环巴胺对前列腺增生症大鼠细胞增殖与凋亡的影响
朱文雄, 袁轶峰, 张 熙, 刘 涛, 李 博, 陈其华
(1.湖南中医药大学第一附属医院, 湖南 长沙 4100072.湖南省第二人民医院, 湖南 长沙 410007)
前列腺增生症(Benign prostatic hyperplasia,BPH)是老年男性常见的泌尿道疾病[1],引起下泌尿道症状,如尿频、尿急、排尿等待、排尿无力、尿后余沥不尽等,50岁以上男性发病率接近50%[2],80岁以上男性发病率接近80%[3]。BPH病因目前尚未阐释清楚,新近研究表明其发生与前列腺上皮、间质细胞增殖和凋亡比例失调关系密切。目前BPH的治疗方案包括侵入性手术策略、微波热疗和药理学治疗。随着α受体阻滞剂、5α还原酶抑制剂等药物的应用,使得BPH的非手术治疗成为可能。新近研究发现Hedgehog(Hh)信号通路对胚胎发育、干细胞自稳态、细胞分化、组织极化和细胞增殖等过程起着非常重要的调控作用,众多增生性疾病、肿瘤发生都与该通路的异常密切相关。环巴胺(Cyclopamine)是一种强大的Hedgehog信号通路阻断剂,近年来其对前列腺癌的治疗作用越来越受到大家的关注[4],但其对BPH的干预作用尚不明确。本研究于2020年6月至2021年5月通过构建BPH模型大鼠,观察前列腺细胞增殖与凋亡情况,探讨环巴胺对BPH的干预效果。
1 资料与方法
1.1动物:成年雄性SD大鼠,体重为400g~450g,购自湖南斯莱克景达实验动物有限公司,生产许可证号:SCXK(湘)2019-0006。
1.2主要试剂与仪器:环巴胺,FERMENTEK公司。丙酸睾酮,华中药业股份有限公司。苏木素-伊红,北京索莱宝科技有限公司。蛋白酶K,MB5088,大连美仑生物技术有限公司。枸橼酸,FK-mL2089,上海樊克生物科技有限公司。TUNEL,ZK-8005,北京中杉金桥生物技术有限公司。DAB/H2O2显色液,2014,Invitrogen,上海英骏生物技术有限公司。胎牛血清,FCS500,Excell Bio,上海依科赛生物制品有限公司。MTT溶液,GD-Y1317,上海古朵生物科技公司。二甲基亚砜,D2650,美国sigma公司。蔡司荧光显微镜,Axio Observer A1/D1/Z1,德国。自动酶标读数仪,BS-1101,南京德铁实验设备有限公司。
1.3BPH大鼠模型的构建[5]:先按剂量40mg/kg采用腹腔注射2%戊巴比妥钠的方式进行麻醉,对大鼠皮肤进行消毒,在无菌环境下经阴囊摘除双侧睾丸。术后大鼠恢复7d,于第8天选取已去势且状态恢复较好的模型大鼠,每天按剂量4mg/kg皮下注射丙酸睾酮(将丙酸睾酮溶于植物油中),持续30d。
1.4分组、给药与标本获取:将造模成功的30只BPH大鼠随机分为模型组(BPH组)和环巴胺组(Cyclopamine组),未造模的15只大鼠为正常对照组(Normal组)。Cyclopamine组大鼠按剂量50mL/Kg腹腔注射10μmoL/L环巴胺,1次/d,连续7d;Normal组和BPH组大鼠腹腔注射等剂量生理盐水,1次/d,连续7d。给药结束后,CO2处死大鼠,获得各组大鼠前列腺组织,对每组大鼠进行以下指标的测定。用分析天平测前列腺组织湿重,用容积法测各组大鼠前列腺体积,测前列腺指数(PI),PI=前列腺湿重/体重。所有动物实验均经过相关伦理委员会的批准。
1.5前列腺组织HE染色:取右侧头叶和腹叶前列腺,10%福尔马林固定24h,常规冲水,梯度乙醇脱水,石蜡包埋,连续切片厚5μm,45℃摊片,捞片,60℃烘烤1h后二甲苯脱蜡。水化后常规苏木精-伊红染色,再经梯度酒精脱水、二甲苯透明、中性树胶封片后在蔡司荧光显微镜下观察前列腺组织病理学变化。
1.6TUNEL法检测前列腺细胞的凋亡:将前列腺组织切片放入3% H2O2,室温孵育10min,蒸馏水洗3次,2min/次;蛋白酶K(20μg/mL)37℃消化30min,PBS洗涤3次,2min/次;室温下与3% H2O2作用5min以阻断内源性过氧化物酶活性,PBS洗涤3次,2min/次;加入含0.1% TritonX-100的0.1%枸橼酸混合液,置冰上4min,PBS洗涤3次,2min/次;加50μL TUNEL混合液,37℃反应1h,PBS洗涤3次,2min/次;DAB/H2O2显色液室温作用5min,水洗终止反应,苏木素复染,脱水、透明、封片。光学显微镜下随机采集5个非重叠视野,观察凋亡小体(apoptotic body),检测100个角膜组织中的TUNEL阳性细胞数,取其平均值。凋亡阳性率以单位面积内凋亡细胞数占细胞总数百分比表示。本实验重复三次。
1.7前列腺细胞的提取、培养:取大鼠的前列腺组织,前列腺每叶各取部分,D-Hanks液清洗2次后剪碎,去除肉眼可见的大血管组织,用2%胰蛋白酶室温消化前列腺各叶30min,离心后用0.06% Ⅱ型胶原酶室温消化15min,过滤,取滤液加上皮细胞培养液混匀,接种于包被有纤维连接蛋白的培养瓶内,置于5% CO2、37℃培养箱内培养。每48~72h换液1次。培养液为上皮细胞培养液,加入10%胎牛血清,添加体积比为1∶100的胰岛素-转铁蛋白-硒添加物、0.5μg/L β-内皮细胞生长因子ECGF,100×103U/L青霉素和链霉素双抗。取前列腺移行带组织按上述方法处理,提取培养前列腺间质细胞。
1.8MTT法检测前列腺细胞增殖:取对数生长期的前列腺上皮细胞和间质细胞,用含10%胎牛血清的RPMI 1640培养基制备成2.5×105个/mL的细胞悬液,接种到96孔培养板。根据实验分组,每组各设8孔,每孔100μL,置于37℃、5% CO2细胞培养箱中培养,分别于培养1d、2d、3d、4d、5d时取出培养板,每孔加入5g/L MTT溶液10μL继续培养4h后,将每孔中的上清液吸出,在无光的环境下每孔加100μL二甲基亚砜,轻轻振荡混匀10min,使其充分溶解由活细胞产生的甲瓒晶体,加入自动酶标读数仪490nm处测定各孔吸光度(OD)值。每次实验重复3次,以时间点为横坐标,OD值为纵坐标绘制细胞活力曲线图。
1.9统计学分析:所有数据均应用SPSS21.0统计学软件进行处理,计量资料采用均值±标准差的形式表示,两组间比较为t检验,多组间的比较应采用单因素方差分析。两变量相关性采用Pearson相关性分析。P<0.05表示差异具有统计学意义。
2 结 果
2.1各组大鼠前列腺组织湿重、体积、前列腺指数:三组大鼠前列腺组织湿重、体积、前列腺指数如表1所示。与Normal组相比,BPH组和Cyclopamine组湿重、体积及前列腺指数显著升高,具有统计学差异(P<0.05)。Cyclopamine组与BPH组相比,Cyclopamine组湿重、体积及前列腺指数显著降低,具有统计学差异(P<0.05)。
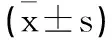
表1 各组大鼠前列腺组织湿重体积前列腺指数
2.2前列腺组织病理学检查结果:前列腺组织HE染色结果如图1显示:Normal组样本光镜下可见腺上皮细胞排列整齐,多呈单层柱状或立方型,分泌物少,表面光滑,腺上皮细胞核圆形,位于基底部,核仁明显,腺体大小一致、排列清晰,腺腔无扩张;BPH组样本光镜下可见腺上皮呈乳头状增生同时向腺腔内突出,呈现为锯齿状,腺上皮细胞呈高柱状、复层,间质和血管扩张,伴随出现充血、水肿,腺体数量多,排列密集,部分腺体扩张,腺腔变大;Cyclopamine组样本光镜下腺上皮细胞多为单层柱状,间质和血管扩张充血、水肿较轻,小部分腺腔变大,腺体少数增生,排列整齐,少部分呈乳头状突入腔内。
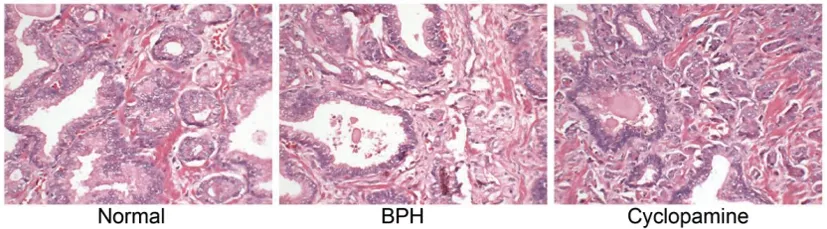
图1 前列腺组织病理学观察(HE染色×400)
2.3TUNEL法检测前列腺细胞凋亡结果:TUNEL染色在光学显微镜下的观察结果如表2、图2所示:与Normal组相比,BPH组和Cyclopamine组凋亡小体表达率明显降低,差异有统计学意义(P<0.05);与BPH组相比,Cyclopamine组凋亡小体表达率明显上升(P<0.05),说明环巴胺能上调前列腺增生中凋亡小体的表达。
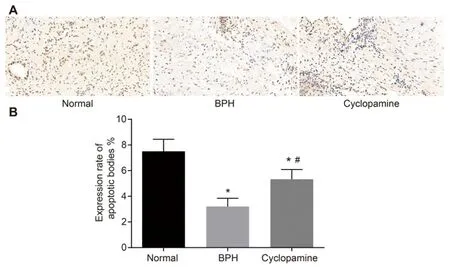
图2 TUNEL法染色结果及凋亡小体表达率注:A:TUNEL染色(×400);B:凋亡小体表达率结果。与Normal组比较,*P<0.05;与BPH组比较,#P<0.05。
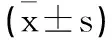
表2 各组大鼠前列腺细胞凋亡情况
2.4MTT法测前列腺上皮和间质细胞增殖能力结果:MTT法测前列腺间质和上皮细胞的结果如表3及图3A-B所示,前列腺间质细胞增殖能力的变化(图3A);上皮细胞增殖能力的变化(图3B)。与Normal组相比,BPH组和Cyclopamine组细胞增殖速率明显增高,差异具有统计学意义(P<0.05);与BPH组相比,Cyclopamine组细胞增殖速率明显降低,差异具有统计学意义(P<0.05)。说明环巴胺能够抑制前列腺间质和上皮细胞的增殖,降低其细胞增殖速率。细胞计数法记录前列腺中间质和上皮细胞的细胞数量的变化(表4及图3C-D)。三组细胞中的间质细胞和上皮细胞的变化与MTT法测细胞增殖的变化趋势基本一致。
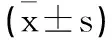
表3 各组大鼠前列腺上皮和间质细胞增殖情况
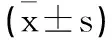
表4 各组大鼠前列腺上皮和间质细胞增殖情况
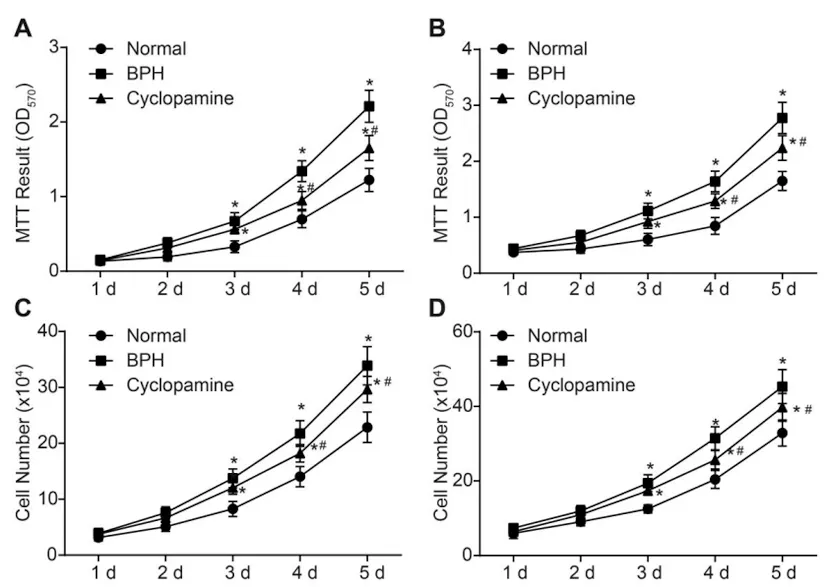
图3 MTT法测细胞增殖能力及细胞计数法测细胞数量
3 讨 论
BPH被认为是老年男性最常见的疾病之一,其病理特点为平滑肌以及前列腺过渡区内的上皮细胞增殖。是一种简单的微小结节性增生,并逐渐发展成为肉眼可见的结节性肿大,并且还可引起尿路症状[6]。由于BPH的发病机制不甚明了。目前BPH的治疗包括经尿道前列腺切除术,药物治疗和植物疗法等[7]。在BPH的研究探索过程中,一些学者提到BPH是上皮和前列腺间质之间由胚胎诱导的相互作用重新唤醒的结果,上皮细胞和间质细胞被发现在BPH的发病中具有重要意义[8]。
刺猬蛋白(Hedgehog)是指在胚胎发育期间首次在果蝇中检测到的一组蛋白质[9]。Hedgehog信号通路被证实是在胚胎组织构建过程中组织细胞增殖和分化的重要参与者,能够导致肿瘤侵袭和转移,该信号通路一旦被激活就可以对包括前列腺癌、胰腺癌和胃癌在内的疾病的发生以及发展产生积极影响。有研究报道了前列腺癌中Hedgehog信号通路的激活[10]。此前,大量研究建立了环巴胺和Hedgehog信号通路之间的密切联系[11]。作为Hedgehog信号通路的抑制剂,环巴胺在抑制前列腺癌和提高生存率方面起着至关重要的作用[12],其能特异性地与膜蛋白受体Smo结合,抑制该蛋白的活性,从而阻断Hedgehog信号向核转录因子Gli及下游靶基因传导。前列腺癌和BPH同属前列腺细胞过度增殖性疾病,而Hedgehog信号通路在前列腺细胞的生长中已经被证明是正调节剂和增殖刺激物。因此我们认为环巴胺很可能能够抑制前列腺细胞的增生。为了了解它在调节BPH中的功能和作用,本研究探索了环巴胺对BPH大鼠前列腺上皮和间质细胞增殖与凋亡的影响。
研究结果表明,环巴胺能够降低BPH大鼠的前列腺湿重、体积和前列腺指数,且对前列腺增生组织的病理形态有改善作用。就BPH的病理特征而言,通常可以观察到过渡区以及尿道周围区域内的上皮和纤维肌肉组织的结节性过度生长。腺体增生和间质增生都可以促进前列腺体积和重量的增加。BPH模型大鼠确实显示了较高的前列腺体积和湿重,再结合HE染色结果,我们考虑环巴胺可能可以抑制BPH。我们的研究还显示,环巴胺能够抑制BPH大鼠前列腺组织的细胞增殖和促进细胞凋亡。尽管发病机理不明确,但BPH的发展与间质和上皮细胞凋亡的减少密切相关。在前列腺细胞的生长中,Hedgehog信号通路已经被证明是正调节剂和增殖刺激物。一旦被环巴胺抑制,Hedgehog信号通路可导致更多细胞凋亡,引发间质和上皮细胞总量的下降,从而阻抑BPH的进展。因此,我们认为环巴胺能够减少BPH大鼠前列腺上皮和间质细胞的增殖并促进细胞的凋亡,其通过阻断Hedgehog信号通路抑制BPH进展的具体机制还有待进一步的研究去阐明。环巴胺具有较强的抑制BPH细胞增殖和促进细胞凋亡的作用,但费用目前较为昂贵、给药方式比较单一、毒副作用尚不明确,其发展成为一种治疗BPH的新药还有很长的路要走。

