Ⅰ型大麻素受体对脊髓损伤小鼠和小胶质细胞活化的影响
安 康, 马正良
(南京大学医学院附属鼓楼医院, 江苏 南京 210008)
脊髓损伤是临床上常见的神经损伤疾病,以运动功能受损和肢体感觉障碍为主要临床表现,常见于暴力打击、血肿和肿瘤等。脊髓损伤恢复较慢,若治疗不当,可引起肢体瘫痪,造成患者严重残疾[1]。I型大麻素受体(cannabinoid 1 receptor,CB1R)广泛分布于中枢和外周神经系统,通过调制神经元和小胶质细胞的活性,参与认知、记忆、感觉和行为控制等活动[2]。研究表明,CB1R在脑卒中、痛觉过敏、抑郁和阿尔兹海默症等神经疾病中发挥重要作用[3]。然而,CB1R在脊髓损伤中的作用鲜有报道。因此,本研究构建小鼠脊髓损伤模型,探讨CB1R受体激动剂HU-210的神经保护作用及其机制,以期为脊髓损伤的临床治疗提供新思路。
1 材料与方法
1.1实验材料和试剂:36只SPF级雌性C57/B6小鼠,8~12周龄,由南京大学模式动物研究所提供,许可证号:SYXK(苏)2019-0056。HU-210购自美国Sigma公司。白细胞介素(IL)-6、IL-17和肿瘤坏死因子(TNF)-α酶联免疫吸附实验(ELISA)试剂盒购自美国eBioscience公司。钙离子结合调节因子(IBA)-1、ED-1抗体、髓鞘碱性蛋白(MBP)抗体、脑源性神经营养因子(BDNF)抗体、神经生长因子(NGF)抗体和β-肌动蛋白(β-actin)抗体购自美国Abcam公司。
1.2模型建立与动物分组:待小鼠适应性生活1周,随机数字表法将其分为3组:对照组、模型组和药物组,每组各12只小鼠。根据改良Allen's法,利用雌性C57/B6小鼠构建脊髓损伤模型[4]。具体方法如下:1%戊巴比妥钠腹腔注射麻醉小鼠,分离棘突附着肌肉,充分暴露T9~T11节段脊髓,Allen's打击器从3cm处自由落体,击打脊髓。若小鼠出现痉挛性摆尾,双后肢迟缓性瘫痪,脊髓组织肿胀明显,提示造模成功。对照组仅暴露脊髓,不进行击打。药物组小鼠在造模前30min灌胃30mg/kg HU-210,此后每天在同一时间点灌胃30mg/kg HU-210,连续14d。
1.3行为学评分:分别于术后第1天、第7天和第14天,利用BMS评分和改良Rivlin斜板实验进行行为学评价。BMS评分方法如下[5]:将小鼠置于特制的旷场内自由活动,观察小鼠5min内后肢踝关节活动度和协调性、尾巴姿态及躯体稳定性。依据具体情况进行评分,计为0~9分,评分越低,则说明运动功能障碍越重。改良Rivlin斜板实验方法如下[6]:将小鼠置于一块粗糙、平坦的斜板上,斜板由水平面开始缓慢上升,待小鼠不能停留原有位置而开始跌落时,停止移动斜板,记录此时斜板的倾斜度数。上述实验均重复3次,取均值。
1.4血清学检测:造模第14天后将小鼠固定在特定容器中,暴露鼠尾,尾静脉穿刺抽取静脉血0.2mL,置于离心机中离心,离心后吸取上层血清,按照试剂盒说明书操作,ELISA法检测各组小鼠血清IL-6、IL-10和TNF-α含量。
1.5取材:采血后处死小鼠,取出损伤处脊髓组织。随机选取6只小鼠脊髓组织,直接置于液氮中,之后转移至-80℃冰箱中保存,用于Western blotting检测。另6只小鼠的脊髓组织,放入10%福尔马林中固定48h,用于病理学检测。
1.6Western blotting检测:从-80℃冰箱中取出脊髓组织,加入200μL裂解液提取总蛋白,BCA法测定总蛋白浓度并进行定量处理。按照20μg/孔进行凝胶电泳,转膜后加入封闭液封闭1h,分别加入MBP一抗(1∶1000稀释)、BDNF抗体(1∶1000稀释)、NGF抗体(1∶1000稀释)和β-actin抗体(1∶3000稀释),4℃孵育过夜。漂洗后加入二抗室温孵育1h,进行化学发光显影,以β-actin抗体为内参,分析目的蛋白的表达。
1.7病理学检测:将小鼠脊髓进行石蜡包埋后切片,脱蜡入水后进行抗原修复,加入封闭液封闭1h。冲洗切片后分别滴加IBA-1一抗(1∶200)和ED-1一抗(1∶200),),4℃孵育过夜。漂洗后加入荧光二抗,室温孵育2h后DAPI复染细胞核,封闭、固定后拍片。
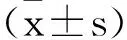
2 结 果
2.1BMS评分比较:与对照组比较,模型组小鼠术后BMS评分明显降低,差异有统计学意义(P<0.05);与模型组比较,药物组小鼠术后BMS评分明显升高,差异有统计学意义(P<0.05)。见表1。
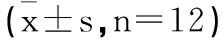
表1 各组小鼠BMS评分比较
2.2Rivlin斜板实验结果比较:与对照组比较,模型组小鼠术后斜板倾斜度明显降低,差异有统计学意义(P<0.05);与模型组比较,药物组小鼠术后斜板倾斜度明显升高,差异有统计学意义(P<0.05)。见表2。
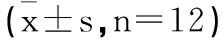
表2 各组小鼠Rivlin斜板实验结果比较
2.3Western blotting结果比较:与对照组相比,模型组小鼠脊髓组织MBP、BNDF和NGF蛋白表达均明显升高,差异有统计学意义(P<0.05);与模型组相比,药物组小鼠脊髓组织MBP、BNDF和NGF蛋白表达均进一步升高,差异有统计学意义(P<0.05)。见图1和表3。
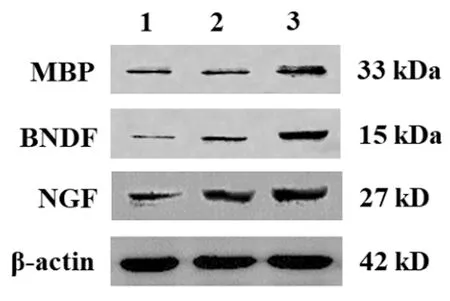
图1 各组小鼠脊髓组织的免疫印迹图片
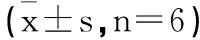
表3 各组小鼠脊髓组织蛋白的表达水平比较
2.4血清炎症因子表达比较:与对照组比较,模型组小鼠血清IL-6、IL-17和TNF-α含量明显升高,差异有统计学意义(P<0.05);与模型组比较,药物组小鼠血清IL-6、IL-17和TNF-α含量明显降低,差异有统计学意义(P<0.05)。见表4。
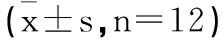
表4 各组小鼠血清炎症因子表达比较
2.5免疫荧光结果比较:与对照组比较,模型组小鼠脊髓组织IBA1/ED1双阳性细胞显著增多,差异有统计学意义(P<0.05);与模型组比较,药物组小鼠脊髓组织IBA1/ED1双阳性细胞显著降低,差异有统计学意义(P<0.05)。见表5和图2。
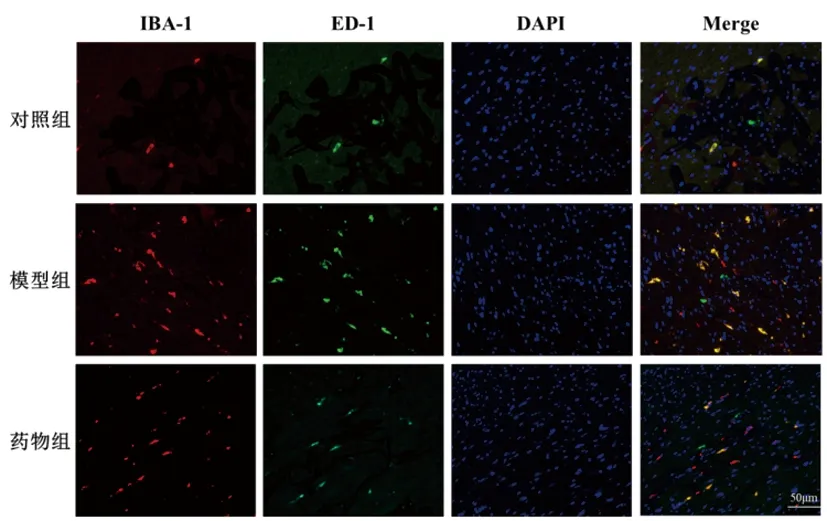
图2 各组小鼠脊髓组织免疫荧光染色结果(放大倍数200×)
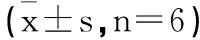
表5 各组小鼠脊髓组织IBA1/ED1双阳性细胞比较
3 讨 论
大麻素受体由2种经典受体CB1R和CB2R组成。其中,CB1R主要分布于中枢神经系统,包括大脑皮质、脊髓、海马和小脑等部位;而CB2R主要分布于造血系统和免疫细胞,神经胶质中亦有少量表达。生理状态下,CB1R通过调制神经元和小胶质细胞的活性,参与认知、记忆、感觉和行为控制等活动。而在病理条件下,CB1R通过抗炎和抗兴奋毒性效应,在脑卒中、痛觉过敏、抑郁和阿尔兹海默症等神经疾病中发挥重要作用[3,4]。研究证实,激活CB1R可降低脑梗死面积和神经功能缺损,改善脑缺血引起的脑损伤。Hughes等研究表明,激活CB1R可减少β淀粉样蛋白沉积,增加海马数量,改善阿尔兹海默症引起的认知功能障碍[3]。
本研究通过腹腔注射特异性CB1R拮抗剂HU-201,探究CB1R在脊髓损伤中的作用。BMS评分和改良Rivlin斜板实验结果表明,给予HU-201可显著改善脊髓损伤小鼠的感觉和肢体运动功能。MBP约占髓鞘蛋白总量的30%以上,是髓鞘的主要构成蛋白[7]。NGF可以营养和促进受损伤神经元的生长,在维持神经系统的稳定方面具有重要作用[8]。BNDF具有促进神经元再生和分化的作用,使受损的神经功能恢复[9]。本研究结果表明,与模型组比较,药物组小鼠脊髓组织MBP、NGF和BNDF蛋白表达均明显升高,提示CB1R可以促进神经元修复,降低脊髓损伤。
研究表明,免疫炎症反应在脊髓损伤过程中具有重要的作用[10]。其中,炎性细胞的聚集、浸润及其释放的炎性介质是导致神经元损伤、坏死和凋亡的重要病理过程[10,11]。作为中枢神经系统内的固有免疫细胞,小胶质细胞参与调控脊髓损伤后的炎症过程。生理状态下,小胶质细胞处于静止状态,通过分泌多种细胞因子,对神经元的正常电活动起到支持、营养和修复作用。当遭受缺血、缺氧、感染和化学物质等病理刺激后,小胶质细胞在数分钟内就可以被激活,并迅速迁移至受损部位[11,12]。研究表明,活化的小胶质细胞可以分泌IL-6和TNF-α等促炎因子,通过上调炎症反应,加重脊髓损伤。此外,抑制小胶质细胞的激活,可减轻炎症反应,发挥脊髓保护作用[12]。
既往研究表明,CB1R在调控小胶质细胞活性和功能方面发挥重要作用[13]。因此,本研究从调节小胶质细胞活化角度,探讨CB1R对脊髓损伤的影响。IBA-1是在小胶质细胞中特异性表达的钙结合蛋白,ED-1是活化小胶质细胞的特异性标记物[13]。因此,本研究利用IBA-1和ED-1双染标记活化的小胶质细胞,结果表明,与模型组比较,药物组小鼠脊髓组织IBA1/ED1双阳性细胞显著降低。此外,药物组小鼠血清IL-6、IL-17和TNF-α含量明显低于模型组,提示CB1R通过抑制小胶质细胞活化介导的炎症反应,发挥脊髓保护作用。
综上所述,CB1R通过抑制小胶质细胞活化和炎症反应,降低脊髓损伤。因此,CB1R可能是临床缓解或治疗脊髓损伤的潜在靶点。

