荧光法测定溶液和食品添加剂中的马来酸
于珊珊, 田 俊
(四川大学化学学院绿色化学与技术教育部重点实验室, 成都 610064)
1 引 言
二酸分子由于其独特的生物学活性以及作为重要生物中间体的合成而备受关注[1,2]. 在常见的二酸中, 马来酸(学名:顺丁烯二酸)及其几何异构体富马酸(反丁烯二酸)是两种重要的二酸结构, 具有巨大的的生物学影响[3]. 它们广泛存在于医药、食品以及聚合物的合成中, 同时也是一种重要的化工原料. 近年来研究发现, 马来酸在三羧酸循环中起着重要的作用, 但过量食用马来酸对肾脏有损害, 并可能导致多种肾脏疾病[4-6]. 因此根据中国现行食品安全标准[7], 禁止马来酸酐和马来酸作为食品添加剂加入食物中. 由于马来酸作为添加剂可以使得淀粉等面制品的光泽度提高且黏性和弹性增加, 从而它被不法商家所利用. 在我国, 2010年长春, 2011年广西, 以及2013年台湾均发生过大规模非法添加马来酸在淀粉中的事件, 给人们的健康造成了不利影响和伤害.
目前, 马来酸的检测主要依赖于离子色谱法[8]、高效液相法[9]以及气相色谱-串联质谱法[10]等. 这些方法均依赖于昂贵的仪器设备, 且样品制备繁琐、操作过程复杂, 在一定程度上增加了检测的难度, 限制了大批量快速检测. 而荧光法具有灵敏度高、测定快速、检测方式多样化、可以实现在线实时检测等优点, 因此此方法得到了科学家的青睐. 近年来, 荧光法在化学、生物及医学领域迅猛发展, 取得了优异的效果[11-13].
我们之前报道的一类基于联萘醛结构的探针1[14]对手性谷氨酸和天冬氨酸有良好的化学选择性和对映选择性, 且对部分二酸化合物有一定的荧光增强. 本文对探针1与马来酸反应后的荧光进一步研究, 并将其应用于淀粉中马来酸的检测.

图1 探针1Fig.1 Probe 1
2 实 验
2.1 仪器与试剂
本文所用药品均来自安耐吉化学试剂供应商, 且使用前未做特殊处理. 所有用于测定荧光光谱的溶剂均为色谱纯, 来自Fisher公司. 荧光光谱仪:日立F7000(HITACHI). 核磁:Bruker AV-400核磁共振仪 (1H: 400 MHz, 0.5% TMS为内标). 化合物1参照文献[14]的方法合成.
2.2 核磁滴定实验
称取化合物1(1 mg)于核磁管中, 另分别称取马来酸(1.9 mg)和富马酸(1.9 mg)分别加入不同的核磁管中, 加入氘代溶剂定容至500 μL, 混合均匀后, 室温放置2 h后进行核磁氢谱的扫描.
2.3 荧光测试
2×10-3mol/L 的化合物1的CH2Cl2溶液和二酸的甲醇溶液均为每次实验现配. 在10 mL试管加入2.5 mL的甲醇溶液, 用微量注射器加入25 μL的化合物1 (2×10-3mol/L), 再加入所需当量的二酸客体溶液(0.10 mol/L, MeOH). 将反应液置于室温下反应一定时长后进行荧光测定. 所有样品的荧光光谱测定总时间不超过2 h.
3 结果与讨论
3.1 核磁滴定
我们考察了在不同氘代溶剂中, 化合物1与马来酸和富马酸的核磁情况. 如图2所示, 在氘代二甲基亚砜、丙酮和乙腈中, 化合物1的醛基信号峰δ=9.53与顺丁烯二酸作用后没有任何变化, 表明其与二酸均不发生反应. 在氘代甲醇中, 加入马来酸后,δ=9.53处的信号峰消失, 在δ=4.75处产生新的信号峰, 这表明羧基与醛基形成对称的半缩醛结构. 在加入富马酸的溶液中, 醛基信号峰δ=9.53没有完全消失, 在δ=4.75处的新的信号也比较弱, 表明没能形成稳定的半缩醛结构. 这与我们之前的报道[14]一致, 醇类溶剂有利于这一反应的进行, 核磁滴定实验也表明了这一点.
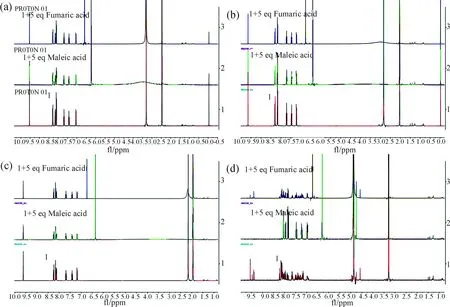
图2 化合物1与马来酸和富马酸在不同氘代溶剂中的反应: (a) DMSO-d6; (b) Acetone-d6; (c) MeCN-d3; (d) MeOH-d4Fig.2 The reaction of compound 1 with maleic acid and fumaric acid in different deuterated solvents: (a) DMSO-d4; (b) Acetone-d6; (c) MeCN-d3; (d) MeOH-d4
3.2 荧光实验
3.2.1 反应时间和反应当量比考察 在2.5 mL甲醇中加入化合物1 (2.0 mmol/L)与马来酸和富马酸(10 equiv), 分别反应不同时间后进行荧光测量.如图3a, 3b所示, 随着时间增加, 荧光强度逐渐增加, 在240 min后达到稳定, 表明反应达到平衡, 后续测量均在反应240 min后进行.
不同当量的马来酸与化合物1反应的荧光效果如图3c, 3d所示.随着马来酸量的增加, 荧光强度稳定增加.在马来酸当量大于等于10 equiv后, 荧光强度保持稳定,表明这一反应的稳定性, 不会随着后续马来酸的过量加入而破坏反应平衡.因此其具有较好的应用前景.
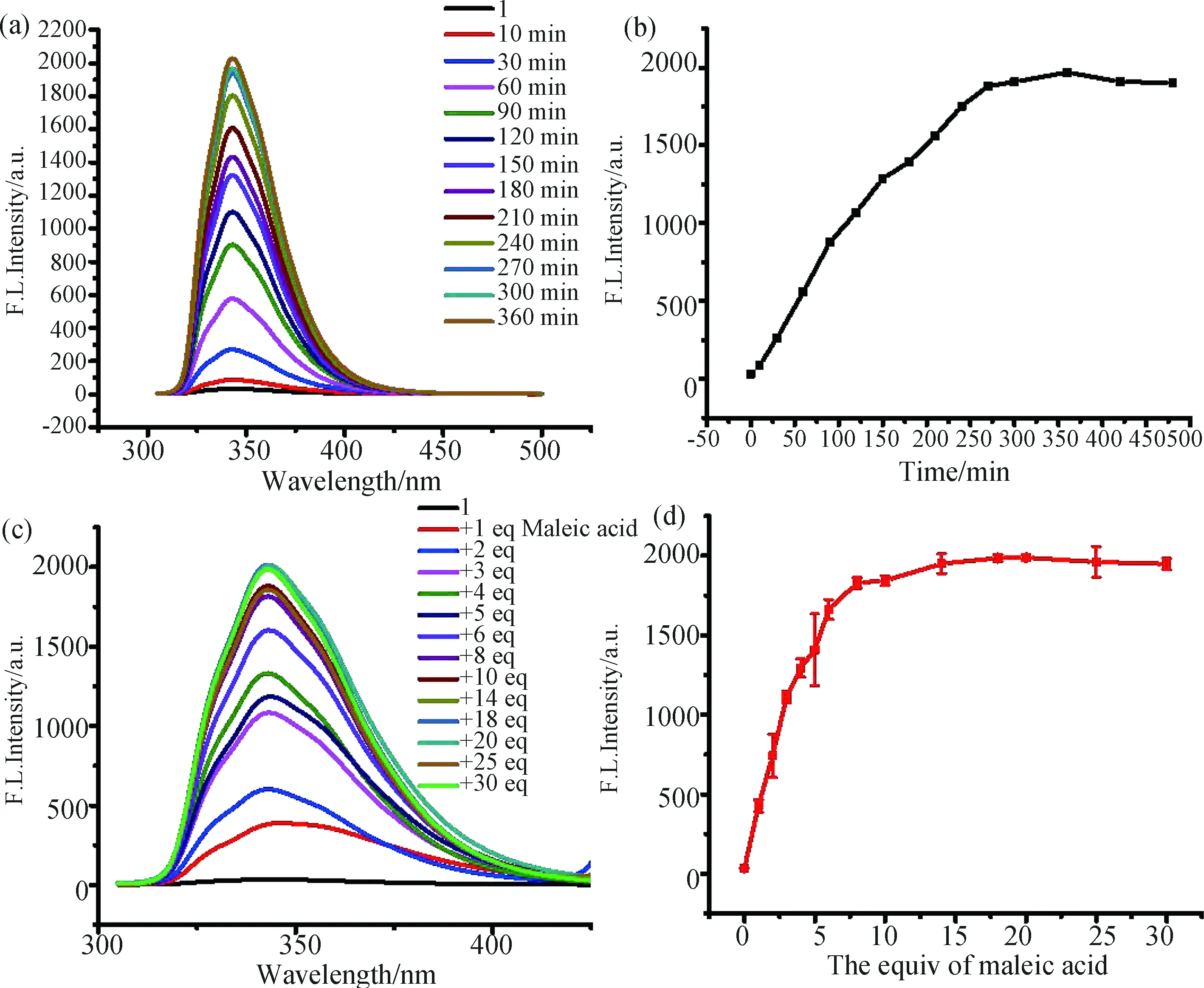
图3 (a) 化合物1(2.0 × 10-5 mol/L)与马来酸(10 equiv) 在10, 30, 60, 90, 120, 150, 180, 210, 240, 270, 300和360 min时的荧光图谱; (b) 化合物1(2.0 × 10-5 mol/L)与马来酸(10 equiv)在350 nm处的荧光强度;(c)化合物1(2.0×10-5 mol/L)与马来酸(0~30 equiv)反应的荧光光谱; (d) 化合物1(2.0 × 10-5 mol/L)与不同当量的马来酸在350 nm处的荧光强度误差线通过3次独立实验测定. 溶剂: MeOH∶DCM=99∶1, v/v. λexc = 285 nm, slits = 5/5 nmFig.3 (a) Fluorescence spectra of compound 1 (2.0 × 10-5 mol/L) with 10 equiv of maleic acid at 10, 30, 60, 90, 120, 150, 180, 210, 240, 270, 300 and 360 min; (b) fluorescence intensity of compound 1 (2.0 × 10-5 mol/L) with 10 equiv of maleic acid at 350 nm; (c) fluorescence spectra of compound 1 (2.0 × 10-5 mol/L) with 0~30 equiv of maleic acid; (d) fluorescence intensity of compound 1 (2.0 × 10-5 mol/L) versus the equivalence of maleic acid at 350 nmThe error bars were obtained with three independent measurements. Solvent: MeOH∶DCM=99∶1, v/v. λexc = 285 nm, slits = 5/5 nm
3.2.2 检测限计算 化合物1与低当量马来酸作用时荧光强度的急剧线性增长表明可以在低浓度下进行检测. 接下来, 我们就化合物1对马来酸响应的检测限做了考察.检测限的计算根据公式:LOD=3δ/S,其中δ为测量10次空白样品的标准偏差值,S为得到的浓度与荧光强度滴定曲线拟合的线性关系的斜率. 为了计算结果的准确, 选取荧光强度变化明显, 马来酸在0~10 mmol/L时的荧光强度进行考察. 如图4所示, 随着马来酸的加入, 荧光强度呈线性增长, 且线性关系良好.通过拟合的线性直线的斜率以及空白探针样品测量10次得到的标准偏差值即可计算得到检测限. 通过计算可得探针1对马来酸的最低检测浓度可达1.3×10-7mol/L. 这一检测浓度达到百纳摩尔级别, 由此可见该探针具有较高的灵敏度, 具有较大的实际应用潜能.
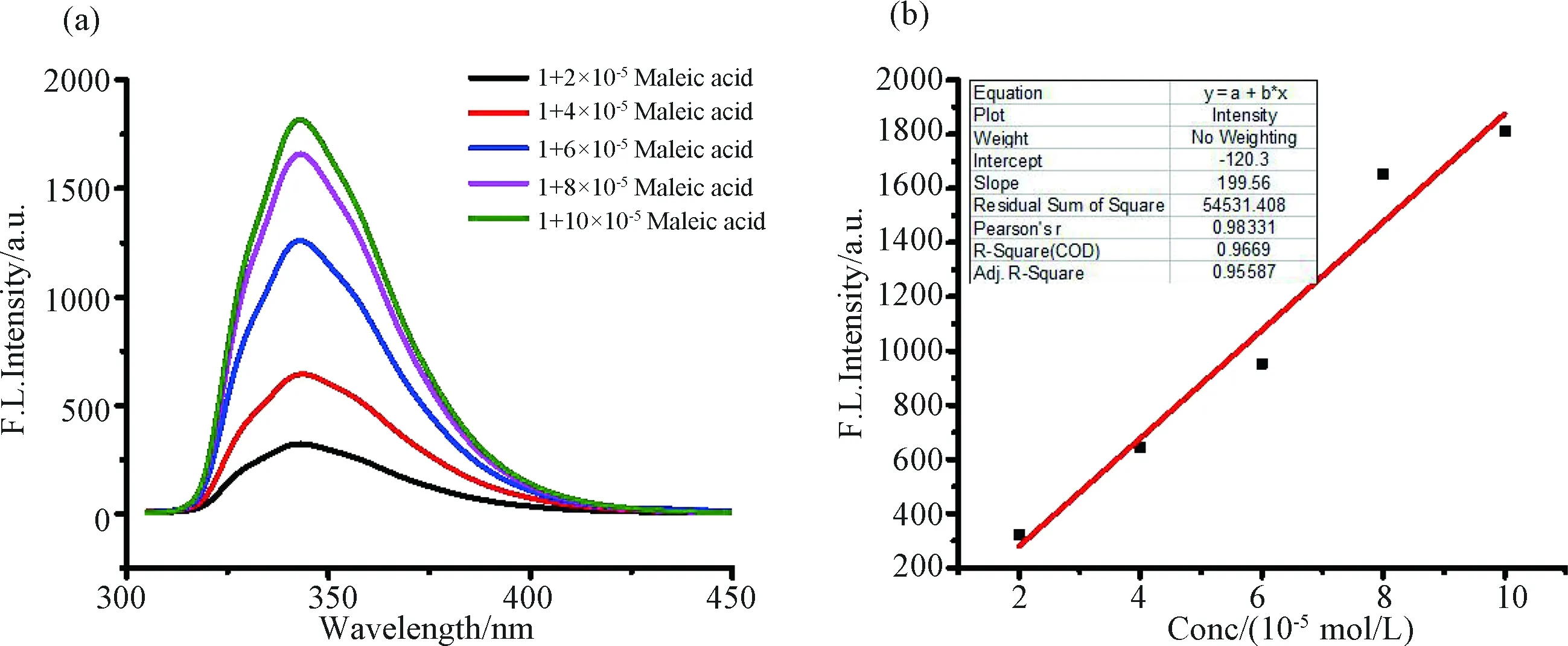
图4 化合物1(2.0×10-5 mol/L)对0~10 mmol/L的马来酸的 (a) 荧光滴定; (b) 350 nm处荧光强度的线性拟合图溶剂: MeOH∶DCM=99∶1, v/v. λexc = 285 nm, slits = 5/5 nmFig.4 The fluorescence spectra (a) and fluorescence intensity at 350 nm (b) of compound 1 (2.0 × 10-5 mol/L) with 0~10 mmol/L of maleic acidSolvent: MeOH∶DCM=99∶1, v/v. λexc = 285 nm, slits = 5/5 nm
3.2.3 干扰实验 抗干扰能力也是衡量一个荧光探针重要的指标.我们之前报道了化合物1对23种二酸的荧光响应, 化合物1对马来酸有着优异的选择性[14]. 在此基础上, 本文分别考察了其余22种二酸对化合物1与马来酸荧光响应的干扰. 在化合物1中分别加入马来酸(6 equiv)和其余二酸(4 equiv),反应后的荧光结果如图5所示.相比于化合物1与马来酸, 加入其余二酸后几乎没有大的荧光变化, 表明了化合物1对马来酸识别的稳定性, 也进一步表明了其实际应用的价值.
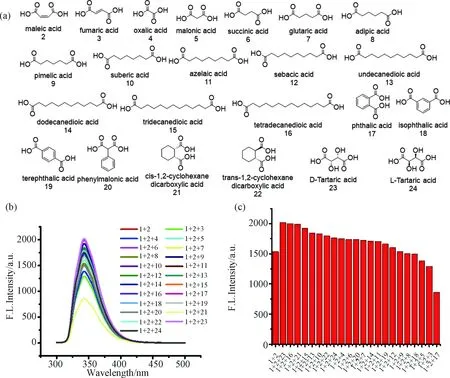
图5 (a) 测试的23种二酸的结构式; (b) 化合物1(2.0 × 10-5 mol/L)与马来酸(6 equiv)在其他二酸存在时的荧光光谱; (c) 350 nm处荧光强度的柱状图溶剂: MeOH∶DCM=99∶1, v/v. λexc = 285 nm, slits = 5/5 nmFig.5 (a) The structural formula of 23 diacids tested; (b) compound 1 (2.0 × 10-5 mol/L) and the fluorescence spectrum of maleic acid (6 equiv) in the presence of other diacids; (c) the bar graphs of the fluorescence intensity at 350 nmSolvent: MeOH∶DCM=99∶1, v/v. λexc = 285 nm, slits = 5/5 nm
3.3 淀粉样品中马来酸的检测
我们将这一检测体系拓展到淀粉样品中的马来酸检测. 分别取3份40 g玉米淀粉放入100 mL烧瓶, 一份作为空白对照, 其余两份分别加入0.40 g马来酸和富马酸. 然后向3份样品中加入80 mL甲醇, 搅拌24 h后过滤掉不溶的固体, 取1 mL滤液与1 mL 化合物1(0.86 × 10-3mol/L)二氯甲烷溶液混合反应2 h后, 用甲醇稀释到2× 10-5mol/L后进行荧光测定. 如图6所示, 化合物1与二酸反应后, 与马来酸作用表现出明显的强荧光信号, 富马酸和空白对照几乎没有荧光增强. 因此可以很好地通过荧光法来对富含淀粉食物中的马来酸添加剂进行检测.
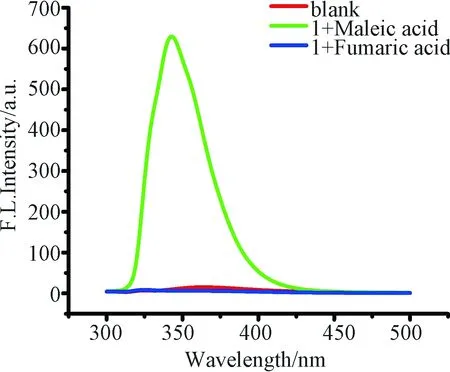
图6 荧光光谱法测定淀粉食物中的马来酸Fig.6 Determination of maleic acid in starch food by fluorescence spectroscopy
4 总 结
我们对已有的化合物1与马来酸反应的荧光条件细化筛选, 考察了反应时间和当量比. 低的检测限表明探针具有高的应用潜能, 优异的抗干扰能力和对淀粉样品中的马来酸添加剂有效的检测进一步表明其实用价值. 总之, 我们开发了一种利用荧光法高效检测食品添加剂中马来酸的方法.

