微生物消毒剂抗性机理*
张可玟 胡 泓 陈 刚
(1)中国海洋大学环境科学与工程学院,青岛 266100;2)中国海洋大学海洋生命科学学院,青岛 266003)
消毒剂是一类可用于物体表面以及空气、水等传播介质中抑制或杀死微生物的化学物质,科学合理使用消毒剂能有效切断病原微生物传播途径[1]。消毒剂不仅应用在医疗、卫生防疫方面[2‑3],同时也广泛应用于食品加工[4‑5]、水处理[6]、环境[7]、工业[8]、农牧渔业[9‑10]等各行业,在维护公共卫生、保障食品安全、保护生态健康等方面发挥着至关重要的作用。近来,严重急性呼吸系统综合征冠状病毒2 引起的全球新型冠状病毒肺炎(COVID‑19)疫情大流行[2],消毒剂的使用量激增,消毒剂使用不规范的现象频发[11]。虽然目前有少数研究发现,与微生物对抗生素的抗性类似,长期不合理使用消毒剂,也会造成微生物对消毒剂产生抗性[12‑13],但抗性基因这种新型基因污染物的产生机制和传播风险仍亟待阐释和解决。本文对微生物消毒剂抗性机制、抗性基因的产生及传播等相关研究进行了阐述和归纳,为进一步研究提供参考。
1 消毒剂种类
根据消毒剂的化学成分,常用的消毒剂主要可分为以下几大类,即含氯消毒剂、过氧化物类消毒剂、醛类消毒剂、醇类消毒剂、酚类消毒剂、含碘消毒剂、环氧乙烷、双胍类消毒剂、季铵盐类消毒剂、重金属盐类消毒剂等。消毒剂的作用机制包括多种物理作用和化学反应,不同消毒剂有不同的使用范围。常见的消毒剂种类、具体举例、作用机制和主要应用详见表1。

Table 1 Types,action mechanism and main applications of disinfectants[2,14]表1 消毒剂的种类及其作用机制和主要应用[2,14]
根据杀菌水平,消毒剂可分为高效消毒剂、中效消毒剂和低效消毒剂,对不同微生物的杀灭作用也有差异[14]。例如次氯酸盐和酒精是针对COVID‑19 防控的常用高效消毒剂,而氯己定、苯扎氯铵对冠状病毒杀灭效果较差[15]。消毒剂的消毒效果与有效成分相关,另外pH、温度、盐度、有机物等环境条件都会影响消毒剂的使用效果[16]。使用消毒剂时,应根据消毒剂种类合理选择使用方式,根据清洁和污染程度配制有效成分浓度、控制消毒作用时间[14]。
2 微生物对消毒剂的抗性机制
微生物对消毒剂的抗性是指微生物个体或种群,在标准化的定量杀灭试验中,表现出比标准试验菌株和群体明显更低的微生物减少量[17]。一般可采用最低抑菌浓度(minimum inhibitory concentration,MIC)测定、定性悬液试验、定量悬液试验和载体试验等方法评价消毒剂的杀菌效果[18]。如果清洁方式不规范、浓度或剂量不足、处理时间不够或长期使用一种消毒剂,会给微生物创造良好的适应条件[19]。另外,消毒剂由于长期或过量使用,经稀释残留进入环境,可能对环境微生物生态多样性产生影响。微生物会通过表型适应、基因突变和水平基因转移等方式提高对消毒剂的耐受性或产生抗性基因。例如,Kampf[20]发现在低浓度苯扎氯铵暴露下,多种微生物适应后MIC值增加4 倍,鼠伤寒沙门氏菌达3 000 mg/L、铜绿假单胞菌达2 500 mg/L、肠杆菌属达1 500 mg/L、大肠杆菌属达1 000 mg/L,并且这种抗性能够稳定遗传[20]。一些消毒剂的副产物也会诱导微生物产生抗性,比如具有诱变活性的二溴乙酸、二氯乙腈、溴酸钾和3‑氯‑4‑(二氯甲基)‑5‑羟基‑2(5H)‑呋喃酮(MX)等典型消毒副产物可诱导抗生素抗性,甚至产生多药耐药现象[6]。
根据目前研究,微生物消毒剂抗性机制基本可分为形成生物膜、降低细胞膜通透性、借助外排泵系统、产生相关特异性酶、改变靶点等几种策略(图1)。在一定环境和选择压力下,消毒剂抗性微生物的抗性基因可通过垂直和水平转移迅速传播,一方面会降低消毒剂的消毒效率;另一方面,这种基因污染物可能对生态环境和人类健康构成严重威胁。在实际环境中,微生物可能会利用多种策略抵抗消毒剂作用。
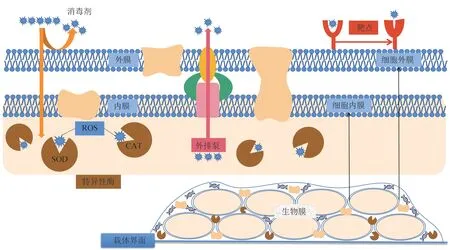
Fig.1 The schematic diagram of disinfectant resistance mechanism图1 消毒剂抗性机理示意图
2.1 形成生物膜
微生物可通过生物膜的形成产生消毒剂抗性。生物膜是微生物及其分泌物积累形成的聚集体,主要由多糖包被分泌物和胞外聚合物组成。生物膜最早发现于17世纪,Van Leeuwenhoek通过改进的显微镜观察到牙齿上的菌斑,而相关理论直到1978年才发展起来[21]。生物膜是相关细胞群落被封闭在含有开放通道的聚合物基质中形成的复杂表面,细胞通常不可逆转地附着在载体界面或彼此之间,嵌在胞外高分子物质基质中,其生长速度和基因转录等方面可以随生物膜外部环境改变而有相应的变化[21]。
消毒剂处理可刺激某些微生物形成生物膜。单核细胞增生李斯特菌在过氧乙酸处理后,容易形成静态和连续流动生物膜,并对氯苯扎和过氧乙酸消毒剂的抗性增高,分析发现消毒剂处理促使与形成生物膜和抗性相关的热激响应转录因子hrcA和分子伴侣dnaK表达增加[22]。在对金黄色葡萄球菌和表皮葡萄球菌的研究中,经乙醇和异丙醇消毒剂处理时比未经处理的对照组呈现出更高的生物膜水平,且消毒剂浓度越高,生物膜的形成率越高[23]。另一研究用乙醇处理金黄色葡萄球菌后,与生物膜形成相关的基因icaA和icaD转录水平显著提高,这些基因的表达有助于细胞间多糖黏附素生成而形成生物膜,同时分析还发现一些与抗生素抗性相关的基因表达也增高了[24]。
研究表明,生物膜强弱与抗性高低呈正相关。含氯消毒剂常用于水处理工艺,反渗透膜中的嗜酸杆菌、沙单胞菌和假单胞菌等耐氯细菌能通过建立稳定的生物膜抵抗氯气的威胁,导致含氯消毒剂处理的反渗透膜生物污染加重,进一步通过宏基因组学关联分析显示,消毒剂抗性与生物膜菌群的群体感应基因、胞外多糖合成基因和氨基酸合成基因表达高度关联[25]。Ribic等[8]在对常规消毒处理的超净间内微生物进行生物膜、消毒剂抗性及相关基因的调查中,采用实时定量PCR 检测发现,95%的葡萄球菌具有生物膜相关基因icaA、aap、bhp,它们是对季铵盐消毒剂产生抗性的遗传基础;而刚果红琼脂法检测出40%的菌株形成生物膜,结晶紫染色法确定16%的菌株形成强生物膜。分析表明,形成强生物膜有助于菌株增加对氯化双癸基二甲基铵(DDAC)的抗性。
形成生物膜能显著提高微生物消毒剂抗性。首先,生物膜的胞外多糖和蛋白质等聚合基质结构可形成阻力,延迟消毒剂等物质的生物膜基质渗透。与游离细胞相比,生物膜降低了消毒剂对黏附在载体上的大肠杆菌的可及性[26],对消毒剂的敏感性降至游离细胞的1%~4%而表现出抗性的提高[27‑29]。生物膜的结构成分可以与一些消毒剂发生反应或催化氧化还原过程,使消毒剂部分消耗,一些氧化类消毒剂的功效会受多糖、蛋白质和核酸等生物膜基质成分影响而降低杀菌效果[30‑31]。
另外,有些微生物可通过降低生物膜内细胞生长速度的策略来抵抗消毒剂的作用而增加抗性。生物膜内细胞的生长速度明显慢于游离微生物细胞,这种较低的代谢水平使一些消毒剂难以发挥作用[21]。Legner等[32]利用恒化器模型测定生物膜生长速率,发现生物膜的形成越强,微生物生长速度越慢,消毒剂的吸收率与灭活率也越低。另一项研究也发现,大肠杆菌细胞在生物膜中生长缓慢,同时表现出对头孢三胺的高抗性[33]。
此外,生物膜中的革兰氏阴性菌可通过合成调节因子对环境压力作出反应。恶臭假单胞菌的胞外功能σ 因子ECF‑10 有助于生物膜形成和药物外排[34],新月柄杆菌的胞外功能σ 因子σF 调控重金属的应激反应[35],铜绿假单胞菌和荧光假单胞菌可诱导磷酸盐降解、脂质生物合成和多胺生物合成的调节因子,有助于提高生物膜的抵抗力和恢复力,产生对戊二醛的抗性[36]。
一些研究发现,某些种类的病原性微生物能耐受一定剂量的消毒剂而存活,且传染性和致病性提高,可能是长期低水平的消毒处理与微生物的生物膜产生协同效应[19]。一方面,生物膜的细胞和胞外聚合物是一个复杂而紧凑的多层结构,一系列物理化学作用会引发运输限制,使消毒剂很难穿透并到达内层,进而影响消毒功效[37];而另一方面,病原性微生物生物膜的形成,可能更利于病原菌分泌内毒素、分散至宿主体内、增强对宿主免疫系统的抵抗力,这种消毒剂刺激促进生物膜的形成为病原菌提供侵染所需的生态位,可能导致其更易引发疾病,应该引起关注[21]。
2.2 降低细胞膜通透性
细胞膜是限制物质进入细胞的屏障,一些微生物可通过降低细胞膜通透性的策略,减少或阻止消毒剂进入微生物细胞内,提高对消毒剂的抗性。该类微生物的消毒剂抗性主要取决于细胞外膜[38‑39]。具有选择透过性的以磷脂双分子层为骨架的细胞膜结构组分中,蛋白质、磷脂、脂多糖及脂肪酸的结构和组成改变都可能改变细胞膜通透性,进而会影响消毒剂的杀菌效果[16]。
膜蛋白在参与维持细胞膜完整性和选择透过性方面起到重要作用。在消毒剂作用下,其变化可促进微生物存活并增强消毒剂耐受性[38,40]。一方面,增加与细胞膜稳定性和完整性相关的膜蛋白、脂蛋白、结合蛋白等可减少消毒剂的破坏。在戊二醛诱导下,荧光假单胞菌secA、secB、secE、secG、secY、yaiC、yidC、lspA等基因转录上调,Sec 易位酶的增加有利于蛋白质转运系统稳定运转;groEL/groES和dnaK的提高可增加伴侣蛋白GroES/GroEL表达,确保蛋白质适当折叠来维持细胞膜稳定性;编码Tol‑Pal 系统的folQ、tolA上调转录水平,维持细胞外膜完整性,从而保障细胞膜的选择透过性,阻止消毒剂进入[41]。在含氯消毒剂作用下,结合细菌形态、细胞膜破坏、细胞疏水性等分析发现,分枝杆菌细胞膜损伤较轻、膜蛋白疏水性较高,从而产生耐氯性[42]。另一方面,一些膜蛋白功能的缺陷可以降低微生物对消毒剂的敏感性。长期消毒可能导致耻垢分枝杆菌和龟分枝杆菌Msp孔蛋白活性缺陷,对戊二醛和邻苯二甲醛的敏感性降低[43‑44]。Chiu 等[45‑46]发现幽门螺杆菌Imp/OstA蛋白的破坏会降低细胞膜通透性,使其对有机消毒剂的敏感性下降。Machado 等[38]采用蛋白质组学方法研究铜绿假单胞菌对苯扎溴铵氯化物的适应现象,发现抗性作用源于孔蛋白OprF和OprG、脂蛋白OprL 和OprI的表达减少,无法正常维持细胞形状和细胞膜流动性,这种功能缺陷会减少细胞与外界物质交换的通道,可能同时存在适应性和获得性两种抗性。
磷脂、脂多糖等结构和组成也可降低细胞膜通透性,阻挡消毒剂入侵。疏水性消毒剂可由外膜蛋白清除,而亲水性消毒剂可通过膜孔蛋白扩散方式进入微生物细胞膜,但会被脂多糖和磷脂层截留,尤其不易侵入外膜具有不对称脂多糖结构的革兰氏阴性菌[1]。此外,在鼠伤寒杆菌、大肠杆菌和沙门氏菌中,内膜蛋白YejM 依赖镁离子而具有磷酸酶活性,可以调节外膜中甘油磷脂(PL)和脂多糖(LPS)的平衡,从而改变外膜通透性来抵抗消毒剂[47]。
2.3 外排泵系统
与限制消毒剂进入细胞不同,一些抗性微生物面对消毒剂的威胁时,通过外排泵外排策略快速、有效地减少细胞内的消毒剂剂量,从而实现抗性[48]。外排泵是存在于微生物细胞膜上的一类蛋白质,可分为多个膜蛋白家族,包括主要促进因子超家族(MFS)、多药及有毒化合物排出家族(MATE)、小多药耐药家族(SMR)、以质子动力为转运底物的抗性‑结瘤‑细胞分裂超家族(RND)和利用ATP 结合能和水解来运输底物的ATP 结合盒超家族(ABC)[49]。研究肠杆菌选择性TolC 非依赖外排泵时,还发现阳离子扩散促进因子家族(CDF)和蛋白质细菌抗菌复合外流家族(PACE)[50]。外排泵系统的类型十分复杂,表2 列举了不同家族的结构特征和具体种类。
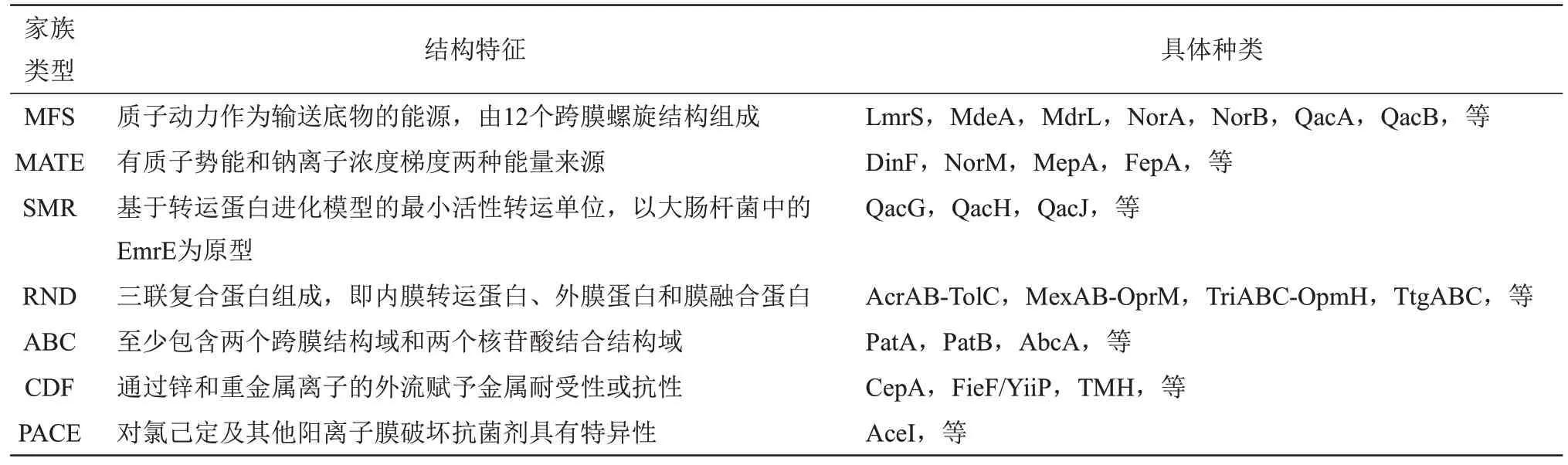
Table 2 Characteristics and types of efflux pump system family[49-53]表2 外排泵系统家族特征及种类[49-53]
外排泵通常由多个系统协同工作,其过度表达可以单独或与其他抗性机制共同作用抵抗消毒剂,避免损伤[1]。根据底物特异性和DNA序列同源性,依赖于质子动力的转运蛋白分为qacA/B和qacC编码的两个家族[54]。常规消毒条件下,一些工业洁净室的表面葡萄球菌具有对二癸基二甲基氯化铵的耐药性,其中超过95%检测出同时具有qacA/B和qacC[8]。对于单独或组合携带norA、qacA和qacC的金黄色葡萄球菌菌株,研究发现携带多个外排泵的菌株抗性更强,预先暴露于苯扎氯铵的菌株会对氯己定有更高的耐受性[55]。
随着研究深入,确定的外排泵相关基因也逐渐完善,基因检测等分子手段常用于抗性机制的研究。Moretro 等[4]发现,qacH和bcrABC赋予单核细胞增生李斯特菌对季铵盐消毒剂的抗性,是编码外排泵系统的决定因子。Meier 等[56]在瑞士和芬兰的大多数苯扎氯铵抗性单核细胞增生李斯特菌中检测到qacH,部分检测到bcrABC。Labreck 等[55]通过对抗性金黄色葡萄球菌的转录分析,发现暴露于苯扎氯铵可以显著诱导qacA和norA的表达,从而增加氯己定耐受性。Hassan等[52]发现编码外排系统相关蛋白AceI的基因可有效诱导鲍曼不动杆菌对氯己定的抗性,采用基因合成方法进行密码子优化,克隆至大肠杆菌的表达系统中,发现包括AceI及其同系物在内的24 个BTP 结构域蛋白中,有87.5%用蛋白质印迹法(Western blot)检测到表达,75%促成了大肠杆菌对一种或多种抗菌药物的抗性。
利血平等外排泵抑制剂可以抑制耐药细菌对药物的外排,从而恢复其对抗生素的敏感性,可以用来确定抗性机制。Jiang等[5]研究零售食品中单核细胞增生菌由外排泵介导的对苯扎氯铵的抗性时,用利血平发现存在质粒基因bcrABC介导和染色体介导的外排泵。Meier 等[56]针对14 株缺乏已知抗性基因的单核细胞增生李斯特菌,加入利血平分析细菌抗性,确定了其中10 株的耐药性部分或完全依赖外排泵。
2.4 抗性相关特异性酶
微生物面对消毒剂的威胁,可通过特异性酶的作用减轻或消除伤害。一方面可能产生针对消毒剂的特异性降解酶,将消毒剂清除;另一方面可能产生具有特定功能的酶,调节自身,增强对消毒剂的耐受性。一些分子伴侣、调节蛋白、辅酶因子等也在其中起到重要作用。
一些种类的消毒剂具有强氧化性,可直接或间接通过活性氧或自由基破坏微生物细胞膜脂系统,使蛋白质和核酸变性来杀死细胞,而微生物细胞的氧化还原系统可产生与之对抗的特异性酶而产生抗性。比如,在含氯消毒剂作用下,铜绿假单胞菌编码烷基氢过氧化物酶AhpD 的rcsA高度表达[57],假单胞菌的抗氧化酶、β 内酰胺酶表达显著上调[7],分枝杆菌的超氧化物歧化酶(SOD)活性提高[42],引发的代谢变化有利于降解次氯酸盐消毒剂。对过氧化氢的抗性与过氧化氢酶‑过氧化物酶有关,这种酶同时具有过氧化物酶活性和过氧化氢酶活性,能够用外部还原剂还原过氧化氢或使其歧化为水和氧,其中KatG 在中性溶液中具有高催化活性[58]。低浓度过氧化氢处理酿酒酵母可促进过氧化氢酶活性的增加[59],铜绿假单胞菌生物膜对氧化剂的抗性也与细胞外基质中的过氧化氢酶等保护酶有关[26],调节蛋白Yap1在此应激效应中发挥着重要作用[60]。Seaver等[61]通过测定总过氧化氢酶活性、过氧化氢酶活性和β‑半乳糖苷酶,发现过氧化氢酶突变体具有快速清除过氧化氢的能力,进一步分析发现保护作用是由烷基过氧化氢还原酶Ahp提供的。
还有一些特异性降解酶或转化酶可增加微生物对多种消毒剂的抗性。比如,甲醛脱氢酶可催化醛的歧化反应,大多依赖谷胱甘肽和辅酶发挥降解作用,可以协助恶臭假单胞菌降解甲醛、乙醛、丙醛等醛类消毒剂[62]。有机汞裂解酶基因merB和汞离子还原酶基因merA由质粒/转座子介导,可编码降解无机和有机汞化合物的水解酶和还原酶,其过度表达可使微生物产生汞抗性[63]。依赖fad的十四烷基三甲基铵单加氧酶(TTABMO)能够通过生理途径氧化季铵盐化合物,催化十四烷基三甲基溴化铵的分解,从而增加恶臭假单胞菌(ATCC 12633)对季铵盐类消毒剂的抗性[64]。
此外,一些微生物会产生特异性酶改变自身特性,间接抵抗消毒剂入侵。一些革兰氏阴性杆菌的特异性磷酸酶YejM 具有依赖于镁离子和活性位点完整性的磷酸酶活性,可以调节外膜的物质组成来诱导抗性[47]。荧光假单胞菌在戊二醛刺激下,可提高蛋白酶ClpB1、HslU的合成,保证受损蛋白质的去除,而且菌株能量生产系统会加强,氧化磷酸化相关的NADH/泛醌氧化还原酶、琥珀酸/泛醌氧化还原酶、泛醌/铁细胞色素c 氧化还原酶、氧/铁细胞色素c氧化还原酶和ATP合成酶上调,三羧酸(TCA)循环相关的丙酮酸脱氢酶、异柠檬酸脱氢酶、酮戊二酸脱氢酶、琥珀酰辅酶A连接酶、琥珀酸脱氢酶、富马酸脱氢酶和铁氧还蛋白也上调,能够增加ATP生成,保障能量供给,增强抵抗消毒剂的能力[41]。
2.5 改变消毒剂作用靶点
微生物可以通过在结合位点或结合位点附近进行突变或酶修饰,使靶点发生物理改变,从而减少与消毒剂的结合。一般来说,消毒剂比抗生素具有更广泛的活性,因为抗生素在细胞内往往具有特定靶点,而消毒剂通常具有多个靶点[5,17]。因此,改变靶点的抗性机制通常存在于抗生素抗性机制中,在消毒剂的抗性机制中则较为少见。
三氯生是一种能够缓慢、可逆、紧密结合大肠杆菌fabI的抑制剂。Sivaraman等[65]研究发现,由fab编码的对三氯生的抗性属于靶点变更,通过诱发突变和氢键检测等手段,确定三氯生对突变体G93V、M159T 和F203L 的亲和力显著降低。Skovgaard 等[66]用DNA 序列分析验证了此机制,发现适应菌株携带编码烯醇酰基载体蛋白还原酶亚型fabI的突变基因,可以增加三氯生的靶点fabI表达,减少三氯生−NAD+−fabI三元复合物的产生。
3 消毒剂抗性相关基因的获得与传播风险
抗性微生物及抗性基因的产生和传播给环境保护、种养殖业、食品安全、卫生防疫以及医院抗感染治疗带来巨大的困难和挑战。微生物的消毒剂抗性可分为固有抗性和获得抗性(acquired resistance),其中获得抗性包括自身突变和外源获得两种途径。
微生物在自然生长及传代过程中会不断发生各种基因突变,在理化因素作用下可能更容易发生突变,但这些自发和诱变产生消毒剂抗性的频率很低。研究发现,低于致死浓度的消毒剂或其消毒副产物可能诱导抗性基因的产生,并使获得抗性相关基因的微生物得以富集。例如,三氯生可诱发大肠杆菌产生多种抗性响应策略,氧化应激可导致fabI、frdD、marR、acrR和soxR等抗性相关基因的突变[67]。当铜绿假单胞菌暴露于亚致死浓度的过氧乙酸时,可诱导产生细胞保护过程的相关基因而产生抗性[68]。金黄色葡萄球菌抗性菌株产生norA、norB、norC、mepA、mdeA、qacA/B等外排泵基因并过量表达[69]。Ortiz 等[70]用微生物全基因组测序(WGS)和电子多位点序列分型分析(MLST)确定了单核细胞增生菌的两个主要抗性类型是prfA突变株S1(ST 31 型)及含抗性转座子Tn6188 的菌株(ST 121型)。
微生物消毒剂性抗基因的获得和转移可由染色体介导,也可由质粒介导。一般来说,染色体介导的抗性基因主要通过传代过程垂直传播或者同种间传播,而质粒介导的抗性更容易引发抗性基因在不同种属间的水平转移而增加抗性及抗性基因的传播风险(图2)。
3.1 染色体介导的消毒剂抗性
微生物染色体基因突变,以及染色体的缺失、插入和取代等染色体变异,都可能使微生物产生对消毒剂的抗性。在季铵盐类消毒剂的压力或诱导下,染色体编码的基因突变可能会触发控制外排泵表达的调节系统、导致外排泵过度表达、提高泵的外排效率等,使适应微生物对季铵盐类消毒剂和外排泵其他底物的耐受性增加2~8 倍[71]。活性氧(ROS)介导的marR、rob、sdiA、cytR和crp的染色体突变等抗性关键决定因素,会导致编码AcrAB‑TolC 泵等多药流出泵系统的基因调控发生变化,可能提高大肠杆菌对环己烷等一些高疏水性有机消毒剂的耐受性[72‑73]。与之类似,过氧化氢能诱导recA控制的抗性,降低大肠杆菌WP2 细胞中醛类消毒剂的杀伤作用,产生交叉适应性反应[74]。另有研究发现,大肠杆菌基因组中的relA、marC、proQ、yfgO和rraA与氨基酸生物合成途径、铁离子稳态和能量代谢相关,5种突变能增加对丙二醇的抗性[75]。单核细胞增生菌也具有染色体介导的外排泵,造成其对苯扎氯铵的抗性,可用外排泵抑制剂利血平证明[5]。
此外,可移动遗传元件(mobile genetic elements,MGE)是微生物获得和传播消毒剂抗性的重要载体,包括质粒、转座子、整合子、插入序列、细菌噬菌体和其他整合性接合元件(ICE)等[76]。MGE可能引起一系列遗传学效应,包括引起插入突变、染色体畸变、产生新的基因变异、调节基因活动等[77]。比如,Petty 等[78]在对一种全球扩散的多重耐药性尿路病原体大肠杆菌分型ST131的研究发现,其每个亚系相关的大多数单核苷酸变异是MGE 相邻区域的重组所致,证明了MGE 和重组在这一抗性病原体进化中的作用。铜绿假单胞菌有巨大的细菌基因组,并能够通过水平基因转移获得大量基因,Botelho 等[76]认为MGE是其产生抗性的重要驱动因素,微生物获得并适应MGE,在共同进化过程中还可能发生一些补偿性突变。ICE可携带编码多种表型的基因,包括对重金属的抗性[79‑80]和降解芳香化合物的能力[81]等,可能整合至微生物的染色体,赋予其相应的抗性。
3.2 质粒介导的消毒剂抗性
质粒是微生物染色体外能够自主复制的另一重要遗传物质,通常呈环状闭合的双链DNA。根据质粒性质和转移特点,质粒可分为接合型和非接合型两类,其中接合型质粒带有转移基因。接合性质粒和ICE 具有接合转移位点oriT、松弛酶(Mob)、IV 型伴侣蛋白(T4CP)和IV 型分泌系统(T4SS)4个转移功能区,具有滚环复制和接合转移等典型单链DNA自行转移特性[82]。微生物对消毒剂抗性可能由质粒介导,质粒中消毒剂抗性基因的存在与菌体MIC 敏感性的降低呈相关性[83]。例如,Littlejohn 等[84]早在1991 年就通过测定2.4 kb 质粒的pSK89全序列,在金黄色葡萄球菌消毒剂抗性株中发现外排泵基因qacC/qacD。Sasatsu 等[85]发现金黄色葡萄球菌对溴化乙锭等消毒剂的抗性与质粒中与qacC、qacD同源的ebr有关,测序发现高抗性菌株的质粒pTZ22 携带的抗性基因ebr加倍,外排泵效率提高了1倍,进一步将此质粒的抗性基因插入到pUC19 并转化到大肠杆菌后,大肠杆菌对戊二醛的抗性提高,MIC 由对照菌株的100 mg/L提高到1 600 mg/L。Leelaporn 等[86]通过DNA‑DNA 杂交分析和表型耐药性研究,检测凝固酶阴性葡萄球菌,发现与抗性相关的多药外排基因qacA和qacC都位于质粒上,qacA位于>10 kb的质粒上,qacC主要位于2~3 kb的质粒上。
获得性抗性基因常借助质粒和ICE 等MGE,通过接合转移等方式在微生物间水平转移。SMR家族的季铵盐类消毒剂专用多药外排泵基因包括emrE、sugE、qacE、qacΔE、qacF、qacG、qacH、qacI、qacJ和qacZ等外排决定基因,这些外排蛋白基因主要位于转座子、ICE、质粒和整合子等流动遗传元件中,可以在同一或不同属的微生物之间水平转移[71]。比如,在肺炎克雷伯菌发现的qacA、qacΔE、qacE、acrA与对戊二醛等消毒剂的抗性有关,可以使细菌对乙醇的MIC 增长为无抗性基因菌株的16 倍,存在于质粒且能够整合至染色体[87]。多数可移动质粒是通过表达Mob 利用接合元件匹配孔的,Mob 作用于质粒的同源oriT[88]。为深度解读海量可移动基因组数据,Li等[89]开发了生物信息学软件oriTfinder,用于快速识别质粒和ICE 序列中的oriT、Mob、T4CP 和T4SS 等接合转移功能模块,构建并提出接合转移、非自主转移和不可转移的质粒等归类方法,可用于分析细菌全基因组序列及批量分析。此类技术的发展和完善将有助于微生物消毒剂抗性基因研究的深入,明确抗性基因的转移方式和路径。
3.3 获得抗性和抗性基因的水平传播
微生物对消毒剂的抗性基因常借助MGE 在微生物间水平转移[90],通过转化、转导、接合转移等方式广泛传播并增加抗性[91‑94]。一些研究证实,消毒剂能够促进质粒携带的抗性基因在不同微生物间转移,而一些抗性基因不易被一般消毒方法除去,这将加剧全球使用消毒剂可能存在的风险[12]。Luprano 等[95]发现,过氧乙酸消毒无法消除环境中ampC、mecA、ermB、sul1、sul2、tetA、tetO、tetW、vanA等抗性基因。此外,细胞内ROS 的形成、SOS反应、细胞膜通透性的增加以及相关基因表达的改变可能增强接合转移。Lu等[96]通过表型实验、全基因组RNA 测序和蛋白质组学分析,发现环境浓度的三氯生暴露可诱导微生物细胞ROS产生量增长至原来的1.3~1.5倍,引起细胞膜损伤,上调外膜孔蛋白翻译,增强一般分泌系统Sec 约1.4倍、双精氨酸转位系统Tat约1.2倍和IV型菌毛分泌系统约2.5 倍,有助于微生物通过菌毛捕获和细胞膜通道的转运等方式获得外源基因,使携带精氨酸合成基因的质粒向大肠杆菌DH5α的转化提高1.4 倍。生物膜的形成会导致微生物群体中出现广泛的遗传多样性,高细胞密度、基质的存在、大量DNA 的释放和生物膜内的营养条件都可能促进接合和转化过程[37]。基因的转移赋予受体新的代谢能力,使之适应新的生态位[91]。
一些消毒方式会对抗性基因的转移有不同程度的影响。通常高剂量的消毒剂会取得更好的灭菌效果,而剂量不足则可能引发抗性扩散的不良后果。用0.2 mmol/L过氧化氢处理耻垢分枝杆菌后的转录分析表明,糖酵解、糖异生和脂肪酸代谢等代谢途径可能参与抗性反应;而7 mmol/L 过氧化氢处理时,编码核糖体的基因的转录水平降低,会影响蛋白质合成装置,减少蛋白质合成,导致细菌生长减少[97]。研究发现,高剂量的紫外线或氯气均可显著抑制精氨酸转移的频率,而低剂量的紫外线消毒和氯化对接合转移有不同影响,紫外线照射只减少细菌数量,不改变细胞通透性,因此影响很小,而氯胺刺激可提高细胞的通透性,细胞表面诱导出的菌毛是精氨酸转移的途径,于是低剂量氯消毒可提高接合转移频率2~5 倍[98]。与之类似,游离氯、氯胺和过氧化氢的亚抑制浓度(低于MIC)导致种内接合转移的频率较对照组增加1.5~7.5 倍、属间接合转移频率较对照组增加1.4~2.3 倍,而高于MIC的消毒剂显著抑制接合转移[99]。
4 消毒剂抗性与抗生素抗性的关联
微生物对抗生素的耐药性已构成世界性危机,除医疗机构外,更多的研究调查从污水处理厂、养殖场、土壤、水体等各种环境中发现广泛存在的抗生素抗性基因(ARG)和抗生素抗性细菌(ARB)。这会加剧ARB 全球传播的环境风险,目前ARG 已归为新兴污染物,引发了全球的关注[100]。消毒剂作为另一类杀灭微生物的物质,微生物对其也会产生抗性,相关抗性基因的传播机制及潜在危害也逐渐引起研究者的重视。
越来越多的研究发现,消毒剂抗性与抗生素抗性之间具有一定的关联性。Lyon 等[101]研究质粒介导的消毒剂抗性基因时发现,当编码多药外排系统的基因位于含有青霉素、庆大霉素、甲氧苄啶和卡那霉素等抗生素耐药基因的质粒上,可以说明消毒剂抗性与抗生素抗性之间具有一定的相关性。Amsalu 等[102]研究铜绿假单胞菌在不同自然生态位中同时对多种抗生素和消毒剂产生耐药性的能力,发现存在交叉耐药性,其主要促成因素是调节基因mexR、nalC或nalD及相应氨基酸突变导致的MexAB‑OprM药物外排泵的过度表达。
此外,消毒剂暴露下诱导出的抗性微生物往往也能抵抗一定浓度的抗生素,甚至可能促进微生物抗生素耐药性的产生和传播。比如,土壤中铜、锌浓度与ARG和MGE基因丰度之间存在相关性[103],垃圾填埋场中ARG与MGE的相对丰度与砷、镉含量显著相关,表明ARG 的出现主要受重金属消毒剂和MGE 的影响,造成抗生素耐药性传播的风险[104]。饮用水氯消毒时,消毒剂的副产物能够诱导抗生素抗性,导致群落抗生素耐药性与抗生素水平不一致[6]。究其原因,氯化过程能够通过自然转化促进质粒的水平转移,导致ARG 在属间的交换和新型ARB 的出现,氯损伤还会使致病菌从非ARB 转移到ARB,而且转移元件很难通过消毒降解[100]。总之,多种消毒剂可以通过诱导基因突变增强微生物的抗生素抗性,从而增加抗生素抗性基因在环境中传播的潜在风险。
5 结论与展望
综上所述,微生物可通过形成生物膜、改变细胞膜渗透性、过量表达外排泵、产生消除或减弱消毒剂的特异性酶及改变作用靶点等策略产生针对消毒剂的抗性。抗性基因可由染色体或质粒介导,并且不合理使用消毒剂可能会诱导抗性并加剧抗性基因的传播风险。大量环境调查和医疗卫生机构的病原检测发现微生物的消毒剂抗性与抗生素抗性存在一定关联,消毒剂的不规范使用不仅能加剧消毒剂抗性基因污染,而且还会增加抗生素抗性基因传播,对环境和医疗健康造成更大的风险。
目前国内外缺乏对微生物消毒剂的抗性机理、抗性基因转移,以及与微生物特性、消毒水平及环境条件等有关的研究[1]。消毒剂不规范使用及可能存在的环境风险已经引起全球关注,其中欧盟已颁布评估消毒剂环境风险的法律条款,统一市场运作和管理,确保消毒剂不危害环境和人类健康[9]。并已提出减少长期使用单一消毒剂,选择加热、臭氧、UV等替代措施进行消毒。而针对生物膜结构等抗性机制,应用酶处理会提高消毒效率[37],可以联合使用多种处理方法协同作用来更彻底地消除有害微生物,避免消毒剂抗性的产生和传播。另外值得注意的是,相对于抗生素抗性,微生物消毒剂抗性机制更复杂。今后应加强针对不同消毒剂的抗性研究,尤其是作为抗性传播重要载体的MGE 在抗性水平转移方面的研究,利用转座子突变体库等分子生物学先进技术,联合基因组、转录组、代谢组、蛋白质组学等多组学分析手段,开发相应的消毒剂抗性基因数据库和相应生物信息学分析工具,广泛开展微生物消毒剂抗性、抗性相关基因及产生机制的研究,深入探索微生物对消毒剂抗性的产生和传播机理,为科学有效使用消毒剂、减少消毒剂抗性风险提供理论支持。
——一道江苏高考题的奥秘解读和拓展
- 生物化学与生物物理进展的其它文章
- Protein Aggregation and Phase Separation in TDP-43 Associated Neurodegenerative Diseases*
- 细菌的信号转导系统及其在耐药中的作用*
- CRBGP Inhibited The Activity of Glioma U251 Cells Through Suppressing FAK-AKT Pathway and The Secretion of Interleukin-6*
- Bradykinin Upregulated The Expression of Cyclooxygenase-2 in The Submucosal Plexus of Enteric Nervous System of Guinea Pig*
- 阿尔茨海默病体外诊断纳米技术*
- 突变和修饰β淀粉样蛋白与阿尔茨海默病

