乳腺癌多模态超声边缘带征象与预后因素关系的研究
郝如意 陈 武 刘晓芳 沈倩倩 任志翔 贺红霞
目前,女性癌症中乳腺癌发生率最高,病死率逐年上升,早期诊断对于患者的治疗及预后至关重要[1]。超声是乳腺癌诊断和预后评估的重要方法之一,而单一的常规超声检查技术有其自身局限性,合理使用多模态超声可提高诊断效能[2]。常规超声可初步判断病灶性质,但对不典型病灶可能会出现误诊和漏诊;超声剪切波弹性成像(share wave elastography,SWE)反映组织硬度,但易受钙化影响;超声造影能够清晰观察到肿瘤内微小血管走行、分布情况,反映肿瘤新生血管情况。同时,多项研究表明,癌灶的边缘带是生物学活性表现最为显著的区域,边缘带征象具有重要意义[3,4]。因此应用多模态超声检查可以实现对乳腺癌边缘带形态、弹性及血管形成的同步评估,提高乳腺癌的诊断准确率。
癌灶直径及淋巴结转移状态作为决定乳腺癌分期的主要因素,均被证实是影响乳腺癌预后的重要指标。免疫组化标志物的表达决定了乳腺癌的分型,对判断预后及选择合适的治疗方案也有着重要意义[5]。目前,关于探讨乳腺癌多模态超声边缘带征象与组织学预后特征之间联系的研究尚少,故本研究拟探讨乳腺癌多模态超声边缘带征象与癌灶直径、淋巴结转移状态和免疫组化标志物等预后因素之间的关系。
资料与方法
1.研究对象:收集2020年11月~2021年6月于笔者医院腺体外科经手术病理检查证实为乳腺癌的女性患者67例,共69个癌灶,患者年龄26~83岁,平均年龄为50.2±11.8岁。病理结果显示浸润性导管癌58个,浸润性混合型癌2个,导管内原位癌5个,黏液癌2个,小细胞癌1个,腺样囊性癌1个。免疫组化结果显示雌激素受体(estrogen receptor,ER) 阳性表达53个,孕激素受体(progesterone receptor,PR)阳性表达46个,人类表皮生长因子受体-2(human epidermal growth factor receptor-2,Her-2)阳性表达14个,ki-67阳性表达46个。淋巴结转移癌灶28个,无淋巴结转移癌灶41个。癌灶病理平均最大径为21.09±7.39mm。纳入标准:术前均行常规超声、超声造影及SWE检查且检查前未进行任何治疗,均获取术后病理及免疫组化结果。排除标准:①妊娠期或哺乳期;②对六氟化硫微泡(造影剂)过敏;③有假体植入史;④患有严重心肺疾病的患者等。本研究通过笔者医院医学伦理学委员会审批,并取得受试者的知情同意。
2.常规超声及SWE检查:使用法国声科SuperSonic Aixplorer实时剪切波弹性成像超声诊断仪,探头频率为(4~15)MHz。患者取平卧位并保持平静呼吸,多切面观察癌灶二维声像图特征,记录癌灶边界(有无高回声晕),边缘(有无毛刺、成角)。而后行SWE检查,取癌灶的最大径切面,调节取样框覆盖整个病灶,图像稳定后存储,重复3次。边缘带弹性最大值(Emax)、边缘带弹性比值(Eratio)被认为是目前SWE区分乳腺病变良恶性的最佳定量指标[6,7]。使用内置“Q-Box Ratio”定量分析软件,选取直径为2mm的圆形取样框定位至癌灶边缘弹性值最大位置测量,后选取同样直径取样框定位至周围正常脂肪组织测量,重复3次,自动得到3组数据。每组数据都包括癌灶边缘最硬处最大弹性模量值Emax、癌灶边缘最硬处及正常脂肪组织弹性模量比值Eratio,计算3组数据均值。记录癌灶有无“硬环征”,均值Emax、Eratio。
3.超声造影检查:使用美国GE LOGIQ E9彩色多普勒超声仪,探头频率为(9~15)MHz。嘱患者平卧位并保持平稳呼吸,找到癌灶后开启造影模式,选取癌灶形态不规则、血流较丰富切面,造影剂选用声诺维(意大利Bracco公司),将其与5ml 0.9%氯化钠溶液混合振摇成微泡悬液,经肘静脉快速团注4.8ml微泡悬液,继以5ml 0.9%氯化钠溶液冲管。动态观察并实时存储180s视频。后回放造影过程,记录边缘带定性增强特征,即有无边缘增强特征(放射状增强、环状增强、穿支状增强),有无增强后范围扩大,有无增强后边缘模糊[8]。边缘带定量增强特征:开启QLAB分析软件,分别选取乳腺癌癌灶增强区域边缘上、下、左、右4处为感兴趣区,软件处理得出各兴趣区的时间强度曲线(TIC)及峰值强度(PI)、基础强度(BI)、梯度(Grad)、上升斜率(K)、曲线下面积(AUC)、达峰时间(TtoPK)等定量参数,共4组,计算出平均值并记录。
4.影像学图像分析:影像学图像由两名及以上具有丰富乳腺诊断经验的医生在不参考任何相关资料下独立分析图像,结果有争议时与另1名具有8年以上乳腺诊断经验医生商议得出最终结果,确定乳腺癌的常规超声、超声造影及SWE边缘带征象。
5.病理及免疫组化结果分析:从术后病理及免疫组化结果中记录患者癌灶直径、腋窝淋巴结状态和免疫组化标志物的表达情况,并拟作为预后因素[9]。对免疫组化标志物结果进行判读,其中ER、PR结果判定:细胞核染色≥10%判为阳性,<10%判为阴性;ki-67结果判定:细胞核棕黄色染色≥14%判为阳性,<14%判为阴性;Her-2结果判定:“-”或“+”判为阴性,“+++”判为阳性,对于“++”的结果,有Her-2基因扩增的判为阳性,反之判为阴性。
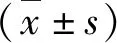
结 果
1.乳腺癌多模态超声边缘带影像学特征与预后因素的关系:(1)常规超声:仅边缘毛刺征在癌灶>2cm组及癌灶≤2cm组间比较差异有统计学意义(P<0.05)。(2)SWE:“硬环征”在ki-67阳性表达组与ki-67阴性表达组间、淋巴结转移组与无淋巴结转移组间、癌灶>2cm组与癌灶≤2cm组间比较,差异均有统计学意义(P<0.05,表1)。(3)超声造影:放射状增强、增强后边缘模糊在ER阳性表达组与ER阴性表达组间、PR阳性表达组与PR阴性表达组间比较,差异均有统计学意义(P<0.05,表2)。
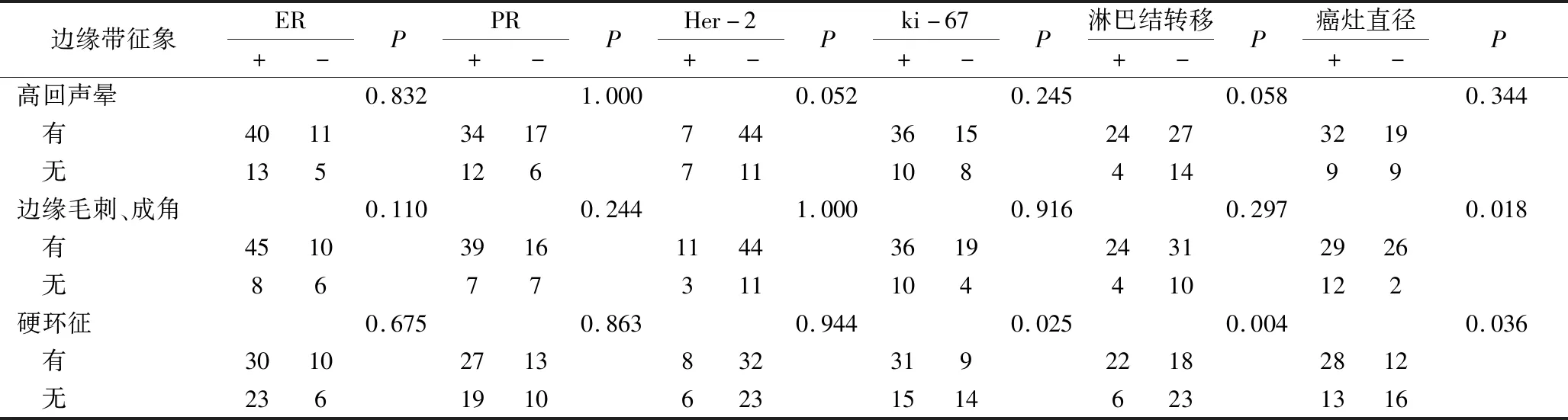
表1 乳腺癌常规超声、SWE边缘带影像学特征与预后因素的关系(n)
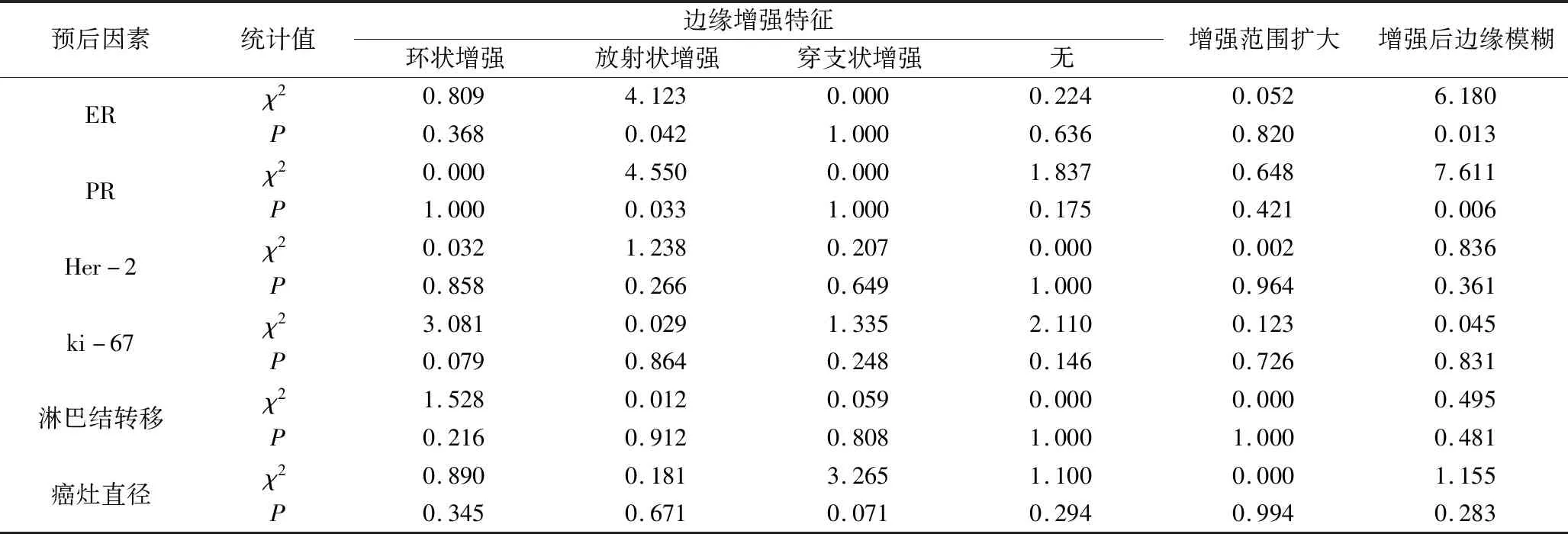
表2 乳腺癌超声造影边缘带影像学特征与预后因素的关系
2.乳腺癌多模态超声边缘带影像学特征与预后因素的相关性分析:(1)常规超声:仅边缘毛刺征与癌灶直径有相关性,且呈正相关(r=0.270,P<0.05)。(2)SWE:“硬环征”与ki-67阳性表达、淋巴结转移、癌灶直径均呈正相关(r分别为0.270、0.345、0.253,P均<0.05)。(3)超声造影:放射状增强、增强后边缘模糊与ER阳性表达、PR阳性表达均呈正相关(r分别为0.274、0.382,0.288、0.372,P均<0.05)。
3.乳腺癌多模态超声边缘带可量化特征与预后因素的相关性分析:(1)SWE:Emax、Eratio与ki-67阳性表达、淋巴结转移及癌灶直径均呈正相关(r分别为0.301、0.376、0.426,0.291、0.303、0.273,P均<0.05)。同时,Eratio与Her-2阳性表达呈正相关,与PR阳性表达呈负相关(r分别为0.313、-0.275,P均<0.05)。(2)超声造影:边缘带达峰时间(TtoPK)与ER阳性表达、PR阳性表达呈负相关(r分别为-0.414、-0.355,P均<0.05),AUC与ki-67阳性表达、癌灶直径呈正相关(r分别为0.364,0.299,P<0.05),PI与癌灶直径呈正相关(r=0.419,P<0.05,表3,图1)。
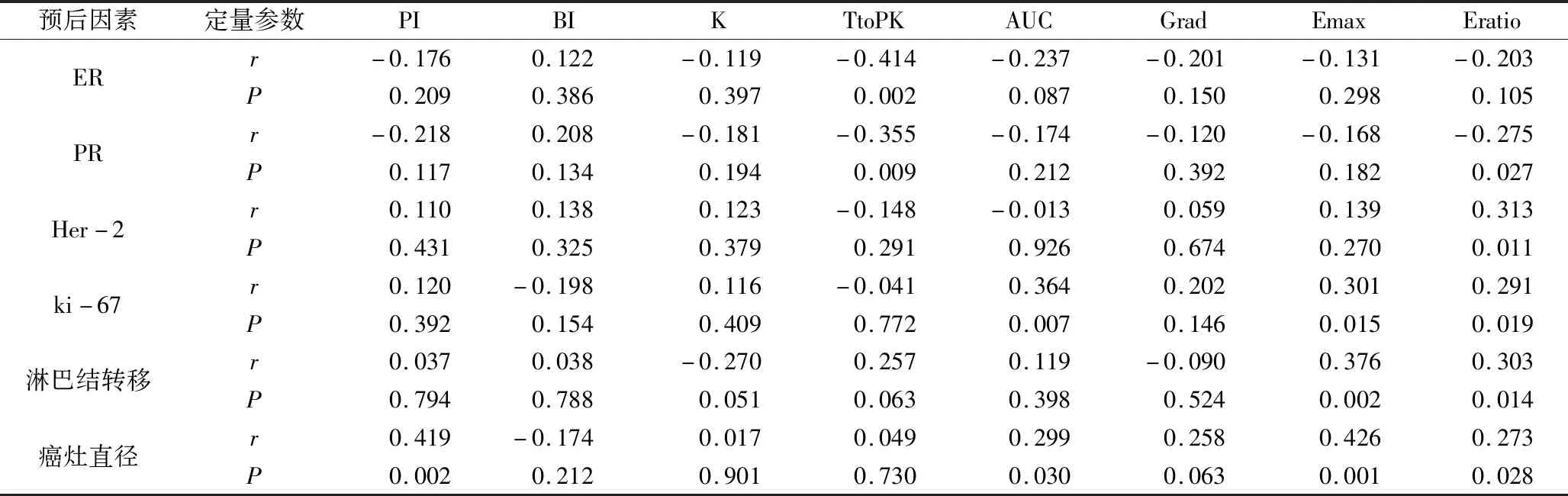
表3 乳腺癌多模态超声边缘带可量化特征与预后因素的相关性分析
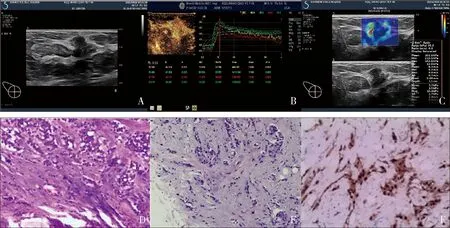
图1 右侧乳腺浸润性导管癌声像图及病理图患者,女性,69岁。右乳低回声病灶,术后病理证实为浸润性导管癌Ⅱ级,右侧腋窝淋巴结转移,ER(+),PR(-),Her-2(+)、ki-67(+)。A.常规超声示乳腺癌灶边缘毛刺、成角;B.超声造影示乳腺癌灶放射状增强、增强后边缘模糊、边缘带TIC曲线及定量参数;C.SWE示乳腺癌“硬环征”及边缘带弹性定量参数;D.乳腺浸润性导管癌Ⅱ级(HE染色,×40);E.右侧腋窝淋巴结,可见癌转移(HE染色,×40);F.乳腺浸润性导管癌ER(+)
讨 论
分子生物学行为决定了乳腺癌的形态变化[10]。ER、PR、Her-2和ki-67是乳腺癌4种常见的分子标志物,这些分子生物学指标的表达可以指导疾病治疗和预后监测。此外,癌灶直径及淋巴结转移状态作为决定乳腺癌分期的主要因素,均被证实是影响乳腺癌预后的重要指标。但这些预后因素的检测往往需要通过手术或活检后病理才能获得,具有创伤性及滞后性[11]。是否能够通过乳腺癌无创超声边缘带征象间接客观反映预后因素并寻找它们之间的相关性是目前研究热点。因此,本研究将乳腺癌预后因素与边缘带多模态超声表现相对照,探讨其相关性,旨在为乳腺癌的早期诊断与预后提供精准诊断的依据。
1.乳腺癌边缘带的研究价值:乳腺癌演进过程中肿瘤微环境主要表现为恶性基质化以及肿瘤血管的异质性,对肿瘤细胞的侵袭和转移均起到关键性作用,影响最为显著的就是呈侵袭性生长的边缘带[12]。边缘带的形成是由于乳腺癌边缘的肿瘤细胞向周围正常乳腺腺体或脂肪组织浸润蔓延,引起间质反应,从而形成不规则界面的边缘带,而乳腺癌促结缔组织增生反应或癌细胞向间质的浸润又增加了边缘带的硬度。此区域生物学活性显著,运用多模态超声对乳腺癌边缘带进行观察,并与预后因素进行相关性分析,对指导临床诊疗具有重要的研究价值[3,12]。
2.乳腺癌常规超声边缘带征象与预后因素的关系:癌灶>2cm时较易观察到边缘毛刺征可能是因为随着肿瘤血管生成癌灶增大,肿瘤细胞增殖活跃,向周围组织浸润,胶原纤维组织或导管不断增生,癌灶周边呈毛刺样改变,与康亚圣等[13]研究结果一致。ER、PR、Her-2、ki-67的表达及淋巴结转移状态与乳腺癌常规超声边缘带征象无明显相关性。
3.乳腺癌SWE边缘带征象与预后因素的关系:“硬环征”可能是由促结缔组织增生反应或肿瘤细胞浸润间质组织、恶性肿瘤内低剪切波振幅和(或)噪声或内部生物学因素引起的[14]。本研究ki-67阳性表达、淋巴结转移及癌灶>2cm均为不良预后因素,提示肿瘤向周围组织浸润程度较高,肿瘤周围基质异质性和硬化或纤维化,从而表现出“硬环征”及边缘带弹性参数较大[15]。此外,PR阴性表达也提示预后不良,具有较高侵袭性,肿瘤细胞增殖活跃,易浸润周围组织引起促结缔组织增生反应,使边缘带弹性参数较大。有研究表明,肿瘤的硬度不仅与肿瘤细胞数相关,还与微血管密度(microvessel density,MVD)相关[16]。Her-2基因扩增与MVD之间呈显著正相关,且Her-2作用于细胞外基质胶原硬度与细胞内硬度间的机械力传导,因此Her-2阳性表达乳腺癌边缘带Eratio较大[17]。
4.乳腺癌超声造影边缘带征象与预后因素的关系:超声造影放射状增强及增强后边缘模糊均与ER或PR阳性表达相关,当ER或PR阳性表达时,肿瘤成分沿导管向周围组织放射状蔓延浸润,大量血管内皮生长因子(vascular endothelial growth factor,VEGF)促进新生血管生成,新生血管与肿瘤细胞伴行,故超声造影呈放射状增强,肿瘤细胞增殖活跃促使肿瘤逐渐增大并向周围浸润,使边缘模糊[18]。位于肿瘤边缘带的肿瘤相关成纤维细胞(cancer-associated fibroblasts,CAFs)可诱导ER阳性表达,CAFs分泌大量VEGF,使边缘带大量新生血管迅速生成,且新生血管结构不完整,动静脉吻合常见,因此ER阳性表达边缘带血流灌注TtoPK缩短[3]。ki-67阳性表达与边缘带AUC呈正相关,原因可能是在癌灶生长过程中,ki-67与VEGF的表达相互促进,ki-67阳性表达促使VEGF生成新生血管,并增加血管通透性,静脉、淋巴管内癌栓形成导致血管狭窄甚至闭塞,故大量造影剂滞留于血管内[9]。当癌灶>2cm时,大量肿瘤细胞的增殖需要更多的新生血管提供营养,而新生血管多位于边缘带,边缘带血流丰富,而新生血管生长过快,排列杂乱,多形成盲端,因此会造成癌灶边缘带PI及AUC较大。
综上所述,乳腺癌多模态超声边缘带征象与癌灶直径、淋巴结转移及免疫组化标志物呈现一定相关性,对于准确诊断乳腺癌及指导个体化治疗具有重要的影像学意义。

