中青年体检人群脂联素水平与代谢综合征的相关性研究
王锐 陆强 刘炎 贾晓娇 石蕊 刘鑫 王菲 刘晓丽
代谢综合征(MS)是胰岛素抵抗、血压升高和致动脉粥样硬化性血脂异常等一系列疾病,MS及其各组分增加了心血管疾病发生的风险,严重威胁人类健康及生命。多项分析表明,由遗传和(或)环境因素(如导致肥胖的生活方式和高脂肪饮食)诱发的低脂联素血症可能是这种代谢疾病发病的一个重要危险因素[1]。MS的发展可能与肥胖、脂肪组织含量和激素水平有关。一项前瞻性研究发现,基线血清脂联素APN水平低和随访期间APN水平下降均与MS风险增加相关[2]。脂肪因子是由白色脂肪组织合成并释放的一种促炎细胞因子,脂联素(APN)是最丰富的脂肪因子,是胰岛素抵抗(IR)、组织炎症和内皮功能的关键调节因子。APN通过其胰岛素增敏特性是葡萄糖和脂质稳态的主要调节剂,较低水平似乎与2型糖尿病(T2DM)和MS的发展有关。在不同种族群体中进行的一项研究证实,肥胖和T2DM与低血浆APN浓度密切相关,并且低脂联素血症与IR和高胰岛素血症的程度密切相关[3]。本研究以我院体检中青年人群为研究对象,探讨APN水平和MS之间的关系。
1 资料与方法
1.1 一般资料 我院体检中青年人群244人,年龄28~52岁,其中男108人,女136人。入选患者均无心脑血管并发症和肝肾等疾病,排除急性并发症,停用可能影响血清脂联素水平的药物(如胰岛素增敏剂等)>2周。
1.2 方法
1.2.1 人体基本参数测定:包括身高、体重、腰围(WC)和血压。计算体重指数(BMI)=体重(kg)/身高(m)2。
1.2.2 口服葡萄糖耐量试验(OGTT):所有受试者前1 d晚餐后禁食8~10 h,空腹采血后于5~10 min内饮250~300 ml含75 g葡萄糖水。服糖前和服糖后2 h抽血检测血糖和胰岛素浓度。血糖检测采用葡萄糖氧化酶法,脂联素检测采用酶联免疫吸附法(ELISA)进行同批测定,胰岛素检测采用化学发光微粒子免疫检测法测定。计算Homa胰岛素抵抗指数(Homa-IR)=[空腹血糖(FPG)×空腹胰岛素]/22.5。
1.2.3 生化指标检测:应用空腹静脉血样检测血三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)及肝功能。测定仪器为日立 7060全自动生化分析仪。
1.3 MS诊断标准:(1)腹型肥胖:腰围男性≥90 cm,女性≥85 cm。(2)高血糖:空腹血糖≥6.1 mmol/L或糖负荷后2 h 血糖≥7.8 mmol/L 和(或)已确诊为糖尿病并治疗者。(3)高血压:血压≥130/85 mmHg和(或)已确认为高血压并治疗者。(4)空腹三酰甘油(TG)≥1.70 mmol/L。(5)空腹HDL-C<1.04 mmol/L。具备三项及以上者即可诊断[4]。
1.4 分组:按APN水平三分位数将研究人群分为3组:上三分位数组(n=81):APN水平6 132.5~28 419.5 ng/ml;中三分位数组(n=82):APN水平3 369.4~6 121.2 ng/ml;下三分位数组(n=81):APN水平643.0~3 337.5 ng/ml。
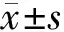
2 结果
2.1 3组间人体基本参数与生化指标水平比较 中三分位数组BMI、WC、TG及Homa-IR均高于上三分位数组,HDL-C水平低于上三分位数组(P<0.05)。下三分位数组BMI、WC、收缩压(SBP)、舒张压(DBP)、TG、糖负荷后2 h血糖(2 hPG)及Homa-IR均高于上三分位数组,HDL-C水平低于上三分位数组(P<0.05)。下三分位数组BMI、WC、SBP、DBP、TG及Homa-IR均高于中三分位数组,HDL-C水平低于中三分位数组(P<0.05)。2组间SBP、空腹血糖(FPG)、2 hPG比较差异无统计学意义(P>0.05)。见表1。
表1 不同APN水平体检人群人体基本参数及生化指标比较
2.2 APN与各指标相关性分析 APN与BMI(r=-0.283,P<0.001)、WC(r=-0.347,P<0.001)、SBP(r=-0.225,P<0.001)、DBP(r=-0.253,P<0.001)、TG(r=-0.257,P<0.001)、FPG(r=-0.146,P=0.023)、2 hPG(r=-0.184,P=0.004)和Homa-IR(r=-0.312,P<0.001)呈负相关,与HDL-C呈正相关(r=0.445,P<0.001)。
2.3 APN与MS相关性分析 中三分位数组高三酰甘油血症检出率高于上三分位数组,下三分位数组腹型肥胖、高血糖、高三酰甘油血症和低高密度脂蛋白血症检出率高于上三分位数组(P<0.05)。多因素Logistic回归分析显示,校正年龄、性别、吸烟史、饮酒史和BMI后,中三分位数组和下三分位数组发生MS的危险是上三分位数组的 3.296(95%CI: 1.041~10.434,P=0.042)倍和17.778(95%CI: 5.372~58.836,P<0.001)倍。见表2、3。
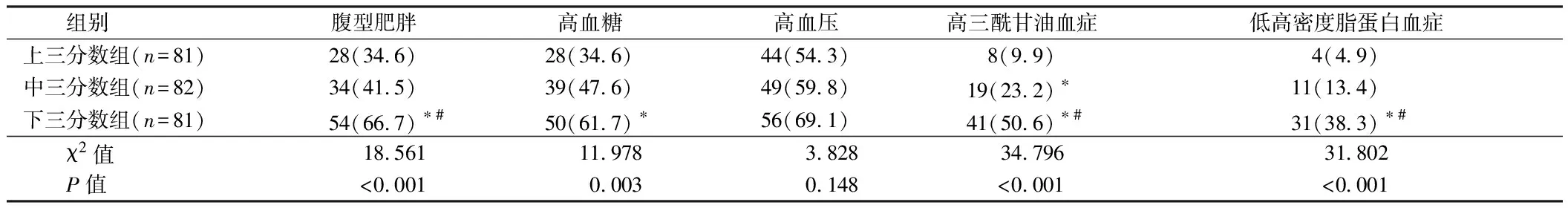
表2 3组MS各组份比较 例(%)

表3 APN水平与体检人群MS的关系
3 讨论
目前全世界约有1/4的人口患有MS。中国2010至2012年>18岁成年人MS流行病学调查显示,样本人群MS患病粗率为15.4%,标化率为11.0%[5]。本研究人群为中青年,MS检出率高达34.0%,与美国目前MS患病率相当,也高于2010年左右NHANES 和 CDC 数据[6,7]。APN具有多种生物学功能,能促进血浆游离脂肪酸氧化,增加外周组织对胰岛素的敏感性并具有防止动脉硬化形成和抗炎的作用,其表达和分泌水平的变化与MS密切相关,使得APN在MS中的作用受到了重视。
本研究按APN水平三分位数将研究人群分为3组,分析比较MS各组分情况。下三分位数组BMI、WC、SBP、DBP、TG、2 hPG及Homa-IR均高于上三分位数组,HDL-C水平低于上三分位数组;中三分位数组BMI、WC、TG及Homa-IR均高于上三分位数组,HDL-C水平低于上三分位数组;且下三分位数组BMI、WC、SBP、DBP、TG及Homa-IR均高于中三分位数组,HDL-C水平低于中三分位数组。相关分析显示,APN与BMI、WC、SBP、DBP、TG、FPG、2 hPG和Homa-IR呈负均相关,与HDL-C呈正相关。中三分位数组高三酰甘油血症检出率高于上三分位数组,下三分位数组腹型肥胖、高血糖、高三酰甘油血症和低高密度脂蛋白血症检出率高于上三分位数组。进一步多因素Logistic回归分析显示,校正年龄、性别、吸烟史、饮酒史和BMI后,中三分位数组和下三分位数组发生MS的危险是上三分位数组的3.296倍和17.778倍。提示APN水平与MS显著相关,低APN水平是中青年体检人群MS的独立危险因素。
APN的循环水平在2型糖尿病、肥胖、心血管疾病和高血压等病理情况下降低。APN基因与T2DM的易感性,支持APN在该疾病的发病机制中起关键作用的观点[1]。多项研究证实APN水平与MS标准之间的反比关系[8,9]。日本队列研究跟踪了5年,证实较高水平的APN与较低的T2DM发病率相关,APN水平最低三分位数的个体的T2DM水平大约是最高三分位数的个体的9倍[9]。此外,血浆APN水平较低的个体具有较小尺寸的LDL胆固醇分子、较低的脂蛋白脂肪酶活性、较低的HDL-胆固醇水平和较高的三酰甘油水平[8]。与非高血压患者相比,高血压患者的循环APN水平较低,即使在调整了肥胖、IR和T2DM后也是如此。而循环APN水平似乎随着MS成分数量的增加而降低。
APN是血浆中浓度最高的激素之一,生理条件下的浓度在0.5~30 μg/ml,占血浆总蛋白的0.01%。自发现以来,APN立即引起了科学界的重视,因为它在与肥胖相关的IR和炎症等中发挥保护作用,是血管稳态的关键调节剂,对心血管疾病有潜在的重要作用,包括减少动脉粥样硬化病变中淋巴细胞的募集,降低C-反应蛋白,抑制肿瘤坏死因子 α 和核转录因子 κB 介导的促炎信号。研究表明APN对血压稳态有影响。APN通过激活 AMPK增加基因表达并激活内皮一氧化氮合酶,刺激一氧化氮的合成,一氧化氮是一种重要的内皮因子和有效的血管扩张剂[10]。肾素-血管紧张素系统在调节血压方面发挥着重要作用,当它被激活时,会延续动脉壁的炎症过程,增加氧化应激并促进动脉粥样硬化的发展,而APN通过其抗氧化和抗炎作用,可抑制肾素血管紧张素系统激活的有害血管效应,并且与 MS 中的血压稳态失调密切相关[11]。
导致肥胖的几个环境因素会影响APN的产生。久坐不动的生活方式和富含碳水化合物的饮食会抑制APN[12],而一些饮食因素(大豆蛋白、鱼油和亚油酸)似乎会增加血浆APN水平[1]。进餐后APN浓度保持不变,而在体重明显减轻后增加。本研究人群为中青年,均有久坐不动的生活方式和富含碳水化合物的饮食特点,可能使得APN水平下降更加明显,可能在MS的发病过程中发挥了重要作用。
总之,APN水平与中青年体检人群MS显著相关。低APN水平是中青年体检人群MS的独立危险因素。

