3-碘甲状腺原氨酸的受体、通路及药理学效应研究进展
莫丽莉 邹常超 徐启丽 韦波 李伟 曾安宁 陈章荣 刘兴德 周海燕
中图分类号 R96 文献标志码 A 文章编号 1001-0408(2022)02-0244-07
DOI 10.6039/j.issn.1001-0408.2022.02.20
摘 要 3-碘甲状腺原氨酸是甲状腺激素的内源性衍生物,也可作为外源性药物使用,可发挥减少心输出量、冠脉流量,减慢心率,促进脂肪分解,降低基础代谢,改善学习及记忆能力等药理学效应。其对代谢的调节作用与甲状腺素类似,而对心脏的调节作用及产热功能则与其相反。3-碘甲状腺原氨酸作为一种新型化学信使,可通过多种受体及信号通路发挥不同的药理学效应。本文就外源性3-碘甲状腺原氨酸发挥的多种药理学效应及其机制的研究进展作一综述,以期为心血管、代谢性疾病及神经系统疾病提供新的治疗药物。
关键词 3-碘甲状腺原氨酸;受体;信号通路;药理学效应
Research progress of receptor, pathway and pharmacological effect of 3-iodothyronamine
MO Lili1,2,ZOU Changchao3,XU Qili1,2,WEI Bo1,LI Wei1,2,ZENG Anning4,CHEN Zhangrong1,LIU Xingde3, ZHOU Haiyan1,2(1. Dept. of Cardiology, the Affiliated Hospital of Guizhou Medical University, Guiyang 550004, China; 2. School of Clinical Medicine, Guizhou Medical University, Guiyang 550004, China; 3. Dept. of Cardiology, the Second Affiliated Hospital of Guizhou University of Traditional Chinese Medicine, Guiyang 550004, China; 4. Dept. of Cardiology, Qiannan Buyi and Miao Autonomous Prefecture People’s Hospital, Guizhou Duyun 558000, China)
ABSTRACT 3-iodothyronamine (T1AM) is an endogenous derivative of thyroid hormone. It can also be used as exogenous drug. It can play pharmacological effects such as reducing cardiac output and coronary flow, slowing heart rate, promoting lipolysis, reducing basic metabolism and improving learning and memory ability. Its regulatory effect on metabolism is similar to that of thyroxine, but regulatory effect on heart and thermogenic function is opposite to that of thyroxine. As a new chemical messenger, T1AM can exert different pharmacological effects through a variety of receptors and signal pathways. This review summarizes the research progress of various pharmacological effects and mechanisms of exogenous T1AM, in order to provide new therapeutic drugs of cardiovascular, metabolic diseases and nervous system diseases.
KEYWORDS 3-iodothyronamine; receptor; signal pathway; pharmacological effect
3-碘甲状腺原氨酸(3-iodothyronamine,T1AM)是甲状腺激素通过脱羧、脱碘形成的衍生物,其结构与甲状腺激素相似,但部分功能却与甲状腺激素相反。2004年,Scanlan等[1]首次在人和啮齿动物体内检出T1AM,并发现该成分能够在极短时间内降低体温、减少心输出量、减慢心率,是G蛋白偶联痕量胺相关受体1(trace amine associated receptor-1,TAAR1)的有效激動剂。近年来,随着T1AM相关研究的增多,学者们还发现其可作为一种新型化学信使,在内分泌系统、神经系统等发挥降低代谢、改善记忆等不同药理学效应,但其具体作用机制不明[2-13]。已有研究表明,外源性T1AM不与甲状腺激素受体相互作用,而是通过与其他受体[如β-肾上腺素受体(β-adrenergic receptor,ADRB)、5-羟色胺受体1B(5-serotonin receptor 1B,5-HTR1B)等]作用或与质膜中的相关位点[如沉默信息调节因子6(sirtuin 6,SIRT6)、SIRT4等]结合,以非基因学机制来发挥药理学效应[5,14-20]。目前,T1AM的临床研究有限,多数研究是在动物和细胞水平上针对外源性T1AM开展的,以探讨其药理学效应及作用机制。基于此,为总结T1AM的研究现状,本文在介绍T1AM结构、功能、生物合成途径的基础上,对其作用受体、通路及药理学效应进行综述,以期为心血管、代谢性疾病及神经系统疾病提供新的治疗药物。
1 T1AM的结构、功能及生物合成途径
在结构上,T1AM与甲状腺激素有相同的碳骨架,而T1AM不存在含羧酸基团的丙氨酸侧链,仅在芳环上保留了1个碘原子[21]。在功能上,外源性T1AM的一些药理学效应(如调节心脏功能、产热等)与3,5,3′-三碘甲状腺原氨酸(3,5,3′-triiodothyronine,T3)或甲状腺功能亢进相反,而其他作用(如代谢调节)则为协同。由于T1AM的结构与甲状腺激素类似,学者们最初推测T1AM产生于甲状腺:首先,甲状腺激素借助碘化钠同向转运蛋白和甲状腺过氧化物酶,经脱羧和脱碘反应合成衍生物;随后,该衍生物通过芳香族L-氨基酸脱羧酶介导而合成T1AM[22]。但最近一项研究证明,功能性L-氨基酸脱羧酶缺失的患者体内血清T1AM水平正常[23]。上述研究提示,T1AM在合成过程中很有可能不需要借助L-氨基酸脱羧酶。此外,学者们还发现,与甲状腺素一起孵育的大鼠甲状腺细胞FRTL-5不能产生T1AM[24];而在与T3一起孵育的大鼠心肌细胞H9c2中检出了T1AM[25]。学者们在临床工作中发现,接受甲状腺切除和放射性碘治疗的患者的血清T1AM水平高于健康个体,推测T1AM可能是在甲状腺外由甲状腺素代谢物产生的[26]。一项利用甲状腺切除小鼠的实验证实,T1AM可在肠道中合成:肠道中的甲状腺素经鸟氨酸脱羧酶和3种脱碘酶亚型介导、催化,从而合成T1AM[27]。然而,该实验的给药方式是腹腔注射,而甲状腺切除后患者接收替代治疗的方式是口服,两者给药途径不同,所以该实验的结论存在一定争议,但其仍能在一定程度上证实T1AM是在甲状腺以外的器官中合成的。
2 外源性T1AM的作用受体、通路及其药理学效应
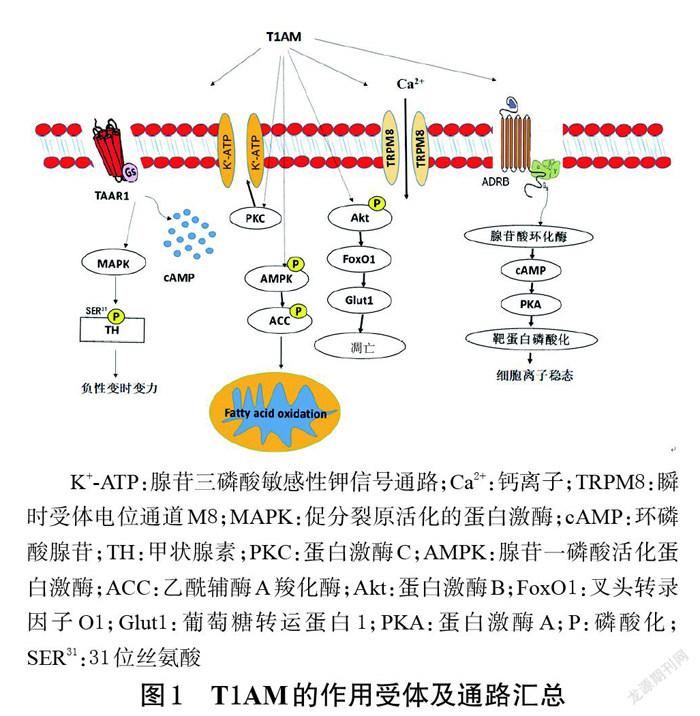
T1AM主要分布于啮齿动物体内,包括血清、大脑、心、肝、肾、胃、肺及骨骼肌,且其在组织中的分布浓度远高于在血清中的浓度[25];同时,T1AM也分布于人类的血液、大脑中[25]。为探究其作用机制及成药性,学者们通过给予外源性T1AM在细胞及动物水平上开展了相关研究。T1AM的作用受体及通路汇总见图1。
2.1 T1AM作用于G蛋白偶联受体影响心脏、神经细胞和细胞离子稳态
G蛋白偶联受体是T1AM的作用靶点之一,也是细胞信号转导领域一类重要的蛋白质分子,可对生物体的生长发育、生殖、摄食、代谢以及行为等起到调控作用[28-30]。T1AM可直接作用于G蛋白偶联受体中的TAAR1和ADRB[31-35]。
2.1.1 T1AM作用于TAAR1产生心脏负性变时、变力作用 TAAR有9种不同的亚型,在多种组织中广泛表达,其中TAAR1是单胺类神经递质传递的重要调节器,因其具有调节单胺类神经递质传递的作用,其激动剂在心血管、神经系统等疾病治疗领域中有一定的潜力[35]。由于T1AM与TAAR1的高亲和力,学者们初始认为T1AM仅通过作用于TAAR1来介导小鼠体温下降[5]。但随后学者们通过TAAR1基因敲除小鼠证实,在给予T1AM后,TAAR1基因敲除小鼠的体温仍会下降,表明T1AM对小鼠体温的调节还可通过作用于其他受体来实现[1]。另有利用C57BL/6J小鼠及Wistar大鼠的研究表明,T1AM可通过激活TAAR1或其他TAAR亚型来减少心输出量、主动脉压、冠脉流量,并可剂量依赖性地减慢心率[1,36-38]。在成年雄性C57BL/6J小鼠实验中,给予T1AM后,小鼠心率立即下降,并于持续6~8 h后逐渐恢复正常[1]。在离体大鼠心脏灌流实验中,20~38 μmol/L的T1AM可使大鼠心输出量立即降低,其中38 μmol/L的T1AM可使大鼠10 min内的心输出量较对照组降低63%、心率降低50%,且20 μmol/L及以下剂量的T1AM不会造成大鼠心动过缓[1]。学者们在Wistar大鼠Langendorff离体心脏灌流实验中发现,T1AM能够引起大鼠心输出量、主动脉压、冠脉流量和心率下降,并且上述作用具有剂量依赖性;该研究结果还提示,T1AM可能是通过激活TAAR1来介导这一心脏效应[37]。有一项针对慢性心力衰竭患者的临床研究结果显示,其血清T1AM水平明显增高,且增高水平与左室射血分数降低相关,提示T1AM对心脏有直接的负向调节作用[39]。
2.1.2 T1AM作用于TAAR1受体产生神经细胞保护作用 有研究显示,TAAR1受体与多种神经系统疾病有关,如T1AM与TAAR1受体的结合,可有助于改善小鼠的学习记忆能力[2,40]。阿尔茨海默病的发病机制有多种假说,大脑内嗅皮层中β淀粉样蛋白异常聚集是其中的一种假说,该蛋白的异常聚集可抑制海马区长时程增强,使学习记忆能力受损[41]。在一项使用野生型小鼠和阿尔茨海默病模型小鼠内嗅皮层切片进行的电生理实验中,学者们分别或联合灌注了β淀粉样蛋白、T1AM、TAAR1激动剂RO5166017、TAAR1拮抗剂EPPTB,结果显示,T1AM恢复了模型小鼠内嗅皮层的长时程增强,TAAR1拮抗剂EPPTB消除了T1AM的上述作用,而TAAR1激动剂RO5166017则模拟了T1AM的上述效应,表明T1AM可通过激活TAAR1而阻止β淀粉样蛋白异常聚集所诱导的神经细胞功能障碍[2]。此外,由于T1AM结构与T3相似,T3可以透过血脑和脊髓屏障,提示T1AM也可能会透过血脑和脊髓屏障而进入脑脊液和神经组织。有研究证实,T1AM可作用于TAAR1以减少脊髓神经细胞凋亡,减轻脊髓损伤[40]。由于此前有研究表明,T1AM对甲状腺激素受体没有作用[37],但对TAAR1有较高的亲和力和激活作用,因此推测线粒体介导的凋亡是TAAR1下游的一种潜在机制。一项以脊髓损伤模型大鼠为对象的研究显示,T1AM组脊髓损伤模型大鼠的运动功能评分显著高于对照组和T1AM+TAAR1拮抗剂组(P<0.05),提示T1AM对神经功能具有一定的保护作用,有利于脊髓损伤后大鼠运动功能的恢复;同时,TAAR1拮抗剂组大鼠的运动功能与对照组相似,说明T1AM的上述作用可能是通过TAAR1来介导的。该研究还通过TUNEL实验证实了T1AM参与并减少了神经细胞的凋亡[40]。綜上所述,T1AM可以通过介导TAAR1而减少神经细胞凋亡,从而保护神经细胞,促进神经功能的恢复。
2.1.3 T1AM作用于ADRB增加细胞内Ca2+内流,调节细胞离子稳态 ADRB是T1AM的另一受体,T1AM可通过ADRB2增加人结膜上皮细胞IOBA-NHC中Ca2+的内流,从而调节细胞离子稳态[42]。Dinter等[42]通过过表达ADRB的人胚胎肾细胞HEK293证实,异丙肾上腺素可通过作用于ADRB而激活兴奋性G蛋白的信号转导,使得cAMP积累增加;在异丙肾上腺素基础上加用低浓度(10-8~10-7 mol/L)的T1AM,可明显增强ADRB2介导的兴奋性G蛋白信号转导和cAMP积累效应,而对ADRB1介导的兴奋性G蛋白信号转导无影响;此外,在异丙肾上腺素基础上加用高浓度(10-5~10-4 mol/L)的T1AM,其cAMP积累效应强于单用异丙肾上腺素,但弱于异丙肾上腺素加用低浓度T1AM,该现象可能与高浓度T1AM激活了抑制性G蛋白信号转导有关。另有研究发现,T1AM可增加人结膜上皮细胞IOBA-NHC中的Ca2+内流,非选择性ADRB拮抗剂噻吗洛尔既可以阻断去甲肾上腺素引起的Ca2+内流,同时又可以逆转T1AM引起的Ca2+内流,提示T1AM可能是通过作用于ADRB2使细胞内Ca2+内流增加,从而调节细胞离子稳态[42]。
2.2 T1AM作用于瞬时受体电位通道调节细胞离子稳态,减少炎症介质释放
瞬时受体电位通道是一类跨膜非选择性阳离子通道,包括28个成员。TRPM8和瞬时受体电位香草酸亚型1(transient receptor potential vanilloid 1,TRPV1)均对温度敏感,其中TRPM8可在低于28 ℃时被激活,TRPV1则可在高于43 ℃时被激活[43-45]。有研究指出,T1AM可通过激活TRPM8来增加人结膜上皮细胞IOBA-NHC中的Ca2+内流;此外,其还可抑制TRPV1激动剂辣椒素引起的Ca2+内流和白细胞介素6释放,在调节细胞离子稳态的同时减少炎症介质的释放[44]。Khajavi等[46]通过IOBA-NHC细胞实验证实,在适度降温和给予TRPM8激动剂icilin的条件下,T1AM可增加IOBA-NHC细胞的Ca2+内流,而TRPM8阻滞剂BCTC可阻断这种作用。T1AM可模拟TRPM8激动剂icilin的作用,引起细胞Ca2+内流的增加;此外,TRPM8阻滞剂BCTC可逆转T1AM引起的Ca2+内流[45]。该细胞实验证实,在适度降温的条件下,T1AM可激活TRPM8,从而增加Ca2+内流,并调节细胞离子稳态;T1AM可逆转TRPV1激动剂辣椒素引起的Ca2+内流,抑制TRPV1激活所引起的白细胞介素6释放;T1AM可模拟TRPV1特异性受体拮抗剂辣椒平的阻断作用,提示T1AM可能是通过抑制TRPV1信号通路导致白细胞介素6释放减少。
2.3 T1AM作用于5-HTR1B调节体温
5-HTR1B主要通过调节5-羟色胺等神经递质的释放进而影响神经细胞的兴奋性,其主要分布在纹状体,其次在下丘脑、黑质、垂体等部位。5-HTR1B和TAAR1可作为体温调节信号在下丘脑共表达,前者主要参与抑郁样行为和厌食症的发生[47]。由于5-HTR1B和TAAR1的表达谱重叠,而T1AM可激活TAAR1受体,因此Bräunig等[48]利用5-HTR1B过表达人胚胎肾细胞HEK293进行实验探讨T1AM是否可以激活5-HTR1B,结果提示,T1AM可通过激活5-HTR1B,偶联抑制性G蛋白,从而使细胞内cAMP积累减少。然而,该学者利用5-HTR1B和TAAR1同时过表达的人胚胎肾细胞HEK293进行研究发现,T1AM仅通过激活TAAR1而偶联兴奋性G蛋白,但不激活5-HTR1B,这可能是因为T1AM与TAAR1有更高的亲和力。因此,Bräunig等[48]推测,在给予TAAR1基因敲除小鼠T1AM后,小鼠的体温仍会下降,这可能是T1AM作用于5-HTR1B所产生的体温调节作用。
2.4 T1AM与毒蕈碱受体结合减少膀胱收缩
毒蕈碱受体广泛存在于副交感神经节后纤维支配的效应器细胞上,分为5个亚型。毒蕈碱受体在中枢神经系统中表达,在记忆和疼痛回路中起主要作用,在外周参与平滑肌收缩、外分泌腺和内分泌腺分泌等生物学过程。有学者利用毒蕈碱受体过表达的中国仓鼠卵巢细胞CHO进行研究发现,T1AM可以抑制毒蕈碱受体激动剂碳酰胆碱诱导的大鼠膀胱收缩,提示T1AM是毒蕈碱受体弱的、非选择性的拮抗剂[49]。
2.5 T1AM通过FoxO1信号通路减少心肌缺血再灌注损伤并诱导肌细胞萎缩
2.5.1 T1AM通过Akt/FoxO1信号通路减少心肌缺血再灌注损伤 心肌缺血再灌注损伤是缺血性心脏病溶栓或者介入治疗后,影响临床治疗效果的重要因素[50]。在心肌缺血再灌注损伤过程中,T1AM可通过Akt/FoxO1信号通路来调控心肌细胞代谢,从而减少其凋亡,最终起到保护心肌的作用。本课题组前期研究首先建立了缺氧/复氧诱导的人心肌细胞AC-16损伤模型,发现低浓度的T1AM可提高损伤心肌细胞的活力,显著降低损伤心肌细胞的耗氧率和凋亡率;其次,通过转录组学测序技术检测T1AM对缺氧/复氧损伤心肌细胞转录组的影响,发现差异基因可富集到FoxO1信号通路上[7];最后,通过实时定量聚合酶链反应技术和免疫印迹法检测FoxO1、Akt、Glut1、Bcl-2、Bax基因和Akt/FoxO1信号通路相关蛋白的表达水平,证实T1AM可以通过上述信号通路使AC-16细胞代谢降低,从而减少其凋亡[51],为心肌缺血再灌注损伤的治疗提供了新的思路。
2.5.2 T1AM通过FoxO1信号通路诱导肌细胞萎缩 当细胞的分解代谢多于合成代谢时,会诱发肌肉萎缩[52]。Ju等[53]以小鼠肌细胞C2C12为研究对象进行实验发现,经T1AM处理后,C2C12细胞直径减小,去除T1AM 9 h后,C2C12细胞直径基本恢复正常;免疫印迹实验结果提示,经T1AM处理后,C2C12细胞合成代谢减少[磷酸化Akt1/Akt1、磷酸化雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)/mTOR、磷酸化核糖体蛋白S6激酶(ribosomal protein S6 kinase,S6K)/S6K降低了44%~56%,热休克蛋白27和αB-晶体蛋白的表达水平分别降低了26%和47%],分解代谢增强(FoxO1蛋白表达水平增加了2.0倍,磷酸化FoxO1/FoxO1降低了65%;磷酸化FoxO3蛋白表达水平降低了42%,磷酸化FoxO3/FoxO3降低了39%)。综合上述实验结果分析,T1AM可通过激活FoxO1信号来增加分解代谢,抑制Akt/S6K信號通路介导的合成代谢,从而引起肌细胞萎缩,该机制为T1AM在肌肉肥大患者的治疗应用奠定了理论基础。
2.6 T1AM通过PKC/K+-ATP通道调节线粒体渗透性从而减轻心肌缺血再灌注损伤
Sabina等[16]以雄性Wistar大鼠为研究对象,建立心肌缺血再灌注模型进行实验,发现低浓度T1AM可缩小缺血再灌注损伤模型大鼠的心脏梗死面积,且不影响其血流动力学参数,但高浓度T1AM无此效果;此外,PKC抑制剂白屈菜红碱和K+-ATP通道阻滞剂格列本脲可消除T1AM介导的心脏保护作用。由此该研究团队推测,T1AM可通过PKC/K+-ATP通道来调节线粒体的渗透性,从而减轻心肌缺血再灌注损伤,上述结果与本课题组前期研究结果一致[7]。
2.7 T1AM通过AMPK信号通路促进脂肪(细胞)分解
2.7.1 T1AM通过AMPK/ACC信号通路促进脂肪分解 Rogowski等[54]以小鼠胚胎成纤维细胞3T3-L1和人肝癌细胞HepG2为研究对象进行实验,发现3T3-L1细胞经T1AM处理后脂质沉积减少,HepG2细胞经T1AM处理后脂肪分解增加,同时AMPK和ACC蛋白的磷酸化水平有所升高,推测细胞脂肪分解作用可能与该化合物激活AMPK/ACC信号通路而引起脂肪代谢变化有关。此外,另一项研究利用小鼠肌细胞C2C12进行实验,结果提示,T1AM可明显减低C2C12细胞耗氧量,通过增加腺苷一磷酸/腺苷三磷酸比例,激活AMPK磷酸化,使肉碱棕榈酰转移酶和丙酮酸脱氢酶激酶表达上调,ACC和丙酮酸脱氢酶磷酸酶表達下调,从而引起脂肪动员[55]。由此可见,T1AM可通过激活AMPK/ACC信号通路来促进脂肪分解,并减少细胞脂质沉积。
2.7.2 T1AM通过AMPK/FoxO1/脂肪甘油三酯脂肪酶/单酰基甘油脂肪酶信号通路分解脂肪细胞 肥胖是脂肪细胞在白色脂肪中的聚集。Kim等[56]通过诱导小鼠胚胎成纤维细胞3T3-L1脂滴积累,研究T1AM分解脂肪的机制,结果发现,T1AM可通过激活AMPK/FoxO1/脂肪甘油三酯脂肪酶/单酰基甘油脂肪酶信号通路将甘油三酯分解为游离脂肪酸和甘油,这种作用可以被脂肪甘油三酯脂肪酶抑制剂ATGListatin显著抑制;此外,T1AM还可通过AMPK/ACC/肉毒碱棕榈酰转移酶1信号通路来促进游离脂肪酸进入线粒体并发生β氧化,从而提供能量。
2.8 T1AM作用于SIRT影响体质量、神经细胞
2.8.1 T1AM通过SIRT减轻体质量 SIRT是一类具有多种代谢调节酶活性的蛋白家族,共有7个家族成员[57-58]。其中,SIRT6在维持糖脂代谢稳态中起着重要作用,可减少糖酵解和甘油三酯合成[1,35];SIRT4是一种线粒体沉默调节蛋白,也是线粒体代谢的负调节因子,抑制SIRT4可增强肝脏和肌肉细胞的线粒体功能并加速脂肪酸氧化[37]。Assadi-porter等[59]研究发现,按10 mg/(kg·d)的剂量给予小鼠T1AM,7 d后其体质量较对照组下降10%;按25 mg/(kg·d)的剂量给予小鼠T1AM,7 d后其体质量较对照组下降18%;此外,与对照组比较,T1AM组小鼠体内的代谢物(乳酸、丙氨酸、琥珀酸等)含量、相关蛋白(SIRT6、SIRT4、葡萄糖激酶)表达及血清胆固醇水平等均有较大差异,且T1AM对初级代谢(尤其是氨基酸、脂质、碳水化合物及糖核苷酸代谢等)的影响尤为明显;与此同时,相关基因转录和蛋白表达的检测结果表明,T1AM可通过上调SIRT6表达、下调SIRT4表达来重新编码脂肪酸和葡萄糖的代谢,从而使小鼠体质量下降。由此可见,T1AM可通过调控SIRT的表达来减轻实验动物的体质量。
2.8.2 T1AM通过调控SIRT保护神经细胞 T1AM对神经退行性病变具有保护作用,可改善学习和记忆能力,除了作用于TAAR1这一靶点外,还可以通过上调SIRT6的表达来激活自噬,从而发挥对神经细胞的保护作用[3]。神经退行性病变的共同病理改变是错误折叠蛋白的聚集,有研究表明,T1AM可通过上调SIRT6表达,抑制mTOR磷酸化,诱导人胶质母细胞瘤细胞的自噬,降解异常蛋白,减少错误折叠蛋白的聚集,从而达到保护神经细胞的目的。
2.9 T1AM通过磷脂酰肌醇3激酶/Akt/mTOR信号通路诱导自噬,保护神经细胞
自噬是一种由细胞溶酶体介导的复杂生物学行为,其通过溶酶体降解来消除错误折叠蛋白、蛋白复合物或细胞器,是维持细胞稳态所必需的生理过程。自噬与阿尔茨海默病、帕金森病以及创伤和缺血性脑损伤后遗症等神经退行性疾病的发生发展密切相关[60]。由此可见,诱导自噬可成为治疗神经系统疾病的一种方法。为了探究T1AM在自噬过程中的作用,Bellusci等[3]以人胶质母细胞瘤细胞U-87MG为研究对象,以1 μmol/L的T1AM分别干预0.5、4、8、24 h,以观察细胞自噬通量的改变。透射电镜结果显示,T1AM诱导U-87MG细胞产生自噬,且有时间依赖性;免疫荧光结果显示,T1AM干预8 h后,细胞内自噬标志物微管相关蛋白1轻链3斑点形成明显;免疫印迹实验结果显示,T1AM能够显著诱导U-87MG细胞中微管相关蛋白1轻链3-Ⅱ表达上调,自噬蛋白p62和磷酸化Akt表达下调[3]。磷脂酰肌醇3激酶/Akt/mTOR通路是调节自噬的重要通路,降低磷酸化Akt的表达,可抑制mTOR的活性,故上述研究团队推测,T1AM可通过抑制Akt的激活来降低mTOR的活性,从而促进细胞自噬。综上所述,T1AM可通过抑制磷脂酰肌醇3激酶/Akt/mTOR信号通路来诱导U-87MG细胞产生自噬,从而发挥神经保护作用,该化合物有可能成为神经退行性疾病的有效治疗药物。
3 结语
外源性T1AM作用于不同受体、通路发挥不同药理学效应:在心血管系统,其可降低心输出量、主动脉压、冠脉流量、心率;在内分泌系统,其可促进脂肪分解、降低基础代谢[11,13];在神经系统,其可改善学习及记忆能力。因其在极短时间内可发挥药理学效应[1],故该物质可为今后心血管、神经、内分泌系统疾病等的治疗提供新方向。尽管如此,目前关于T1AM的认识还是不足,主要表现为以下几个方面:(1)T1AM在机体中的合成位点、合成途径、失活形式尚未完全清楚;(2)T1AM可作用于多个受体,不仅可与TAAR1或TAAR其他亚型相互作用,还可与非G蛋白偶联受体相互作用,但其作用模式仍存在争议;(3)外源性T1AM的作用效果与浓度相关,其有效浓度的选择也将是其临床应用的巨大挑战之一。
參考文献
[ 1 ] SCANLAN T S,SUCHLAND K L,HART M E,et al. 3-iodothyronamine is an endogenous and rapid-acting derivative of thyroid hormone[J]. Nat Med,2004,10(6):638-642.
[ 2 ] ACCORRONI A,RUTIGLIANO G,SABATINI M,et al. Exogenous 3-iodothyronamine rescues the entorhinal cortex from β-amyloid toxicity[J]. Thyroid,2020,30(1):147-160.
[ 3 ] BELLUSCI L,RUNFOLA M,CARNICELLI V,et al. Endogenous 3-iodothyronamine(T1AM)and synthetic thyronamine-like analog SG-2 act as novel pleiotropic neuroprotective agents through the modulation of SIRT6[J]. Molecules,2020,25(5):E1054.
[ 4 ] FLIERS E,KLIEVERIK L P,KALSBEEK A. Novel neural pathways for metabolic effects of thyroid hormone[J]. Trends Endocrinol Metab,2010,21(4):230-236.
[ 5 ] BIEBERMANN H,KLEINAU G. 3-iodothyronamine induces diverse signaling effects at different aminergic and non-aminergic G-protein coupled receptors[J]. Exp Clin Endocrinol Diabetes,2020,128(6/7):395-400.
[ 6 ] HA K,SHIN H,JU H,et al. Behavioral hypothermia of a domesticated lizard under treatment of the hypometabolic agent 3-iodothyronamine[J]. Exp Anim,2017,66(2):99-105.
[ 7 ] ZHOU H Y,HU B L,ZHANG B,et al. Comparative tran- scriptome analysis reveals the potential cardiovascular protective targets of the thyroid hormone metabolite 3-iodothyronamine(3-T1AM)[J]. Biomed Res Int,2020,2020:1302453.
[ 8 ] GENCARELLI M,LAURINO A,LANDUCCI E,et al. 3-iodothyronamine affects thermogenic substrates’mobilization in brown adipocytes[J]. Biology(Basel),2020,9(5):E95.
[ 9 ] MITTAG J. More than fever-novel concepts in the regulation of body temperature by thyroid hormones[J]. Exp Clin Endocrinol Diabetes,2020,128(6/7):428-431.
[10] ZUCCHI R,RUTIGLIANO G,SAPONARO F. Novel thyroid hormones[J]. Endocrine,2019,66(1):95-104.
[11] KÖHRLE J. The colorful diversity of thyroid hormone metabolites[J]. Eur Thyroid J,2019,8(3):115-129.
[12] LANDUCCI E,GENCARELLI M,MAZZANTINI C,et al. N-(3-Ethoxy-phenyl)-4-pyrrolidin-1-yl-3-trifluoromethyl-benzamide(EPPTB)prevents 3-iodothyronamine(T1AM)-induced neuroprotection against kainic acid toxicity[J]. Neurochem Int,2019,129:104460.
[13] LOUZADA R A,CARVALHO D P. Similarities and diffe- rences in the peripheral actions of thyroid hormones and their metabolites[J]. Front Endocrinol(Lausanne),2018,9:394.
[14] PIEHL S,HOEFIG C S,SCANLAN T S,et al. Thyrona- mines:past,present,and future[J]. Endocr Rev,2011,32(1):64-80.
[15] CUMERO S,FOGOLARI F,DOMENIS R,et al. Mitochondrial F(0)F(1)-ATP synthase is a molecular target of 3-iodothyronamine,an endogenous metabolite of thyroid hormone[J]. Br J Pharmacol,2012,166(8):2331-2347.
[16] FRASCARELLI S,GHELARDONI S,CHIELLINI G,et al. Cardioprotective effect of 3-iodothyronamine in perfused rat heart subjected to ischemia and reperfusion[J]. Cardiovasc Drugs Ther,2011,25(4):307-313.
[17] ZUCCHI R,ACCORRONI A,CHIELLINI G. Update on 3-iodothyronamine and its neurological and metabolic actions[J]. Front Physiol,2014,5:402.
[18] SACRIPANTI G,LORENZINI L,BANDINI L,et al. 3-iodothyronamine and 3,5,3′-triiodo-L-thyronine reduce SIRT1 protein expression in the HepG2 cell line[J/OL]. Horm Mol Biol Clin Investig,2020,41(1):20190045[2021-06-28]. https://doi.org/10.1515/hmbci-2019-0045.
[19] KÖHRLE J,BIEBERMANN H. 3-iodothyronamine:a thyroid hormone metabolite with distinct target profiles and mode of action[J]. Endocr Rev,2019,40(2):602-630.
[20] LAURINO A,LANDUCCI E,RAIMONDI L. Central effects of 3-iodothyronamine reveal a novel role for mitochondrial monoamine oxidases[J]. Front Endocrinol(Lau- sanne),2018,9:290.
[21] PIEHL S,HEBERER T,BALIZS G,et al. Thyronamines are isozyme-specific substrates of deiodinases[J]. Endocrinology,2008,149(6):3037-3045.
[22] ACCORRONI A,SAPONARO F,ZUCCHI R. Tissue thyroid hormones and thyronamines[J]. Heart Fail Rev,2016,21(4):373-390.
[23] HACKENMUELLER S A,MARCHINI M,SABA A,et al. Biosynthesis of 3-iodothyronamine(T1AM)is dependent on the sodium-iodide symporter and thyroperoxidase but does not involve extrathyroidal metabolism of T4[J]. Endocrinology,2012,153(11):5659-5667.
[24] AGRETTI P,DE MARCO G,RUSSO L,et al. 3-iodothyronamine metabolism and functional effects in FRTL5 thyroid cells[J]. J Mol Endocrinol,2011,47(1):23-32.
[25] SABA A,CHIELLINI G,FRASCARELLI S,et al. Tissue distribution and cardiac metabolism of 3-iodothyronamine[J]. Endocrinology,2010,151(10):5063-5073.
[26] HOEFIG C S,KÖHRLE J,BRABANT G,et al. Evidence for extrathyroidal formation of 3-iodothyronamine in humans as provided by a novel monoclonal antibody-based chemiluminescent serum immunoassay[J]. J Clin Endocrinol Metab,2011,96(6):1864-1872.
[27] HOEFIG C S,WUENSCH T,RIJNTJES E,et al. Biosynthesis of 3-iodothyronamine from T4 in murine intestinal tissue[J]. Endocrinology,2015,156(11):4356-4364.
[28] 趙强,吴镭,李佳,等.重大疾病导向的G蛋白偶联受体研究[J].中国基础科学,2015,17(3):3-8,25.
[29] 李聰慧,崔诗遥,顾燕燕,等. G蛋白偶联受体的研究进展[J].蚕桑通报,2019,50(2):4-7,15.
[30] LI X Y,XIE L,QU X L,et al. GPR91,a critical signaling mechanism in modulating pathophysiologic processes in chronic illnesses[J]. FASEB J,2020,34(10):13091- 13105.
[31] LINDEMANN L,EBELING M,KRATOCHWIL N A,et al. Trace amine-associated receptors form structurally and functionally distinct subfamilies of novel G protein-coupled receptors[J]. Genomics,2005,85(3):372- 385.
[32] LINDEMANN L,HOENER M C. A renaissance in trace amines inspired by a novel GPCR family[J]. Trends Pharmacol Sci,2005,26(5):274-281.
[33] RUTIGLIANO G,BRÄUNIG J,DEL GRANDE C,et al. Non-functional trace amine-associated receptor 1 variants in patients with mental disorders[J]. Front Pharmacol,2019,10:1027.
[34] DHAKAL S,MACREADIE I. Tyramine and amyloid beta 42:a toxic synergy[J]. Biomedicines,2020,8(6):145.
[35] KOKKINOU M,IRVINE E E,BONSALL D R,et al. Reproducing the dopamine pathophysiology of schizophrenia and approaches to ameliorate it:a translational ima- ging study with ketamine[J]. Mol Psychiatry,2021,26(6):2562-2576.
[36] HOEFIG C S,ZUCCHI R,KÖHRLE J. Thyronamines and derivatives:physiological relevance,pharmacological actions,and future research directions[J]. Thyroid,2016,26(12):1656-1673.
[37] CHIELLINI G,FRASCARELLI S,GHELARDONI S,et al. Cardiac effects of 3-iodothyronamine:a new aminergic system modulating cardiac function[J]. FASEB J,2007,21(7):1597-1608.
[38] BENJAMIN E J,BLAHA M J,CHIUVE S E,et al. Heart disease and stroke statistics-2017 update:a report from the American Heart Association[J]. Circulation,2017,135(10):e146-e603.
[39] LA COUR J L,CHRISTENSEN H M,KÖHRLE J,et al. Association between 3-iodothyronamine(T1AM)concentrations and left ventricular function in chronic heart fai- lure[J]. J Clin Endocrinol Metab,2019,104(4):1232- 1238.
[40] LV J N,LIAO J,TAN W,et al. 3-iodothyronamine acting through an anti-apoptotic mechanism is neuroprotective against spinal cord injury in rats[J]. Ann Clin Lab Sci,2018,48(6):736-742.
[41] BANGERT C,RINDLER K,KRAUSGRUBER T,et al. Persistence of mature dendritic cells,TH2A,and Tc2 cells characterize clinically resolved atopic dermatitis under IL-4Rα blockade[J]. Sci Immunol,2021,6(55):eabe2749.
[42] DINTER J,KHAJAVI N,MÜHLHAUS J,et al. The multitarget ligand 3-iodothyronamine modulates β-adrenergic receptor 2 signaling[J]. Eur Thyroid J,2015,4(Suppl 1):21-29.
[43] TOMINAGA M,CATERINA M J. Thermosensation and pain[J]. J Neurobiol,2004,61(1):3-12.
[44] TOMINAGA M,TOMINAGA T. Structure and function of TRPV1[J]. Pflügers Arch,2005,451(1):143-150.
[45] NILIUS B,OWSIANIK G,VOETS T,et al. Transient receptor potential cation channels in disease[J]. Physiol Rev,2007,87(1):165-217.
[46] KHAJAVI N,REINACH P S,SLAVI N,et al. Thyro- namine induces TRPM8 channel activation in human conjunctival epithelial cells[J]. Cell Signal,2015,27(2):315- 325.
[47] KENNETT G A,DOURISH C T,CURZON G. 5-HT1B agonists induce anorexia at a postsynaptic site[J]. Eur J Pharmacol,1987,141(3):429-435.
[48] BRÄUNIG J,DINTER J,HÖFIG C S,et al. The trace amine-associated receptor 1 agonist 3-iodothyronamine induces biased signaling at the serotonin 1b receptor[J]. Front Pharmacol,2018,9:222.
[49] LAURINO A,MATUCCI R,VISTOLI G,et al. 3-iodothyronamine(T1AM),a novel antagonist of muscarinic receptors[J]. Eur J Pharmacol,2016,793:35-42.
[50] Correction to:heart disease and stroke statistics-2017 update:a report from the American Heart Association[J]. Circulation,2017,135(10):e646
[51] ZHOU H Y,HU B L,LIU X D. Thyroid hormone metabolite 3-iodothyronamine(T1AM)alleviates hypoxia/reoxygenation-induced cardiac myocyte apoptosis via Akt/FoxO1 pathway[J]. Med Sci Monit,2020,26:e923195. DOI:10.12659/MSM.923195.
[52] LOMONOSOVA Y N,SHENKMAN B S,NEMIROVSKAYA T L. Attenuation of unloading-induced rat soleus atrophy with the heat-shock protein inducer 17-(allylamino)-17- demethoxygeldanamycin[J]. FASEB J,2012,26(10):4295-4301.
[53] JU H,KIM T,CHUNG C M,et al. Metabolic suppression by 3-iodothyronamine induced muscle cell atrophy via activation of FoxO-proteasome signaling and downregulation of Akt1-S6K signaling[J]. Biol Pharm Bull,2017,40(5):576-582.
[54] ROGOWSKI M,BELLUSCI L,SABATINI M,et al. Lipolytic effects of 3-iodothyronamine(T1AM)and a novel thyronamine-like analog SG-2 through the AMPK pathway[J]. Int J Mol Sci,2019,20(16):E4054.
[55] JU H,SHIN H,SON C,et al. 3-Iodothyronamine-media- ted metabolic suppression increases the phosphorylation of AMPK and induces fuel choice toward lipid mobilization[J]. Horm Metab Res,2014,47(8):605-610.
[56] KIM M,PARK K,CHOI I. The metabolic suppressor 3-iodothyronamine enhances lipolysis in 3T3-L1 adipocytes via activation of the adenosine monophosphate-activated protein kinase/forkhead box O1 signaling pathway[J]. J Physiol pharmacol,2020,71(3):409-416.
[57] RINE J,STRATHERN J N,HICKS J B,et al. A suppressor of mating-type locus mutations in Saccharomyces cerevisiae:evidence for and identification of cryptic ma- ting-type loci[J]. Genetics,1979,93(4):877-901.
[58] HSU Y C,WU Y T,TSAI C L,et al. Current understan- ding and future perspectives of the roles of sirtuins in the reprogramming and differentiation of pluripotent stem cells[J]. Exp Biol Med(Maywood),2018,243(6):563- 575.
[59] ASSADI-PORTER F M,REILAND H,SABATINI M,et al. Metabolic reprogramming by 3-iodothyronamine(T1AM):a new perspective to reverse obesity through co-regulation of sirtuin 4 and 6 expression[J]. Int J Mol Sci,2018,19(5):E1535.
[60] BELLUSCI L,LAURINO A,SABATINI M,et al. New insights into the potential roles of 3-iodothyronamine(T1AM)and newly developed thyronamine-like TAAR1 agonists in neuroprotection[J]. Front Pharmacol,2017,8:905.
(收稿日期:2021-07-19 修回日期:2021-12-15)
(編辑:邹丽娟)

