外周血miR-21、miR-15a表达对原发性肝癌患者淋巴结转移的诊断分析
梅建民, 聂洪峰, 孙伯洋, 姚军波
中国人民解放军总医院第七医学中心肝胆外科,北京 100700
原发性肝癌(primary liver cancer,PLC)是目前最为常见的恶性肿瘤类型之一,在我国其发病率和死亡率均位居第2[1]。目前国内外仍缺乏高效的PLC治疗方案,患者的5年生存率仅有10%~15%[2],而如何增强患者的疗效、提高其生存率仍是该领域目前研究的重点。研究[3]认为,淋巴结转移是PLC患者复发/转移、死亡的危险因素,需及时清除转移的淋巴结。术前影像学检查可反映淋巴结转移的发生情况,但准确性不甚理想,容易漏诊,且淋巴结肿大和淋巴结转移鉴别难度大。miR-21、miR-15a均在既往的研究中被证实与恶性肿瘤有密切关系[4-6],其中miR-21有调控细胞增殖、凋亡、迁移等作用,且在PLC患者中其表达升高,可抑制磷酸酯酶与张力蛋白同源物(phospatase and tensing homolog, PTEN)基因发挥促癌作用[7];miR-15a不仅可调控细胞增殖、生长和凋亡,还可影响其迁移与侵袭活性,且有研究指出在早期乙型肝炎病毒感染患者中血清miR-15a表达下降[8]。但PLC患者外周血miR-15a表达变化及miR-21、miR-15a是否可评估淋巴结转移情况尚需进一步探讨。本研究回顾性分析96例PLC患者和88名健康志愿者的资料探讨上述问题,以期寻找可靠的淋巴结转移评估指标。
1 资料与方法
1.1 一般资料回顾性分析我院2018年3月至2020年4月收治的96例PLC患者和招募的88名健康志愿者的资料,分别记为A组和B组。A组男78例,女18例,年龄(56.55±7.81)岁(37~65岁),临床分期:Ⅰb期2例、Ⅱa期17例、Ⅱb期36例、Ⅲa期41例,肝功能Child分级:A级37例、B级59例,组织分型:肝细胞癌78例、胆管上皮癌14例、混合性肝癌4例。根据配对原则选取B组,B组男73名,女15名,年龄(57.05±7.65)岁(35~65岁)。两组性别、年龄相比,差异无统计学意义(P>0.05),具有可比性。本研究符合世界医学大会赫尔辛基宣言。本研究经过我院伦理委员会批准。
1.2 纳入及排除标准纳入标准:(1)A组均经病理证实为PLC,B组均为健康志愿者;(2)成年人,且年龄均≤65岁;(3)A组均符合根治性切除术指征,且均实施该术式;(4)A组均经病理检查明确淋巴结转移情况。
排除标准:(1)复发性肝癌或转移性肝癌者;(2)有精神或沟通障碍者;(3)外周血miR-21、miR-15a检测与淋巴结转移病理检查间隔时间≥1个月者;(4)资料记录不完整者。
1.3 方法血清miR-21、miR-15a检测方法:A组均于确诊后治疗前、B组均于纳入研究后空腹检测外周血miR-21、miR-15a表达,空腹抽取5 ml静脉血,室温静置1 h,离心分离(1 500 r/min,10 cm,10 min),取上清液按照血清总RNA提取试剂盒(美国Invitrogen公司,货号15596018)操作,鉴定其纯度。采用miScript试剂盒(德国QIAGEN公司,货号218160)利用ploy(A)聚合酶加尾逆转录获得互补的脱氧核糖核酸(cDNA),设置反应体系:0.5 μg总RNA+4 μl逆转录混合反应液+1 μl反转录酶混合液。采用聚合酶链反应试剂盒(美国Sigma公司,货号MP0035-1KT)进行处理,设置U6为内参,其中miR-21 RT引物序列:5′-ATCGCTAAGAGCTATATGCTAGAGC-3′,qRT-PCR引物正义链:5′-TCGTAGAGCTAGAGCTAGC-3′,qRT-PCR引物反义链:5′-AGCTAGAGGCTAGAGCTA-3′;miR-15a RT引物序列:5′-GTTGGCTTAGAGCTAGAGCTAGACTAGCTA-3′,qRT-PCR引物正义链:5′-CTGATAGCTATAGCTAG-3′,qRT-PCR引物反义链:5′-ATGTGGGGATAGCTAGCTAG-3′,U6 RT引物序列:5′-TGCGATAGGCTATAGCGGAGAGATCGAGACTAG-3′,qRT-PCR引物正义链:5′-TGGGATAGCGGATAGCTAGCTA-3′,qRT-PCR引物反义链:5′-AGCGCGATAGGCGGCTAAGCTA-3′。PCR仪(美国ABI公司,9700型)反应流程:95 ℃ 3 min(预变性),90 ℃ 5 s(变性),60 ℃ 30 s(退火),54 ℃ 60 s(延伸),共40个循环,最后72 ℃ 10 min终止反应。当温度由60 ℃升至95 ℃,利用PCR仪定时监测荧光信号,绘制溶解曲线,计算2-△△Ct值,其中△Ct=Ct(目的基因)-Ct(内参),△△Ct=Ct(目的基因)-Ct(内参)-[Ct(基准样品)-Ct(内参)]。
1.4 观察指标(1)对比A组、B组血清miR-21、miR-15a表达;(2)对比A组中有和无淋巴结转移患者血清miR-21、miR-15a表达,其中淋巴结是否转移以病理检查结果为“金标准”;(3)分析血清miR-21、miR-15a及二者联合对A组淋巴结转移的评估价值,其中二者评估均为阳性即认为联合评估阳性,二者评估任一项为阴性即认为联合评估阴性。
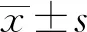
2 结果
2.1 A组、B组血清miR-21、miR-15a表达对比A组血清miR-21表达高于B组,miR-15a表达低于B组,差异均有统计学意义(P<0.05,见表1)。
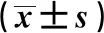
表1 A组、B组血清miR-21、miR-15a表达对比
2.2 A组中有和无淋巴结转移患者血清miR-21、miR-15a表达对比A组中有29例患者有淋巴结转移,淋巴结转移发生率为30.21%(29/96)。29例淋巴结转移患者均经术中所见(未实施手术者均经肝穿活检后病理检查)证实,其中门腔间隙组、肝门组、腹主动脉旁组、腹腔肝动脉旁组、肠系膜上动脉旁组、肝胃韧带组、膈脚后组、肝十二指肠韧带组、心包旁组分别有15例、8例、7例、4例、3例、2例、1例、1例、1例,占比分别为51.72%、27.59%、24.14%、13.79%、10.34%、6.90%、3.45%、3.45%、3.45%,2组同时转移者5例,3组及以上同时转移者3例,占比分别为17.24%、10.34%。
A组中有淋巴结转移患者与无淋巴结转移患者的性别、年龄、组织分型比较,差异均无统计学意义(P>0.05),有淋巴结转移患者肝功能Child分级B级占比高于无淋巴结转移患者(P<0.001,见表2)。
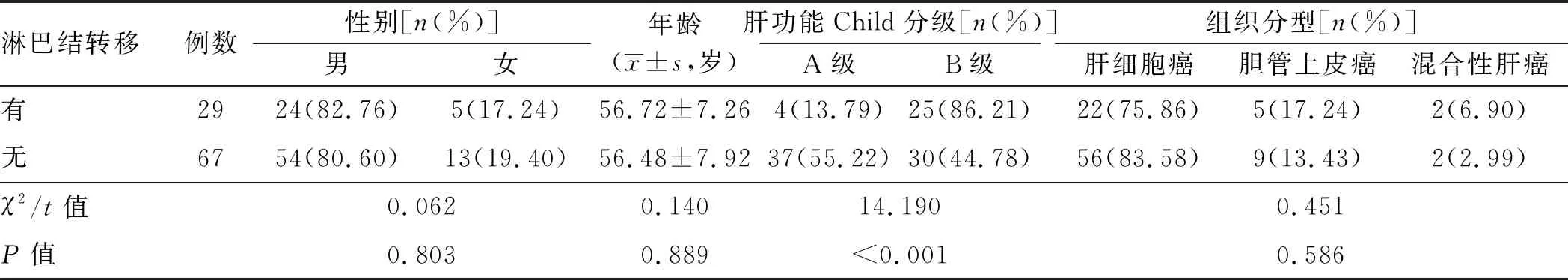
表2 A组中有和无淋巴结转移患者一般资料比较
A组中有淋巴结转移患者血清miR-21表达高于无淋巴结转移患者,miR-15a表达低于无淋巴结转移患者,差异均有统计学意义(P<0.05,见表3)。
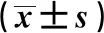
表3 A组中有和无淋巴结转移患者血清miR-21、miR-15a表达对比
2.3 血清miR-21、miR-15a及二者联合对A组淋巴结转移的评估价值分析血清miR-21、miR-15a对A组淋巴结转移评估的Cut-off值分别为1.43、0.28,二者联合评估的灵敏度、特异度、AUC分别为96.55%、97.01%、0.938,其中灵敏度与单独评估相当,特异度、AUC均高于单独评估,且AUC对比差异均有统计学意义(Z=3.728,P=0.021;Z=2.115,P=0.039)(见图1、表4)。
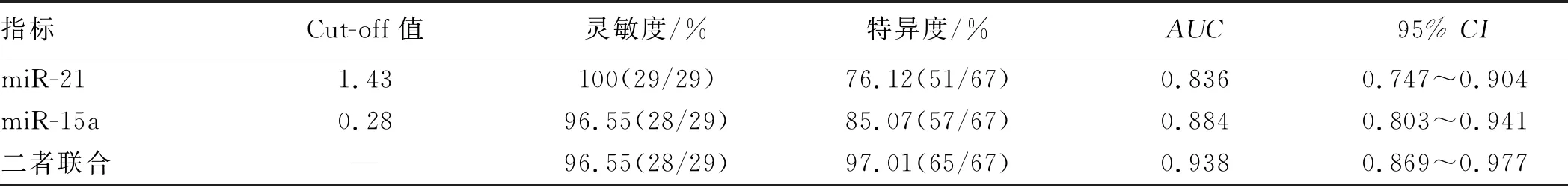
表4 血清miR-21、miR-15a及二者联合对A组淋巴结转移的评估价值分析
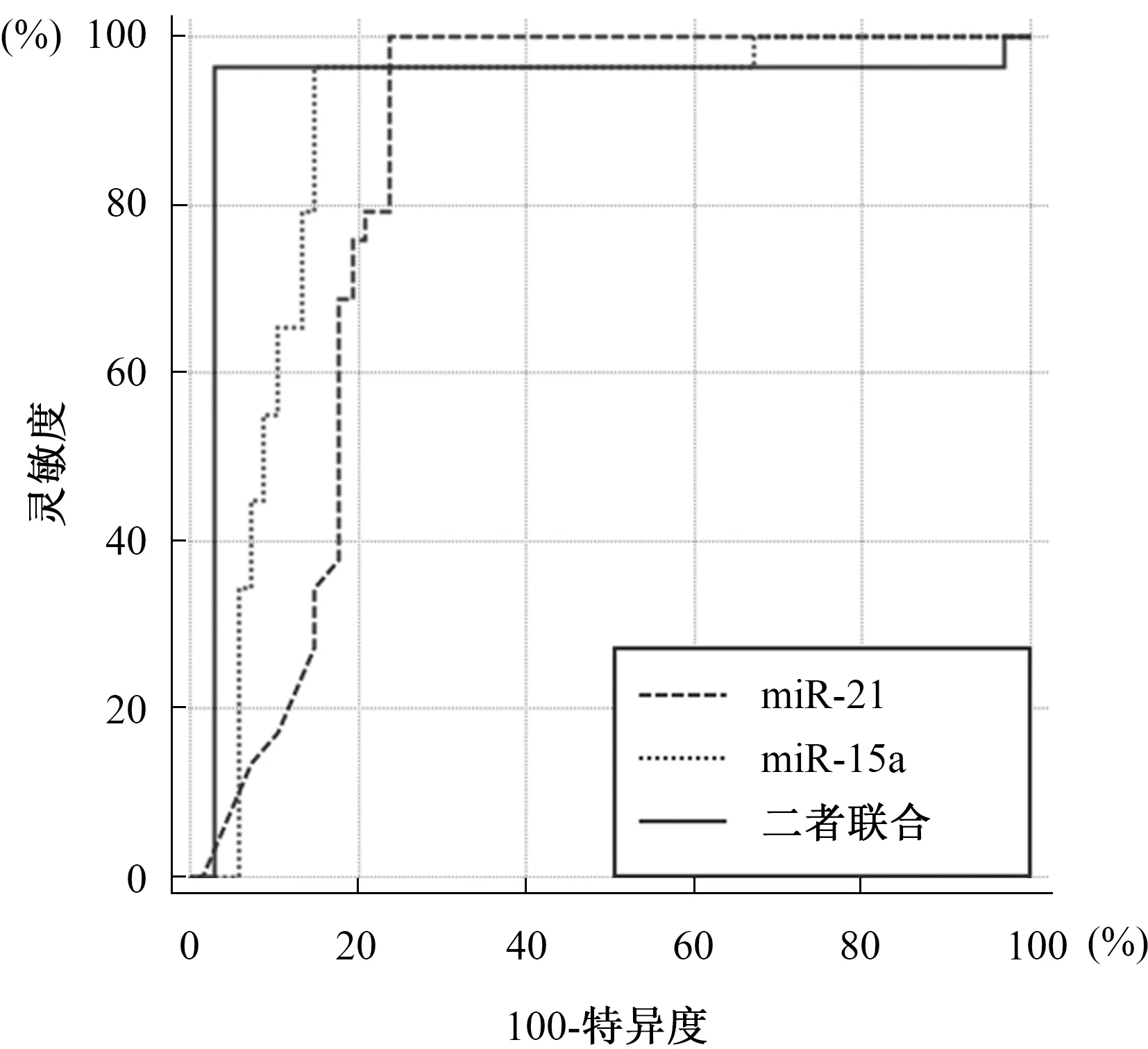
图1 血清miR-21、miR-15a及二者联合对A组淋巴结转移的评估价值
3 讨论
淋巴结转移是指浸润的肿瘤细胞穿过淋巴管壁脱落并随着淋巴液至汇流区,并以此为中心形成新病灶的病理现象,淋巴结转移可广泛累及脏器组织,也是肿瘤最为常见的转移方式之一[9-10]。报道[11]显示,PLC患者若有淋巴结转移需及时清除,方可延缓病情发展,一旦伴有广泛淋巴结转移甚至是骨转移,将会增加治疗难度,且此类患者大多生存期仅为3~6个月。因此,及早发现转移的淋巴结并及时清扫对控制PLC患者的病情发展有至关重要的作用。然而目前临床上常用的淋巴结转移诊断方法仍有局限性,血清肿瘤标志物表达评价淋巴结转移情况常不具有特异性[12],亟待探讨新的、敏感度和特异度高的评价指标。
miRNAs是一类短序列、非编码的小分子RNA,通常情况下包含有20~22个核苷酸,具有生物学调控功能。miRNAs可与靶mRNAs的3端非编码区互补结合,导致后者翻译抑制。研究[13-14]发现,miR-21均是细胞内重要的核酸调节分子,可控制细胞内信息流量,参与细胞增殖、生长、迁移、凋亡等过程,并且还可参与调控生物生长发育。本研究中A组血清miR-21表达高于B组,可知在PLC患者中血清miR-21偏高。有报道[15]显示,PLC患者中血清miR-21表达升高,本研究结果与上述报道相符。另有研究[16]显示,在胆管癌发生过程中,miR-21表达无明显变化,本研究报道与该研究不一致,分析可能由于在不同部位恶性肿瘤发生和发展过程中miR-21的作用与机制不同所致。miR-21可调控多种抑癌基因,如PTEN、组织金属蛋白酶抑制剂3、Kazal基序逆向诱导富含半胱氨酸蛋白等,使得上述抑癌基因表达下降,恶性肿瘤细胞的增殖、迁移能力均增强,而凋亡受抑制,因此可参与肝癌的发生和发展。本研究还发现,A组患者淋巴结转移发生率为30.21%,提示探讨理想的淋巴结转移评估指标有其重要性和必要性。本研究中有无淋巴结转移患者的性别、年龄、组织分型均接近,表明二者具有可比性;有淋巴结转移患者肝功能Child B级占比高于无淋巴结转移患者,可能是因为有淋巴结转移患者病情更严重,肝功能受损也越严重。本研究中ROC分析发现,血清miR-21对A组淋巴结转移评估的Cut-off值为1.43,灵敏度为100%,特异度和AUC分别为76.12%、0.836,表明血清miR-21可用于评估PLC患者淋巴结转移情况。既往研究[17]显示,PLC患者有淋巴结转移者血清miR-21高于无淋巴结转移者,本研究结果与该研究一致,且上述报道还显示血清miR-21高表达与淋巴结转移相关。分析其中原因为:miR-21表达越高,对各种抑癌基因的抑制作用越强,恶性肿瘤细胞迁移的活性越强,因此更容易发生淋巴结转移,且血清miR-21可作为淋巴结转移的评价指标。
本研究还发现A组血清miR-15a表达低于B组,且A组中有淋巴结转移者血清miR-15a表达低于无淋巴结转移者,表明PLC患者血清miR-15a表达偏低,且有淋巴结转移者其表达更低。有研究[18-19]发现,miR-15a表达下降可激活可易位C-myc基因和蛋白的表达,增加细胞周期蛋白D1的活性,从而导致细胞无限增殖,参与组织损伤,诱发恶性肿瘤。本研究结果与上述报道中的部分结果相符,共同表明血清miR-15a表达下降可能是PLC发生和发展的重要因素。根据上述分析可以推测,血清miR-15a表达越低,C-myc和细胞周期蛋白D1的活性越强,细胞的恶性程度越高,淋巴结转移的风险也可能会随之增加。本研究ROC分析结果中显示,血清miR-15a表达评估A组淋巴结转移的Cut-off值为0.28,且灵敏度、特异度、AUC分别为96.55%、85.07%、0.884,说明血清miR-15a表达可用于评估PLC患者淋巴结转移情况。
血清miR-21可通过调控多种抑癌基因参与PLC的发生和发展,而miR-15a则可通过调控C-myc和细胞周期蛋白D1促进PLC的发生和发展,因而了解二者的表达变化可从不同角度了解此类患者的病情状况。本研究中血清miR-21联合血清miR-15a评估A组淋巴结转移的灵敏度与单独评估相当,特异度和AUC均高于单独评估,提示二者联合对PLC患者淋巴结转移情况的评估效能更高。
综上所述,在PLC患者中血清miR-21表达偏高,而miR-15a表达偏低,且有淋巴结转移者前者的表达更高,后者的表达更低,二者联合评估淋巴结转移的灵敏度与单独评估一致,特异度和AUC均较高,建议联合二者进行评估以提高效能。

