家族性腺瘤性息肉病与散发性结直肠腺瘤血清代谢物特征谱的比较分析
尹馥梅, 郭家池, 许俊锋, 张 杰, 王凤玉, 潘元明, 盛剑秋,
1.解放军医学院,北京 100853; 2.中国人民解放军总医院第七医学中心消化内科; 3.中国人民解放军总医院第一医学中心消化内科医学部; 4.首都医科大学附属北京胸科医院肿瘤研究中心
家族性腺瘤性息肉病(familial adenomatous polyposis,FAP)和散发性结直肠腺瘤(colorectal adenoma,CRA)是结直肠癌主要的癌前病变,其中85%~90%的结直肠癌来源于CRA[1],1%来源于FAP[2]。FAP作为一种常染色体显性遗传病,若不及时处理,结直肠癌的风险可达100%,远高于CRA。FAP发生腺瘤通常由家族性腺瘤样结肠息肉病易感基因(adenomatous polyposis coli,APC)等位基因发生突变引起[3],其中一个等位基因发生遗传突变,而另一等位基因发生体细胞突变或基因缺失,进而导致功能性APC蛋白缺失和β-连环蛋白异常蓄积[4]。近年来,随着代谢组学相关技术的快速发展,越来越多的研究开始关注疾病相关代谢物的变化,其中血液代谢物的异常分布与结直肠癌的发展已成为研究热点[5-6]。有研究[7]表明,APC基因突变致使Wnt信号通路及其靶基因发生转录激活后会引起代谢谱的改变。因此,本研究基于超高效液相色谱串联质谱(ultra-high performance liquid chromatography and tandem mass-spectrometry,UPLC-MS/MS)检测平台,通过Metwell数据库和多元统计分析,比较FAP与CRA患者的血清代谢物差异,筛选出FAP特异性代谢谱,为其发病机制的深入研究提供新的思路,同时根据重要代谢谱特征,为FAP疾病的发展建立预警指标模型提供相关基础。
1 资料与方法
1.1 研究对象在2017年3月1日至2020年12月31日于中国人民解放军总医院第七医学中心消化内镜中心行结肠镜检查的患者中进行筛选。最终共收集32例受试者,包括FAP患者(n=24)和性别、年龄相匹配的CRA患者(n=8)。本研究经中国人民解放军总医院第七医学中心伦理委员会批准(No.2022-132),所有受试者均同意留取血液标本,并签署知情同意书。
1.2 血液标本收集及保存晨起空腹采集外周血5 ml(采用不含抗凝剂的真空采血管),静置60 min待血液凝固。随后,以3 000 r/min,4 ℃条件下离心10 min。最后将上清液分装至冻存管,保存在-80 ℃冰箱中。
1.3 血清样品制备从-80 ℃冰箱中取出血清样品,在4 ℃下解冻。取100 μl血清于EP管中,加入甲醇300 μl。随后,使用搅拌机(MM400,Retsch),涡旋3 min后,在12 000 r/min,4 ℃条件下离心10 min。最后,取上清液于新的EP管中,在12 000 r/min,4 ℃条件下再次离心3 min后,吸取上清液保存于进样瓶中,用于UPLC-MS/MS分析。
1.4 液相色谱与质谱分析数据采集仪器系统主要包括UPLC-MS/MS。液相条件主要包括:色谱柱:Waters ACQUITY UPLC HSS T3 C18(1.8 μm,2.1 mm×100 mm);流动相:A相为超纯水(0.04%的乙酸),B相为乙腈(0.04%的乙酸);洗脱梯度:0 min水/乙腈(95∶5 V/V),11.0 min为5∶95 V/V,12.0 min为5∶95 V/V,12.1 min为95∶5 V/V,15.0 min为95∶5 V/V;流速0.4 ml/min;柱温为40 ℃;进样量为5 μl。质谱条件主要包括:电喷雾离子源温度550 ℃,质谱电压5 500 V,帘气25 psi,碰撞诱导电离参数设置为高。在三重四级杆中,每个离子对是根据优化的去簇电压和碰撞能进行扫描检测。
1.5 数据处理和代谢组学分析
1.5.1 数据预处理:基于Metwell数据库及代谢物信息公共数据库,使用软件Analyst1.6.1对质谱检测的一级谱、二级谱数据进行定性分析。通过MultiaQuant软件,利用三重四级杆质谱的多反应监测模式(multiple reaction monitoring,MRM)进行定量分析,对色谱峰进行积分和校正,每个色谱峰的曲线下面积代表对应物质的相对含量。
1.5.2 质控分析:本实验主要采用的是主成分分析(principal component analysis,PCA),我们在PCA过程中每10个检测分析样本中插入1个质控样本(quality control,QC),以监测血清样本分析过程的重复性和稳定性。其中,QC由样本提取物混合制备而成。QC样本聚集得越好,就越表明仪器的稳定,则采集到的数据质量越好。
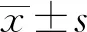
2 结果
2.1 FAP和CRA患者的临床资料本研究共纳入32例受试者,24例FAP患者分别来自22个确诊的FAP家系,男12例,女12例,年龄(38.0±14.9)岁(16~69岁);8例CRA患者选自我院消化内科门诊,男4例,女4例,年龄(42.4±5.2)岁(34~52岁)。两组患者在性别(P=0.5)和年龄(P=0.43)方面比较,差异无统计学意义,FAP和CRA患者的结肠镜下表现和病理特征如图1所示。
2.2 FAP与CRA的血清代谢谱比较PCA评分图显示了CRA与FAP组之间的分离趋势,两组之间存在明显差异(见图2A)。随后构建OPLS-DA模型,并基于238种代谢物,选出前10个上调(红色标记)和前10个下调的(绿色标记)代谢物(见图2B)。通过两个正交成分和一个预测成分(R2X=0.619,R2Y=0.999,Q2Y=0.995)(见图2C)来证明建模和预测能力。进一步对OPLS-DA模型进行排列验证(n=200,即进行200次排列实验)(见图2D)。最终结果表明,通过UPLC-MS/MS检测的FAP患者的血清代谢谱与CRA组不同。
2.3 FAP血清特异性代谢物筛选基于OPLS-DA模型的结果,我们同时选择符合VIP值(≥1)和FC(≤0.5或≥2)条件的代谢物,最终确认了85个显著差异代谢物,其中20个上调代谢物,65个下调代谢物。图3A的火山图展示了FAP组和CRA组血清代谢物表达的差异。为了进一步挖掘代谢物的变化,我们对具有显著差异的代谢物进行了归一化处理,并绘制了聚类热图(见图3B)。与CRA组相比,反,反-粘康酸(Trans, Trans-muconic acid)是FAP患者代谢物中表达下降最为显著的一种,其倍数变化最大(FC=483.4)。1,5-无水葡萄糖醇(1,5-anhydro-D-glucitol)是FAP患者中表达增加最为显著的代谢物(FC=4.33×10-5)。如图2B所示,显著上调前10位的血清代谢物包括1,5-无水葡萄糖醇、阿糖肌苷(Hypoxanthine-9-B-D-arabinofuranoside)、苯丙氨酸二肽(Phe-Phe)、D-木糖酸锂盐(D-xylonic acid lithium salt)、3-甲基-2-氧基丁酸(3-methyl-2-oxobutanoic acid)、D-天冬氨酸(D-aspartic acid)、乳清酸(Orotic acid)、氢化肉桂酸(Hydrocinnamic acid)、L-鸟氨酸(L-ornithine)和2,6-二氨基庚二酸(2,6-Diaminooimelic acid)。显著下调的前10位血清代谢物包括反,反-粘康酸(Trans, Trans-muconic acid)、L-瓜氨酸(L-citrulline)、N-乙酰-L-亮氨酸(N-acetyl-L-leucine)、牛磺鹅脱氧胆酸(Taurochenodesoxycholic acid)、甘氨脱氧胆酸(Glycodeoxycholic acid)、L-无水天冬酰胺(L-asparagine anhydrous)、甲基丙二酸(Methylmalonic acid)、牛磺胆酸(Taurocholic acid)、甘氨鹅脱氧胆酸(Glycochenodeoxycholic acid)和棕榈烯酸[Palmitoleic acid (C16∶1)]。
注:A:PCA图;B:前10个上调(红色标记)和前10个下调(绿色标记)的代谢物;C:OPLS-DA图(R2X、R2Y和Q2Y是评估模型的预测参数,这三个指标越接近1,模型越稳定且可靠,Q2Y>0.5视为有效模型,Q2Y>0.9视为出色的模型);D:OPLS-DA模型验证。
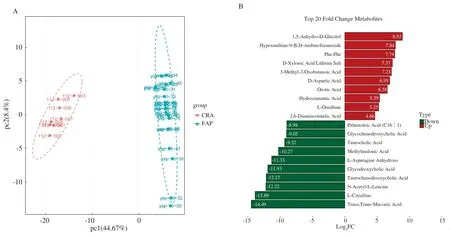
2.4 FAP特异性代谢物功能分析KEGG数据库分析结果表明,如图3C~3D所示,与CRA组相比,FAP组有77个关键代谢途径改变,其中主要涉及氨基酸和核苷酸代谢(包括谷胱甘肽代谢,精氨酸生物合成,丙氨酸、天冬氨酸和谷氨酸代谢)、碳水化合物代谢和脂肪酸代谢等。本研究将主要关注表1中碳水化合物和氨基酸的改变。与CRA组相比,FAP患者的1,5-无水葡萄糖醇表达明显升高,木糖醇、L-岩藻糖、果糖、葡萄糖、甘露糖、A-D-葡萄糖、阿拉伯糖和吡喃葡萄糖表达下降。在氨基酸中,甘氨酸、天冬氨酸、异亮氨酸、谷氨酸、胱氨酸、苏氨酸、天冬酰胺、亮氨酸和瓜氨酸表达显著降低。
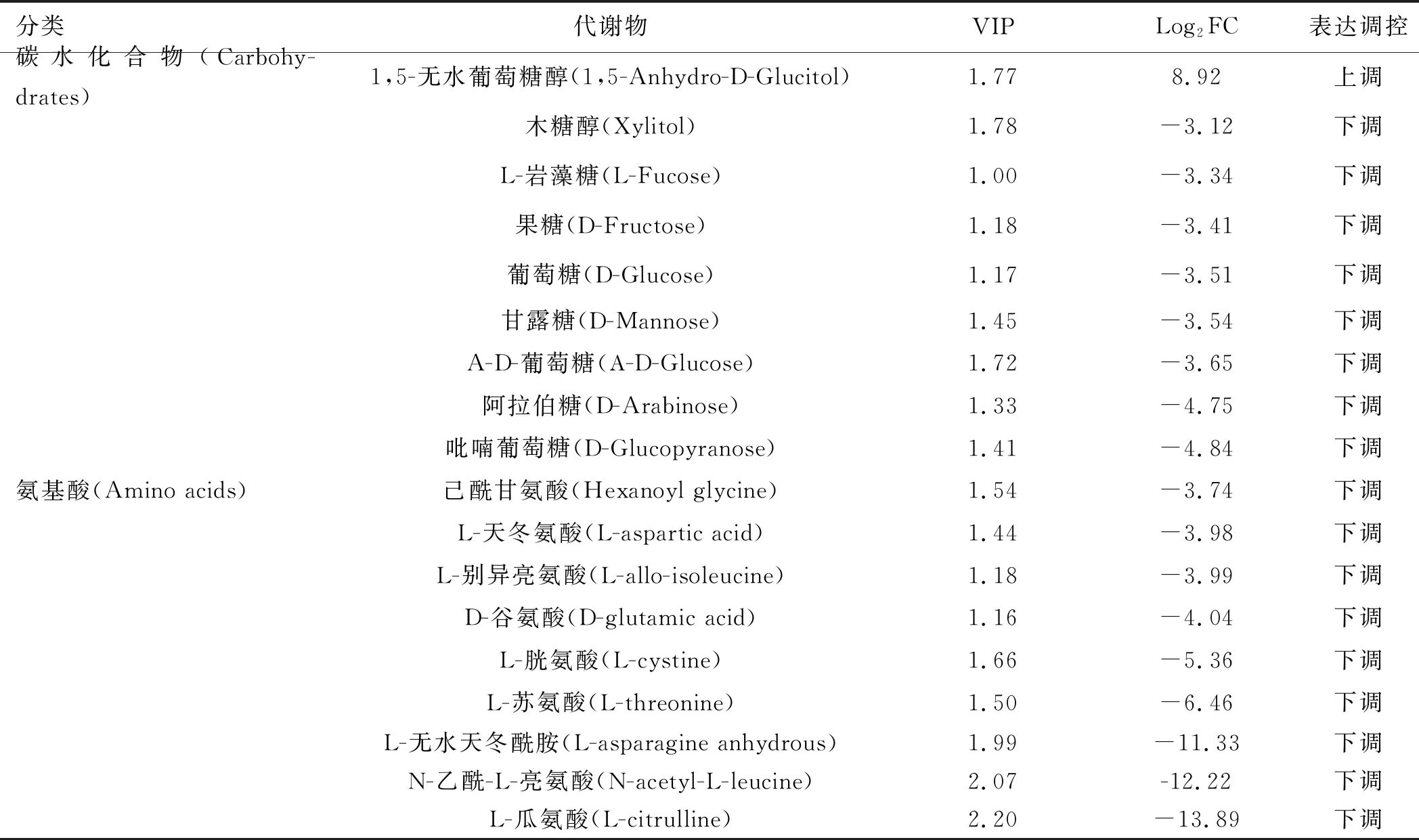
表1 通过KEGG分析鉴定的碳水化合物和氨基酸代谢中的主要代谢产物
注:A:火山图(每个点代表代谢物);B:聚类热图;C:KEGG注释代谢物分类;D:KEGG富集的代谢产物分类。
3 讨论
近年来,分析和监测与疾病相关的代谢改变,尤其是肿瘤微环境与代谢途径的变化,以探索更多的潜在机制逐渐成为研究热点。有研究[8]通过SW480细胞和APCmin/+小鼠表达APC基因截短蛋白表明,APC基因突变会导致机体代谢谱的改变。然而,截至目前在FAP患者中分析APC突变引起的代谢组学变化的研究甚少。本研究通过UPLC-MS/MS分析,首次比较分析了FAP和CRA的血清代谢谱特征,掌握了APC基因突变引起的代谢特征。共筛选出85种在两组中具有明显差异的代谢物,包括表达上调的20种和表达下调的65种。进一步通过KEGG分析发现,与CRA组相比,FAP患者的碳水化合物代谢中,木糖醇、L-岩藻糖、果糖、葡萄糖、甘露糖、A-D-葡萄糖、阿拉伯糖和吡喃葡萄糖的表达均下降,而1,5-无水葡萄糖醇的表达明显升高。同时FAP患者氨基酸代谢异常,包括甘氨酸、天冬氨酸、异亮氨酸、谷氨酸、胱氨酸、苏氨酸、天冬酰胺、亮氨酸和瓜氨酸表达显著降低。本研究结果表明,FAP患者血清中存在特征性代谢谱改变,涉及碳水化合物代谢和氨基酸代谢。有研究[8-9]发现,APC基因突变导致功能丧失引起Wnt/β-catenin信号过度激活,可能调控三羧酸(Tricarboxylic acid,TCA)循环和氨基酸代谢相关的通路。
与CRA相比,在FAP患者的碳水化合物代谢中,木糖醇、L-岩藻糖、果糖、葡萄糖、甘露糖、A-D-葡萄糖、阿拉伯糖和吡喃葡萄糖的表达均下降,而1,5-无水葡萄糖醇的表达明显升高。这些代谢物均与糖酵解、TCA循环等碳水化合物相关,可能是因为FAP患者的高腺瘤负荷导致的能量供给不足[10]。FAP患者的1,5-无水葡萄糖醇是急性葡萄糖波动(葡萄糖峰值)的标志物,其表达升高表明体内存在低血糖,可能成为监测FAP患者癌变的潜在生物标志物[11]。
与CRA相比,我们发现FAP患者的甘氨酸、天冬氨酸、异亮氨酸、谷氨酸、胱氨酸、苏氨酸、天冬酰胺、亮氨酸和瓜氨酸表达均显著降低。其中异亮氨酸、亮氨酸和苏氨酸为必需氨基酸。细胞需要摄入必需氨基酸维持基本生命活动。与正常细胞相比,肿瘤细胞对必需氨基酸的需求明显增加[12]。这与我们的研究一致,FAP患者的平均腺瘤数量远远大于CRA患者,同时与CRA患者相比,FAP患者对异亮氨酸、亮氨酸和苏氨酸等必需氨基酸的高消耗可能用于维持肿瘤细胞的快速增殖。谷氨酰胺不是必需氨基酸,它在人体内可由谷氨酸、异亮氨酸和缬氨酸合成。肿瘤细胞使用谷氨酰胺分解过程中产生的介质来参与三羧酸循环促进细胞能量代谢[13-14]。同时,谷氨酰胺和甘氨酸、半胱氨酸参与合成谷胱甘肽,其具有抗氧化功能。胱氨酸是由两个半胱氨酸通过二硫键形成的。在肠道肿瘤细胞的微环境中,肿瘤细胞通过糖酵解消耗大量的氧,进而产生过多的活性氧(reactive oxygen,ROS)。ROS的积累对生物分子造成严重损害,导致细胞死亡[15]。因此,肿瘤细胞中需要大量的抗氧化剂(例如谷胱甘肽)来平衡ROS的产生[16]。本研究中,我们发现相较于CRA患者,FAP患者的谷氨酸和甘氨酸的表达下调,这可能与FAP患者息肉负荷量大,进而需要足量的谷氨酰胺和谷胱甘肽相关。胱氨酸的表达显著降低可能是谷胱甘肽需求增加导致半胱氨酸的过量消耗。谷氨酸通过转氨基作用生成天冬氨酸,天冬氨酸和瓜氨酸在精氨琥珀酸合成酶的作用下生成精氨琥珀酸,并进一步生成精氨酸,完成尿素循环。有研究[10]表明在FAP患者中,瓜氨酸、天冬氨酸和天冬酰胺的表达浓度显著降低,可能是由于APC基因突变引起了氨基酸谱的变化。
本研究通过UPLC-MS/MS法检测CRA与FAP患者的血清代谢物,筛选出FAP特征性代谢谱,并通过KEGG功能注释和富集分析阐明其重要相关的代谢通路途径,可为APC基因突变诱导的代谢组学改变进而导致结直肠癌发生发展的深入机制研究提供新的思路。此外,定期监测FAP患者的血清代谢物改变,可为疾病的发展提供预警。同时,根据FAP患者的特征性小分子代谢物改变,为FAP从腺瘤发展为结直肠癌的化学预防提供新的依据。本研究受限于单中心、小样本,研究结论有待多中心以及扩大样本量以验证。

