百合无性繁殖器官病毒检测及LlMADS2调控珠芽发生的初步解析
张雪敏, 李佳敏, 康圣楠, 李玉舒, 梁佳惠, 张铭芳, 张秀海, 于晓南, 杜运鹏
(1.北京林业大学园林学院,北京 100083;2.北京市农林科学院草业花卉与景观生态研究所, 北京100097;3.北京农业职业学院,北京 102442)
百合为百合科(Lilaceae)百合属(Lilium)植物,是重要的药食同源植物之一[1],在北温带和亚热带地区分布广泛。中国是百合属的起源和分布中心之一,具有丰富的百合资源[2]。百合经常发生病毒性感染,病毒性感染往往会导致百合种球的数量和品质下降,最终造成严重的经济损失[3-4]。据报道,有10种以上的不同病毒可以造成各地百合的感染[5-7]。其中百合无症状病毒(LSV)、黄瓜花叶病毒(CMV)和百合斑驳病毒病毒(LMoV)被认为是最具危害性的种类[8]。因此百合繁殖器官抗性的提高或者自身毒性的降低,对于百合产业的发展具有重要意义。研究表明,在卷丹中珠芽携带的病毒种类低于其他繁殖器官[8]。在众多百合资源中,卷丹是具有珠芽发生能力的种类之一。卷丹是在中国分布范围最广的百合科百合属植物,其花大色艳,抗性强,兼具观赏、食用、药用价值,为中国食用百合的主要种,种植面积广,产业价值高[9-10]。但卷丹一般为三倍体,难以通过有性繁殖方式扩大种群。因此,珠芽被视为卷丹极具开发潜力的繁殖方式。目前对珠芽的研究集中在解剖学和生理学层面,包括珠芽发生发育的组织学观察,以及珠芽形成过程内源激素的变化,但对其发生发育的分子机理的研究很少[11]。珠芽着生于百合的叶腋处,多被认为是腋生器官,在其他植物当中,对于叶腋分生组织的形成、腋生器官的启动与生长,已经有一定的研究基础[12-15]。其中,MADS-box(MCM1/AGAMOUS/DEFICIENS/SRF)转录调控因子是植物中研究最多的家族之一,这个家族的成员参与多种植物的生长发育过程[16]。最初,MADS-box基因只是被作为花器官中重要的参与者,但近年越来越多的研究揭示,MADS-box基因在几乎所有器官的形态发生上具有重要的功能,其贯穿植物的整个生命周期[17]。研究表明,当龙舌兰(Agavetequilana)受精失败或去除顶端花芽时,会诱导珠芽的形成,且AtMADS1/2/4/6/7参与调控珠芽的形成[18-19];狗尾草(Setariaviridis)的simads34突变体能够显著改变狗尾草的花序结构,且狗尾草的次生分枝数量显著增加[20];沉默POTM1(potatoMADS1)基因会导致马铃薯(Solanumtuberosum)块茎产量降低、侧芽生长增强[21];在拟南芥(Arabidopsisthaliana)中AtAGL21可以通过增强局部生长素的生物合成,来调节侧根原基和侧根中生长素的积累,进而刺激侧根的起始和生长,而agl21突变体则表现侧根发育受损[22]。这些结果初步证明MADS-box转录因子对于珠芽形成具有重要意义。然而,目前缺少MADS-box基因在百合珠芽发生过程的功能研究。本研究通过对卷丹、重瓣卷丹、淡黄花和泸定百合的两种无性繁殖器官珠芽和鳞茎的病毒检测,进一步证实了珠芽的低毒优势,随后通过对卷丹珠芽发生发育转录组数据中与珠芽发生相关的MADS-box差异表达基因进行分析,结合qRT-PCR结果,最终筛选出一个可能参与珠芽发生的注释为MADS2的关键基因,进一步对LlMADS2进行生物信息学分析和表达分析,发现其在珠芽发生过程中的S0和S1时期的表达中具有显著差异,可能参与调控百合珠芽的发生,为探明MADS-box转录因子调控卷丹珠芽发生机制研究提供理论基础。
1 材料与方法
1.1 材料
1.1.1 植物材料 卷丹、重瓣卷丹、淡黄花、泸定百合独头种球种植于北京市农林科学院国家百合种质资源库中。从卷丹种植到珠芽成熟的过程不断进行观察,在卷丹珠芽尚未发生时期(S0)、小白点期(S1)、绿球期(S2)、褐球期(S3)取植株叶腋处(图1),每个阶段取9株卷丹,每株卷丹取同一部位的2个相邻叶腋,每3株卷丹的叶腋作为一个混合样本混样,锡箔纸包裹后用液氮速冻,在-80 ℃冰箱冻存,用于转录组测序。取卷丹、重瓣卷丹、淡黄花百合、泸定百合的褐球期珠芽及同株地下鳞茎于液氮速冻,-80 ℃冰箱冻存,用于病毒检测。取卷丹S0,S1,S2,S3时期珠芽所对应的叶腋处,以及卷丹茎秆上部可发生珠芽部位和下部无法发生珠芽的部位的叶腋,以及卷丹植株各部位器官组织在液氮中速冻,在-80 ℃冻存,用于后期时空表达模式检测。

A,E,F. S0:珠芽尚未发生期;B,F,J. S1:珠芽小白点期;C,G,K. S2:绿球期;D,H,L. S3:褐球期;红圈部分代表珠芽内部分化的鳞片层。
1.1.2 菌株、载体和试剂 EASYspin Plus多糖多酚植物RNA快速提取试剂盒(爱博森生物科技有限公司,北京),大肠杆菌(DH5α)感受态BC102细胞(博迈德生物技术有限公司,北京),pCE2 TA/Blunt-Zero Vector载体5 min TM TA/Blunt-Zero Cloning Kit,2 × Phanta® Flash Master Mix(Dye Plus) ,2 × Rapid Taq Master Mix和反转录试剂HiScript Ⅲ SuperMix for qPCR(+gDNA wiper)(诺唯赞,南京),DNA通用纯化回收试剂盒(天根生化科技有限公司,北京),荧光定量PCR试剂TB Green® Premix ExTaqTM(宝生物工程(大连)有限公司,大连)。
1.1.3 仪器与设备 电子天平,瑞安市英衡电器有限公司;电热恒温水浴锅,上海精宏实验设备有限公司;高压蒸汽灭菌器,SANYO Techno Solutions Tottori Co.,Ltd;微波炉,合肥荣事达三洋电器股份有限公司;振荡培养箱,上海旻泉仪器有限公司;梯度PCR仪,Life technologies;CFX96TMReal-Time System,Singapore。
1.2 方法
1.2.1 引物设计 从转录组数据中查找到目的基因的转录本序列,在ORF Finder (https://www.ncbi.nlm.nih.gov/orffinder/)获得其开放阅读框(open reading frames, ORF)序列,将获得的长度大于200 bp的ORF序列在NCBI protein BLAST(https://blast.ncbi.nlm.nih.gov/-Blast.cgi)依次进行比对,与转录组注释结果相吻合即视为比对成功,保存比对成功的ORF序列用于定量引物设计。将保存的ORF序列提交至GenScript(https://www.genscript.com/tools/real-time-pcr-taqman-primer-design-tool?page_no= 1& position_no=2&sensors=googlesearch),调整参数organism:other,size range:180~220 bp,Tm≥60 ℃进行定量引物设计。根据引物设计的原则选择最好的1~2个设计结果作为定量引物,后续再进行定量引物的筛选。
利用Primer Premier 5 软件进行克隆引物、病毒检测引物及qRT-PCR引物的设计,本试验所用引物均由生工生物工程(上海)股份有限公司合成(表1)。
采用t检验进行差异显著性分析。

表1 病毒检测及定量试验所用引物Table 1 Primers used in virus detection and qRT-PCR
1.2.2 总RNA的提取及逆转录 利用EASYspin Plus多糖多酚植物RNA快速提取试剂盒提取卷丹叶腋总RNA;根据反转录试剂盒HiScript Ⅲ SuperMix for qPCR(+gDNA wiper)说明书,将提取的RNA反转录合成 cDNA,反应结束后,样品于-20 ℃冰箱冻存备用。
1.2.3 百合无性繁殖器官珠芽和鳞茎病毒检测 利用卷丹、重瓣卷丹、淡黄花百合、泸定百合的珠芽及鳞茎的cDNA为模板进行PCR扩增,对黄瓜花叶病毒(CMV)、百合无症病毒(LSV)、百合斑驳病毒(LMoV)进行检测。扩增体系包含2 × Rapid Taq Master Mix 5 μL,上下游引物各1 μL,所用引物见表1,cDNA 2 μL,ddH2O 2 μL,总体系10 μL。反应程序为95 ℃ 3 min,95 ℃ 15 s,55 ℃ 30 s,72 ℃ 15 s,72 ℃ 5 min,共35个循环。扩增后的PCR产物用1.5%琼脂糖凝胶电泳检测。
1.2.4MADS-box基因分析与关键基因筛选 用DESeq2对卷丹珠芽形成过程的转录组数据进行组间差异表达分析,筛选标准为FDR(False Discovery Rate)<0.05且FC(Fold Change)≥2。将S1、S2、S3作为珠芽已发生时期,S0作为未发生时期,设置3个比较组,分析差异表达基因,选择差异表达基因中所有的转录因子,绘制维恩图与热图。利用tbtools(https://github.com/CJ-Chen/TBtools)进行venn图与热图的绘制。
1.2.5LlMADS2基因克隆 利用卷丹叶腋的cDNA为模板进行PCR扩增,扩增体系包含2 × Phanta Master Mix 25 μL,上下游引物各1 μL,cDNA 2 μL,ddH2O 19 μL,总体系50 μL。反应程序为 98 ℃ 30 s,98 ℃ 10 s,56 ℃ 5 s,72 ℃ 15 s,72 ℃ 5 min,共35个循环。扩增后的PCR产物用1.5%琼脂糖凝胶电泳检测,并用DNA回收试剂盒(TIANGEN, 北京)回收目的片段;将目的片段连接至pCE2 TA/Blunt-Zero Vector载体,转化到DH5α(博迈德,北京) 感受态中,PCR筛选阳性菌株,送往北京诺赛基因组研究中心有限公司(北京)测序。
1.2.6 序列分析、蛋白结构预测及系统进化树构建 通过ProtParam对蛋白理化性质进行分析;利用ProtScale对蛋白亲疏水性进行分析;采用TMHMM Serverv2.0分析编码氨基酸的跨膜结构域;利用NetPhos 2.0 Server 进行磷酸化位点预测;利用NCBI ORF finder在线程序及Conserved domains数据库对测序获得的cDNA序列进行开放阅读框及保守功能结构域分析;通过SOPMA及SWISS.MODEL预测蛋白的二级和三级结构;利用Cell-PLoc 2.0分析亚细胞定位情况[23-24];采用geneious进行多重序列比对。利用生物软件MEGA7.0进行Neighborjoining系统进化树构建,采用遗传距离建树法的相邻连接法,并进行1 000次的Bootstrap校正。
1.2.7LlMADS2的表达分析 以上述用于qRT-PCR的植物材料的cDNA为模板进行qRT-PCR分析,每个样品设3次技术重复。实时荧光定量PCR反应体系:5 μL TB green、1 μL cDNA模板、0.4 μL上下游引物、3.2 μL ddH2O。扩增程序:95 ℃ 30 s,95 ℃ 5 s,55 ℃ 15 s,72 ℃ 30 s,95 ℃ 5 s,循环39次。以卷丹18 S为内参基因,引物序列见表1,采用2-ΔΔCt法计算LlMADS2的相对表达量。利用Excel、SPSS19、GraphPad Prism8等软件进行统计学分析。
2 结果与分析
2.1 4种百合鳞茎及珠芽的病毒检测
本试验以卷丹、重瓣卷丹、淡黄花百合、泸定百合的珠芽和鳞茎的cDNA为模板对百合斑驳病毒(LMoV)、黄瓜花叶病毒(CMV)、百合无症病毒(LSV)进行检测,结果表明,在淡黄花百合中,同一植株地下鳞茎和珠芽中均存在百合斑驳病毒,但在珠芽中表达较弱;卷丹鳞茎中存在黄瓜花叶病毒,但珠芽中并未检测到3种病毒的存在;重瓣卷丹鳞茎和珠芽中均含有百合斑驳病毒,但珠芽中斑驳病毒的含量明显低于鳞茎中;泸定百合鳞茎中存在百合无症病毒和黄瓜花叶病毒,而珠芽中仅含有黄瓜花叶病毒(图2),由此说明珠芽是未携带病毒或带毒率较少的无性繁殖器官。这种表现在卷丹和重瓣卷丹珠芽尤为明显。因此以卷丹为材料探究珠芽的发生机制对于百合种球的脱毒及百合新型繁殖方式的开发具有重要的参考价值。
2.2 卷丹珠芽发生关键基因筛选
结合珠芽形成过程和转录组测序结果,本研究将159,59,47这3处交集作为参与珠芽发生的重点基因集,从中选择出了所有的MADS-box基因,并将筛选出的所有MADS-box基因绘制热图。依据热图可以发现,将S1,S2,S3时期的表达量与S0相比较,Cluster-16492.37633,Cluster-16492.39107,Cluster-16492.42069,Cluster-16492.60924这4个转录本在珠芽发生后的表达量均明显高于珠芽未发生时期,本试验检测了Cluster-16492.37633,Cluster-16492.42069,Cluster-16492.60924这3个转录本在珠芽发生(S0)与初期未发生(S1)阶段的表达情况,发现MADS2定量结果与转录组趋势一致且存在显著差异(图3),于是,最终选择LlMADS2作为后续研究对象。

图3 卷丹珠芽发生相关MADS-box关键基因筛选Fig.3 Screening of MADS-box key genes related to bulbil formation in Lilium lancifolium
2.3 卷丹LlMADS2基因CDS全长克隆及其编码氨基酸序列分析
通过前期的转录组分析,结合定量验证,本研究从差异表达基因中筛选出了一个可能参与调控珠芽发生的基因LlMADS2。将其转录本序列提交至ORF Finder找到1条全长741 bp的CDS序列,使用引物LlMADS2-F和LlMADS2-R对卷丹LlMADS2基因进行PCR扩增,获得1条长度约为700 bp的条带(图4),纯化回收后连接TA/Blunt-Zero Vector载体转化大肠杆菌后,通过菌液PCR挑选条带正确的阳性克隆单克隆菌液送测序。测序结果表明LlMADS2基因开放阅读框(ORF)长741 bp,共编码246个氨基酸。如图中红色框ATG为起始密码子,蓝色框TAA为终止密码子(图4)。
2.4 LlMADS2基因系统进化树构建
系统进化树结果显示,17种MADS-box蛋白聚为5个小分支,且具有较高的支持率,LlMADS2与台湾百合(Liliumformosanum)中的MADS7,卷丹中的AGAMOUS-like序列处于同一个进化分支上,表明他们的亲缘关系最近(图5)。
2.5 卷丹LlMADS2蛋白的理化性质分析
LlMADS2基因全长741 bp,编码一个由246个氨基酸残基组成的蛋白序列。对卷丹LlMADS2基因编码的蛋白质的理化性质进行预测分析,结果显示,该蛋白分子式为C1 220H1 961N359O381S13,相对分子质量为28 170.95 D,理论等电点为7.05,脂肪系数为78.90。LlMADS2蛋白的氨基酸中共含有34个带负电荷氨基酸残基(Asp + Glu),34个带正电荷氨基酸残基(Arg + Lys)。不稳定系数为61.14,蛋白亲水性平均值为-0.698,因此LlMADS2为不稳定疏水性蛋白(图6-A、6-B)。LlMADS2蛋白从内到外无跨膜区域,有接近1的概率表明该蛋白位于膜外,推测是一种非跨膜蛋白(图6-C)。LlMADS2蛋白含有可能发生磷酸化的位点有48个,均为Tyr(酪氨酸)(图6-D)。

图5 LlMADS2与其他物种同源蛋白的系统进化树Fig.5 LlMADS2 Phylogenetic tree and motif analysis of proteins homologous to other species
2.6 卷丹LlMADS2蛋白质二、三级结构的预测分析
采用NCBICD search在线网站分析LlMADS2基因编码蛋白质的结构域,该蛋白有2个specific-hits,为REC_MEF2_like和K-box位点,分别属于MADS superfamily、K-box superfamily(图7-A)。
利用SOPMA在线软件对蛋白质的二级结构进行预测和分析。结果表明,LlMADS2蛋白的二级结构的含量中:α螺旋(蓝色c)(52.03%)>无规则卷曲(黄色c)(35.37%)>延伸链(红色e)(9.35%)>β转角(绿色t)(3.25%),因此可推断,无规则卷曲和α螺旋是LlMADS2蛋白的主要组成成分(图7-B)。蛋白质的多肽链在二级结构的基础上进行盘曲或折叠形成具有规律的三维空间结构。利用在线软件 SWISS-MODEL对蛋白质三级结构进行预测分析,获得了LlMADS2蛋白的三维结构模型(图7-C)。
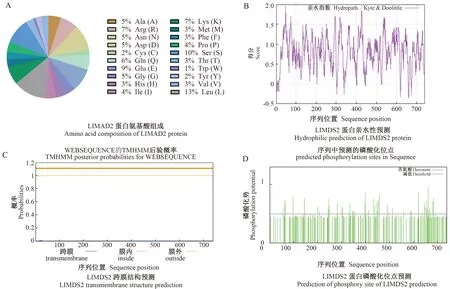
图6 LlMADS2蛋白理化性质分析Fig.6 Physicochemical properties of LlMADS2 protein

图7 LlMADS2蛋白二三级结构预测Fig.7 Secondary and tertiary structure prediction of LlMADS2 protein
2.7 卷丹LlMADS2在不同时期与不同部位中的表达分析
通过qRT-PCR,对LlMADS2基因在卷丹叶腋珠芽未发生(S0)和珠芽发生初期(S1)及后期的发育时期(S2、S3)的表达量进行检测。发现LlMADS2在卷丹珠芽未发生的S0时期与珠芽已发生的S1,S2,S3时期表达量具有显著差异,与转录组中的表达趋势整体一致(图8-A、8-B)。在自然条件下,卷丹茎秆下部是不具备珠芽发生能力的,而上部则是可以发生珠芽的部位,于是笔者对LlMADS2在卷丹珠芽茎秆下部和上部的表达量进行了检测,发现LlMADS2在卷丹茎秆上部的表达量要显著高于下部(图9-C)。这些结果表明,LlMADS2可能参与珠芽发生的调控,并在珠芽发生起始过程中发挥诱导作用。此外,还对LlMADS2在卷丹中的表达模式进行了检测,发现其在卷丹的各个部位均有表达,但在花柱中表达水平最高。

图8 LlMADS2在卷丹中的表达模式Fig.8 Expression pattern of LlMADS2 in Lilium lancifolium
3 结论与讨论
百合病毒病是仅次于真菌病害的第二大类病害,百合在栽培过程中易受到病毒的危害,易造成鳞茎腐烂、病株枯死等的发生,严重影响百合的产量和品质。研究发现,黄瓜花叶病毒、百合无症病毒以及百合斑驳病毒是卷丹的主要病毒病害[25]。目前,种球播种仍是百合主要的繁殖方式,但鳞茎易受病毒侵害,且国产种球普遍存在的产量低,品质差等问题尚未解决。而珠芽是部分百合所具有的一种特殊繁殖器官,一株百合可以产生几十至上百个珠芽,大大提高了其繁殖效率,且珠芽着生于百合叶腋处,属于地上器官,具有低毒优势[9,26]。但目前关于百合珠芽病毒检测的研究很少,仅有张慧等[8]对卷丹珠芽、鳞茎和叶片中的黄瓜花叶病毒,百合无症病毒及斑驳病毒进行了检测和比较,证实卷丹珠芽相对于鳞茎来说确实具有病毒种类少含量低的优势。本研究增加了对泸定百合、淡黄花百合及重瓣卷丹的病毒检测,进一步证实了百合珠芽带毒率低,是极具开发潜力的百合无性繁殖器官。珠芽发生机制的解析对于百合脱毒种球的生产及新型繁殖方式的开发具有重要意义。
MADS-box转录调控因子是植物中研究最多的家族之一,这个家族的成员在植物的生长发育中起着显著的作用[27]。前人研究证明,MADS-box基因在侧生器官的形成过程中发挥关键作用[20-21,28-29],其中发现在龙舌兰珠芽发生过程中,AtMADS1/2/4/6/7可能发挥负调控作用[18]。本研究通过对卷丹珠芽形成过程中转录组的分析,以定量结果为辅助,筛选出LlMADS2作为后续研究对象,对其进行生物信息学分析,LlMADS2属于不稳定疏水性蛋白,结构也较为简单,初步阐述了LlMADS2蛋白的理化性质及其二三级结构。氨基酸多序列同源比对发现LlMADS2与LlMADS7和LlAGAMOUS-like的同源性较高,功能上可能具有部分相似性。对于LlMADS2在卷丹珠芽形成不同时期和不同位置的表达分析发现,LlMADS2在珠芽已发生时期的表达量要显著高于未发生时期,且在具有珠芽发生能力的茎秆上部的表达要显著高于不具备珠芽发生能力的茎秆下部。这说明LlMADS2可能正向调控卷丹珠芽的发生,这可能是由于物种间遗传背景的差异所导致的。时空表达模式说明LlMADS2在卷丹各部位具有表达,但在花柱中最高,其属于MADS-box基因家族这也具有合理性,且有研究表明珠芽的发生与花芽的分化具有一定联系[18],推测LlMADS2通过影响花芽分化进而对珠芽的发生造成影响。
目前,与MADS-box家族基因调控珠芽形成的相关研究较为匮乏,LlMADS2调控珠芽发生的具体机制仍需进一步的探究。本研究通过对4种可发生珠芽的百合鳞茎和珠芽的病毒检测,证实了珠芽的低毒优势,说明对于珠芽发生机制解析的重要性。且对MADS-box转录因子LlMADS2在卷丹珠芽形成过程中的表达模式进行了分析,对其功能进行了初步的推测,为进一步探究LlMADS2调控珠芽形成机制提供了参考。

