内生细菌对NaCl胁迫下小麦幼苗的缓解作用
杜欣 杨林美# 姜梦柯 曾忠秀 李梦霜 李中源 李淑英



摘 要:选择小麦种子作为研究材料,水培条件下进行种子萌发,待小麦幼苗长至15cm时,对小麦幼苗进行NaCl胁迫培养,同时接种紫茎泽兰(Crofton Weed)根分离到的1株内生细菌,通过测定小麦叶片Pro(脯氨酸)和MDA(丙二醛)含量、PPO(多酚氧化酶)和CAT(过氧化氢酶)活性变化,探究内生细菌对NaCl胁迫培养后小麦的缓解作用。结果表明:NaCl胁迫培养条件下接种紫茎泽兰内生细菌后,小麦叶片CAT活性及Pro含量增加;小麦叶片PPO活性及MDA含量变化没有明显规律性,低盐(NaCl 150mmol/L)胁迫培养时接种紫茎泽兰内生细菌短时间内(本试验为7d)对小麦生长有缓解作用,说明紫茎泽兰内生细菌对NaCl(150mmol/L)胁迫培养的小麦幼苗生长有一定的修复作用,紫茎泽兰内生细菌在高盐(NaCl 300mmol/L)条件下生长繁殖受抑制。
关键词:内生细菌;NaCl胁迫;小麦叶片;生理生化
中图分类号 S512.1 文献标识码 A 文章编号 1007-7731(2022)01-0015-04
Alleviating Effect of Endophytic Bacteria on Wheat Seedlings under NaCl Stress
DU Xin# YANG Linmei# JIANG Mengke ZENH Zhongxiu LI Mengshuang LI Zhongyuan LI Shuying
(College of Chemical Biology and Environment, Yuxi Normal University, Yuxi 653100, China)
Abstract: This experiment took wheat seeds as research materials, made seed germination under hydroponic conditions, cultured the wheat seedlings under NaCl stress when they grew to 15cm height, inoculated with an endophytic bacterium isolated from the root of Crofton Weed, and explored the alleviating effect of endophytic bacteria on wheat leaves after NaCl stress culture through determining the contents of Pro (proline) and MDA (malondialdehyde) and the changes of activity of PPO (polyphenol oxidase) and CAT (catalase). The results showed that the CAT activity and Pro content of wheat leaves increased after inoculation with endophytic bacteria of Crofton Weed under NaCl stress; no obvious regularity in the changes of PPO activity and MDA content was found in wheat leaves; inoculation of Eupatorium adenophorum endophytic bacteria could alleviate the growth of wheat in a short time (this experiment is 7d) under low salt (NaCl 150mmol/L), indicating that Crofton Weed endophytic bacteria can repair the growth of wheat seedlings cultured under NaCl (150mmol/L) condition, and the growth and reproduction of Endophytic Bacteria of Eupatorium adenophorum were inhibited under the condition of high salt (NaCl 300mmol/L).
Key words: Endophytic bacteria; NaCl stress; Wheat leaf; Physiology and biochemistry
鹽渍化严重影响作物生长,盐渍化环境中生长的农作物会在生长特征和生理生化特征方面都呈现出一定的变化。田菁等[1]发现盐胁迫处理影响小麦幼苗的形态和生理特性,对其生长有负面影响。当土壤的盐浓度高于70mmol/L,农作物已经表现出胁迫作用,高于100mmol/L则作物生长发育受到严重影响,产量急剧下降[2],同时植物中的游离脯氨酸、丙二醛、可溶性蛋白质会有明显的增加[3,4],盐胁迫使得小麦生长受阻,光合系统和酶系统受到干扰,进而影响小麦产量和质量[5]。
盐渍化土壤修复技术较多,而微生物技术[6-8]由于其成本低、污染小、可持续等优点,在开发利用方面得到重视。植物内生细菌分布于植物的不同组织中,受到植物组织的保护而不受外界恶劣环境(如强烈日光、紫外线、风雨等)的影响,而且有充足的营养物质,因此具有稳定的生态环境,占据有利于生防的生态位,相对于腐生细菌更易于发挥生防作用[9]。在恶劣环境中,植物内生细菌可促进植物生长,改善植物营养吸收,影响酶及代谢产物活性,增强植物抗逆性。植物内生细菌作为生物防治菌株,发展迅速,成为当前微生物学领域研究的热点[10]。本试验选择小麦种子在水培条件下萌发及培养一段时间后,接种从紫茎泽兰根部分离到的内生细菌,通过检测小麦叶片Pro(脯氨酸)、MDA(丙二醛)、PPO(多酚氧化酶)、CAT(过氧化氢酶)含量或活性变化,探讨接种内生细菌对不同盐浓度胁迫下小麦幼苗生长的影响。
1 材料与方法
1.1 试验材料 小麦种子:市场购买。内生细菌:紫茎泽兰(Crofton Weed)根部分离得到。牛肉膏蛋白胨培养基:牛肉膏3g,蛋白胨10g,NaCl 5g,蒸馏水1000mL,pH自然,121℃灭菌30min后35℃恒温无菌检查24h后备用。LB培养基:胰蛋白胨10g,酵母提取物5g,NaCl 10g,蒸馏水1000mL,pH自然,121℃灭菌30min后35℃恒温无菌检查24h后备用。
1.2 试验方法
1.2.1 内生细菌的分离纯化 新鲜健康紫茎泽兰根冲洗干净,吸干水分剪切成2cm的小段,75%乙醇漂洗3min,无菌水冲洗4~5次,5%次氯酸钠溶液漂洗3min,无菌水冲洗4~5次,無菌滤纸吸干水分,研磨成汁过滤,取0.5mL置于4.5mL无菌水稀释为10-1,10倍梯度稀释至10-2、10-3,无菌操作分别取0.5mL涂布接种于牛肉膏蛋白胨平板,每个稀释梯度接种2个平板,35℃培养24~48h后选取长势良好单菌落纯化2~3次后保存。
1.2.2 内生细菌的活化和菌悬液制备 将所获菌株接种至牛肉膏蛋白胨培养基斜面,置于30℃恒温培养24~48h后转接于LB液体培养基,置于30℃(130r/min)震荡培养5d,10000r/min离心10min,收集菌体,用无菌水稀释成菌悬液,调整OD600值≈1,4℃保存备用。
1.2.3 小麦种子盐胁迫培养及内生细菌接种 挑选新鲜健康的小麦种子,用无水乙醇浸泡15~20s,置于5%次氯酸钠溶液消毒3~5min,再用无菌水冲洗5~8次。无菌水浸泡小麦种子12h,白瓷盘铺垫纱布,水量放至合适位置,均匀放置小麦种子。待小麦发芽,幼苗长至15cm高时进行NaCl胁迫培养,设置1个对照组+4个试验组:CK、低盐胁迫(NaCl浓度为150mmol/L)、低盐胁迫(NaCl浓度为150mmol/L)+接种内生细菌、高盐胁迫(NaCl浓度为300mmol/L)、高盐胁迫(NaCl浓度为300mmol/L)+接种内生细菌(NaCl浓度为300mmol/L)。具体过程:CK中加300mL无菌水,低盐及高盐试验组各加300mL盐溶液、低盐及高盐+内生细菌试验组各加菌悬液盐溶液300mL,隔1d加1次,共计10次;第7d时开始取样测定小麦叶片中的脯氨酸和丙二醛含量,过氧化氢酶和多酚氧化酶活性,每隔7d测定1次,共测3次。
1.3 测定项目 采用磺基水杨酸法[11]提取及测定小麦叶片脯氨酸(Pro)含量,波长520nm,标准曲线为:y=0.0226x-0.0019,R2=0.9915。采用双组分分光光度法测定丙二醛(MDA)含量,具体过程及计算参照[11]进行,略作调整。多酚氧化酶(PPO)活性测定参照文献[11]的方法,测定波长为410nm,具体过程参照[11]进行。采用紫外吸收法[12]测定过氧化氢酶(catalase,CAT)活性,波长240nm。
2 结果与分析
2.1 小麦叶片CAT活性变化 研究[13]发现,CAT与盐胁迫耐受相关,随着胁迫时间的延长,处理组的过氧化氢酶活性呈现先升高后降低的趋势[14]。由图1可知,对照组及2个试验组21d水培过程中CAT的变化也表现为先升高后降低的趋势,水培小麦7、14、21d在NaCl浓度为150mmol/L、300mmol/L时接种紫茎泽兰内生细菌后CAT的活性均高于NaCl试验组及对照组,说明在水培条件下紫茎泽兰内生细菌可以在一定程度上缓解NaCl胁迫培养对小麦造成的影响,对小麦生长有一定的修复作用[15],能提高小麦对NaCl胁迫抗逆性,其中7d时低盐(NaCl 150mmol/L)胁迫后紫茎泽兰内生细菌对小麦的修复效果达到79.11%,比CK高44.02%,高盐(NaCl 300mmol/L)时也有一定修复效果,达到19.11%;14d时CK及试验组CAT都有降低,但紫茎泽兰内生细菌对低盐(NaCl 150mmol/L)及高盐(NaCl 300mmol/L)胁迫培养小麦后依然有修复作用,低盐(NaCl 150mmol/L)胁迫条件下修复作用较明显,高达109.49%;水培条件21d时,紫茎泽兰内生细菌对NaCl 胁迫培养小麦后的修复效果明显,低盐(NaCl 150mmol/L)时修复效果达到108.17%,高于CK 118.37%,高盐(NaCl 300mmol/L)时达到59.94%,高于CK 106.94%,说明水培时间越长,紫茎泽兰内生细菌对NaCl胁迫修复效果越明显,具体有效修复时间及机理有待深入研究。
2.2 小麦叶片PPO活性变化 PPO对植物抵御外界胁迫、光合作用、生物合成等起重要作用[16],是参与酚类聚合的酶,酚类物质可促进细胞壁和组织木质化,影响细胞壁中木质素的合成,木质素是植物抵御外界胁迫的天然屏障之一[17],酚类物质的积累被认为与植物抵御非生物胁迫有关,在冷胁迫、水分胁迫条件下均观察到该现象[18,19]。由图2可知,CK及试验组的PPO均呈现出先升高后降低趋势。彭淼[20]研究发现,外源钙对干旱胁迫下草莓PPO活性变化也表现为先升高再降低。低盐(NaCl 150mmol/L)胁迫培养小麦后接种紫茎泽兰内生细菌试验组,胁迫培养7d时PPO活性低于CK及低盐(NaCl 150mmol/L)试验组,说明紫茎泽兰内生细菌的外源性添加在短时间内可以提高小麦对NaCl的抗性,表现出一定修复作用,修复效果为44.50%,随着胁迫时间延长,NaCl(150mmol/L)接种紫茎泽兰内生细菌后PPO活性高于NaCl(150mmol/L)胁迫试验组,紫茎泽兰内生细菌的修复作用逐渐消失;高盐(NaCl 300mmol/L)接种紫茎泽兰内生细菌试验组7、14、21d时,小麦叶片中的PPO都高于高盐(NaCl 300mmol/L)试验组,说明紫茎泽兰内生细菌在高盐(300mmol/L)状态下没有对小麦生长产生修复作用。研究[21] 发现NaCl浓度过高会影响内生细菌的生长繁殖。
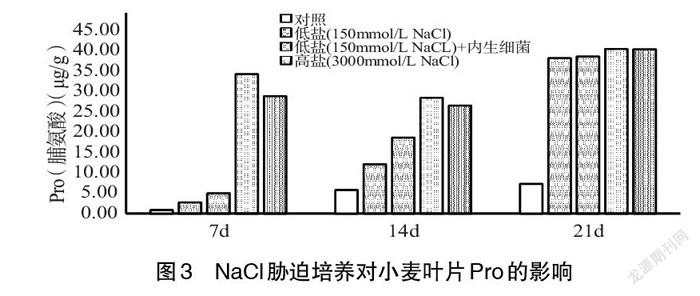
2.3 小麦叶片Pro含量变化 植株体内脯氨酸(Pro)含量在一定程度上反映了植株体的抗逆能力[22]。滕松山[23]在盐生植物碱蓬中分离获得1株内生细菌(Pseudomonas oryzihabitans LP11),在盐分胁迫条件下可提高种子萌发率,增加植物叶绿素、可溶性糖及脯氨酸含量,促进植物生长,提高抗盐性。由图3可知,小麦幼苗在低盐(NaCl 150mmol/L)和高盐(NaCl 300mmol/L)胁迫培养条件下,小麦叶片中的Pro含量明显增加,Pro变化与时间及NaCl浓度等有一定关系。谢强等[24]认为,在胁迫条件下,大多抗逆性强的品种能够积累较多的脯氨酸。本试验中,低盐(NaCl 150mmol/L)及低盐(NaCl 150mmol/L)接種紫茎泽兰内生细菌胁迫小麦时,小麦叶片中Pro含量随培养时间延长逐渐增加,7d时高于CK 215.29%、465.63%,14d时高于CK 109.95%、223.34%,21d时高于CK 421.03%、426.54%,低盐(NaCl 150mmol/L)胁迫且接种紫茎泽兰内生细菌试验组Pro含量均高于低盐(NaCl 150mmol/L)胁迫试验组,说明紫茎泽兰内生细菌对低盐(NaCl 150mmol/L)胁迫小麦有一定修复作用[25],修复效果分别为79.40%(7d)、54.01%(14d)、1.06%(21d),修复效果在逐渐减弱;高盐(NaCl 300mmol/L)及高盐(NaCl 300mmol/L)接种紫茎泽兰内生细菌后试验组Pro有明显增加,Pro含量均高于低盐(NaCl 150mmol/L)胁迫试验组,但高盐(NaCl 300mmol/L)胁迫接种紫茎泽兰内生细菌后小麦叶片Pro含量低于高盐(NaCl 300mmol/L)胁迫试验组及低盐(NaCl 150mmol/L)接种紫茎泽兰内生细菌试验组,修复效果逐渐减弱,这可能是NaCl会影响内生细菌的生长繁殖[21]进而影响到对小麦生长损伤的修复效果 。
2.4 小麦叶片MDA含量变化 研究[26]发现采用NaCl处理后莲藕幼苗后叶片中的丙二醛含量升高,盐胁迫对植物造成质膜氧化,产生大量的丙二醛(MDA),并调节抗氧化酶活性来抵御逆境环境[27],MDA含量变化与NaCl浓度有正相关关系[28]。由图4可知,4个试验组MDA的含量几乎都高于CK,NaCl胁迫培养导致小麦叶片MDA含量增加,其中低盐(NaCl 150mmol/L)接种紫茎泽兰内生细菌试验组胁迫培养小麦7d后,比低盐(NaCl 150mmol/L)胁迫试验组中MDA含量低,而胁迫培养14d和21d后都高于低盐(NaCl 150mmol/L)胁迫试验组中MDA,说明紫茎泽兰内生细菌在短时间内对小麦生长有一定修复作用,修复效果为8.37%;高盐(NaCl 300mmol/L)接种紫茎泽兰内生细菌后小麦叶片MDA含量变化不明显(分别为34.32、35.93、35.77μmol/g),而高盐(NaCl 300mmol/L)胁迫培养小麦后,小麦叶片的MDA呈上升趋势,说明高浓度NaCl(300mmol/L)对小麦叶片细胞膜有损伤,紫茎泽兰内生细菌可以在一定程度上减轻这种损伤作用。
3 结论与讨论
本研究结果表明,NaCl胁迫培养小苗使小麦叶片CAT活性先升后降,NaCl胁迫培养条件下接种内生细菌可以使CAT的活性增加,说明紫茎泽兰内生细菌对NaCl胁迫培养的小麦生长有一定的修复作用。小麦叶片 Pro的含量受胁迫培养时间及NaCl浓度的影响,NaCl胁迫导致小麦叶片Pro含量增加,低盐(NaCl 150mmol/L)胁迫培养时外源加入紫茎泽兰内生细菌对小麦的生长有修复作用,而胁迫培养时间延长及高盐(NaCl 300mmol/L)胁迫培养条件下,紫茎泽兰内生细菌对小麦的生长也没有明显的修复作用。小麦叶片PPO活性及MDA含量的变化表明,小麦在低盐(NaCl 150mmol/L)胁迫培养时加入紫茎泽兰内生细菌短时内(本试验为7d)对小麦的生长有修复作用,而胁迫培养时间延长及高盐(NaCl 300mmol/L)胁迫培养条件下,紫茎泽兰内生细菌对小麦的生长没有明显修复作用。
参考文献
[1]田菁,宋爽.盐胁迫对小麦幼苗形态及生理特性的影响[J].安徽农业科学,2010,38(15):7784-7787.
[2]卞阿娜,林鸣,王文卿,等.根系盐胁迫盐生植物和甜土植物的幼苗生长及矿质元分布的影响[J].热带亚热带植物学报,2015,23(4):405-412.
[3]郭红玲.盐胁迫下小麦幼苗生长的影响及机理研究[J].农业开发与装备,2018(8):120,124.
[4]胡爱双,张小栋,王文成,等.盐胁迫对不同耐盐性八棱海棠株系生理特性的影响[J].果树学报,2021,38(3):335-343.
[5]陈刘平,陈巧艳,李新华,等.NaCl胁迫对小麦苗期和灌浆期生理生化特性及产量性状的影响[J].江苏农业科学,2019,47(13):85-90.
[6]杨璐,周蓓蓓,侯亚玲,等.枯草芽孢杆菌菌剂对盐胁迫下冬小麦生长与土壤水氮分布的影响[J].排灌机械工程学报,2021,39(5):517-523.
[7]王鲁,魏宏达,方可,等.解淀粉芽孢杆菌HM618对盐胁迫下小麦幼苗生长及生理特性的影响[J].天津农业科学,2020,26(12):33-37.
[8]边建文,崔岩,杨宋琪,等.衣藻和固氮鱼腥藻对盐胁迫下小麦幼苗生长的影响[J].浙江农业学报,2020,32 (10):1748 -1756.
[9]冉国华,张志元.植物内生细菌研究及其应用[J].海南大学学报(自然科学版),2004,22(4):366-370.
[10]强梦轲,徐奕卓,高蕊. 植物内生细菌介导的植物抗逆性研究进展[J].植物学研究,2020,9(3):226-239.
[11]刘新,刘洪庆.植物生理学试验[M].北京:高等教育出版社,2018:3.
[12]汤绍虎,罗充.植物生理学试验教程[M].重庆:西南师范大学出版社,2012:6.
[13]GONDIM F A,GOMES- FILHO E,COSTA J H,et al. Catalase plays a key role in salt stress acclimation induced by hydrogen peroxide pretreatment in maize[J]. Plant Physiology & Biochemistry,2012,56:62-71.
[14]李博书,秦昕宇,董文涛,等.干旱胁迫对大豆幼苗过氧化物酶和过氧化氢酶活性的影响[J].粮油农资,2020(10):8-9.
[15]赵龙飞,徐亚军,赖心河,等.内生细菌252和254对盐胁迫下小麦幼苗过氧化物酶和过氧化氢酶活性的影响[J].应用生态学报,2017,28(9):2984-2992.
[16]王馨雨,杨绿竹,王婷,等.植物多酚氧化酶的生理功能、分离纯化及酶促褐变控制的研究进展[J].食品科学,2020,41(09):222-236.
[17]REN G H,WANG B J,ZHU X D,et al. Cloning,expression,and characterization of miR058 and its target PPO during the development of grapevine berry stone[J].Gene,2014,548(2):166-173.
[18]AHMADIPOUR S,ARJI I,EBADI A,et al. Physiological and biochemical responses of some olive cultivars (Olea europaea L.) to water stress[J]. Cellular and Molecular Biology,2018,64(15):20-29.
[19]ORTEGA-GARCÍA F,PERAGÓN J. The response of phenylalanine ammonia-lyase,polyphenol oxidase and phenols to cold stress in the olive tree (Olea europaea L. cv. Picual)[J]. Journal of the Science of Food and Agriculture,2009,89(9):1565-1573.
[20]彭淼,钟晓红,张玲,等.钙对干旱胁迫下草莓SOD、CAT、PPO活性的影响[J].长江大学学报(自然科学版),2009,6(1):11-14.
[21]傅蕾,李霞,高璐,等.盐胁迫下泛菌属内生细菌对杂交狼尾草发芽及生理的影响[J].草业科学,2017,34(10):2099-2108.
[22]朱虹,祖元刚,王文杰,等.逆境胁迫条件下脯氨酸对植物生长的影响[J].东北林业大学学报,2009,37(4):86-89.
[23]滕松山.具ACC脱氨酶活性的碱蓬内生细菌对植物的解盐促生作用及其ACC脱氨酶基因的克隆[D].济南:山东师范大学,2011.
[24]谢强,陈莉.在抗性条件下脯氨酸积累对苔藓植物的作用[J].现代园艺,2020(15):51-51,130.
[25]徐亚军,赵龙飞,邢鸿福,等.内生细菌对盐胁迫下小麦幼苗脯氨酸和丙二醛的影响[J].生态学报,2020,40(11):3726-3737.
[26]李淑艳,印荔,蒋润枝,等.外源Ca2+对莲藕幼苗盐胁迫的缓解效应[J].试验研究,2017(6):11-19.
[27]贺韵雅,于海峰,杨蕾.盐胁迫下发状念珠藻膜脂的过氧化及抗氧化响应[J].青岛科技大学学报(自然科学版),2011,32(6):626-629.
[28]刘慧,刘治婷,於丽华,等.不同NaCl浓度下甜菜葉片MDA含量及抗氧化酶活性的动态变化[J].中国甜菜糖业,2017(1):1-4.
(责编:徐世红)

