禽致病性大肠杆菌P型菌毛papA基因克隆与基因分型分析
陈俊红, 蔡 煜, 戴 薇, 雷卫强, 戴鼎震
(金陵科技学院动物科学与食品工程学院,江苏南京210046)
禽大肠杆菌病是由禽致病性大肠杆菌(APEC)引起的细菌性传染病,对养禽业危害很大,常可引起气囊炎、肝周炎、心包炎,甚至败血症[1-2]。由于大肠杆菌具有菌毛和毒素等多种致病因子,尤其是菌毛可对宿主上皮细胞进行黏附,有助于大肠杆菌在宿主组织器官的定居和繁殖,从而引发上述病理变化[3-4]。禽大肠杆菌具有1型和P型两类菌毛,二者均由染色体基因编码,绝大多数禽致病性大肠杆菌表达1型菌毛[5]。1型菌毛能凝集多种动物的红细胞,且可被D-甘露糖所抑制,因此,1型菌毛又称甘露糖敏感血凝特性菌毛(MSHA)。P型菌毛也能凝集红细胞,但不能被D-甘露糖所抑制,因此又称之为甘露糖抵抗血凝特性菌毛(MRHA)。1型菌毛主要黏附禽上呼吸道,有助于细菌对宿主呼吸道的初步感染,而P型菌毛主要黏附禽下呼吸道,有助于细菌对宿主呼吸道的深部感染[6-7]。P型菌毛是由papI、papB、papA、papH、papC、papD、papJ、papK、papE、papF及papG等基因构成的基因簇编码的,PapA和PapG是大肠杆菌P型菌毛的结构蛋白,其中PapA是组成P型菌毛的主要结构蛋白,由1 000多个亚单位通过组合形成螺旋杆状的菌毛杆;PapG是P型菌毛顶端的黏附蛋白[8-9]。研究结果表明,P型菌毛也存在于感染人尿道上皮的大肠杆菌上,且其papA基因与禽大肠杆菌P型菌毛papA基因存在明显的同源性,反映了它们起源于同一祖先[10]。但同时,P型菌毛papA基因也处于持续的变异之中,先后出现了14个不同的基因分型,这些基因分型可分别用分型PCR引物进行扩增鉴别,而所有位于5′端的引物是共同的,只是3′端的引物不同[11-13]。然而,即使是同样的基因分型,其相互之间仍然存在微小的变异[9]。禽大肠杆菌P型菌毛papA基因分型报道较少,目前报道的papA基因多属于基因11型。但不同分离菌株之间是否存在变异仍有待于通过PCR扩增和测序予以分析,这对分析P菌毛抗原并研制P型菌毛亚单位疫苗非常重要。本研究拟以2株禽致病性大肠杆菌为研究对象,针对其P型菌毛上的papA基因设计、合成相关引物,进行PCR扩增,对扩增产物片段进行酶切、连接、转化,构建papA基因重组克隆载体。然后对papA基因碱基序列进行测定,并与相关序列进行比较分析,从而推断 P 型菌毛papA基因是否存在变异以及变异规律,为 P 型菌毛的检测,相关疫苗的制备提供依据。
1 材料与方法
1.1 供试菌株及主要试剂
禽致病性大肠杆菌TK3菌株(血清型O1)及HJ2菌株(血清型O114),含有P型菌毛,由金陵科技学院兽医微生物学实验室提供。pTG19-T PCR 产物克隆载体来自上海捷瑞生物工程有限公司,胶回收试剂盒购自OMEGA公司,质粒抽提试剂盒由深圳逗点生物技术有限公司提供,琼脂糖购自兰杰科技有限公司。
1.2 引物的设计与合成
鉴于禽大肠杆菌P型菌毛papA基因多为11型,因此以papA基因11型PCR分型通用引物为第1对引物(P1、P2),预计扩增片段大小为281 bp。
P1:5′-GGCAGTGGTGTCTTTTGGTG-3′
P2:5′-GGCCCAGTAAAAGATAATTGAACC-3′
第2对引物(P3、P4)为papA基因两端相对保守区选择的引物,预计扩增片段大小为522 bp,位于papA基因碱基序列的第4至第525位碱基之间,不完全包含papA基因全碱基序列。
P3:5′-ATTAAGTCGGTTATTGCCGG-3′
P4:5′-TGCAACTGCTGAGAAGGC-3′
第3对引物(P5、P6)拟用来扩增完整papA基因11型基因,但由于缺少基因11型可参考的模板,需要扩大引物设计的区域。拟以亲缘关系相近的其他papA基因碱基序列作为模板。查找文献发现基因11型(F11)与基因14型(F14)、基因13型(F13)及基因165型(F165)亲缘关系相近,同属于一个进化分支[5],其中,基因14型具有完整的pap基因碱基序列可供参考。遂以基因14型大肠杆菌83 972株中包含papA基因14型(GenBank:DQ10312.1)的papB至papH之间的碱基序列为模板,分别从papA基因上游的papB基因3′末端及papA基因下游的papH基因5′末端筛选引物,预计扩增片段大小为943 bp,中间片段包含了papA基因的全碱基序列。
P5:5′-ACAGATGAGTCGTCGGCATTTG-3′
P6:5′-GACCGGCAAAAACACCATGAAC-3′
1.3 papA基因DNA模板提取
提取大肠杆菌TK3及HJ2菌株染色体DNA作为模板。取1.5 ml过夜培养菌液,离心后悬于0.5 ml裂解液(TE pH 8.0,0.5% SDS和蛋白酶K50 μg/ml)中,55 ℃水浴1 h后用等体积饱和酚、氯仿及1∶1苯酚和氯仿混合液抽提,乙醇沉淀后溶于蒸馏水中。
1.4 反应体系与反应条件
反应体系均为30 μl:待检测papA模板3 μl,上游引物1 μl,下游引物1 μl(终浓度均为0.4 μmol/L),2×PCR Mix 15 μl,灭菌三蒸水10 μl。
反应条件:94 ℃预变性5 min;94 ℃变性30 s,56 ℃复性 10 s,72 ℃延伸1 min,共35个循环;最后72 ℃延伸5 min,16 ℃维持5 min。扩增产物均用1%琼脂糖凝胶电泳。
1.5 目的基因和T载体连接、转化与筛选鉴定
凝胶电泳后切胶:加450 μl溶胶液,65 ℃水浴至完全融解。将溶液转移到DNA纯化柱上,12 000 r/min离心1 min,加600 μl洗液至DNA纯化柱中,12 000 r/min离心1 min,重复洗1次。12 000 r/min离心5 min,室温挥发5 min,除去残留的乙醇。加20 μl预热的洗脱液,室温静置2 min,最大转速离心收集。取200 μl PCR管,加1 μl pTG19-T载体,再加3 μl PCR胶回收产物,混匀。加4 μl 酶和Buffer混合的即用型2×预混液,立即混匀。在PCR仪上,25 ℃连接30 min。冰上融化DH5α感受态细胞,加入连接产物,轻弹管壁混匀,冰上静置30 min,42 ℃热激45 s后,立即冰上放置3 min,加900 μl LB培养基(不含Amp),37 ℃摇菌培养1 h(转速250 rpm)。Amp抗性的LB固体培养基在37 ℃预热。5 000 r/min离心5 min,弃900 μl LB培养基,用剩余的培养基重悬细菌,用无菌的涂布棒涂菌,37 ℃培养箱中倒置培养过夜。
1.6 PCR鉴定克隆
用T载体上M13上下游引物进行PCR克隆与鉴定。取无菌的2.0 ml离心管,加200 μl LB培养基(含Amp),用无菌的20 μl枪头挑取菌落,并在培养基中反复吹打,37 ℃摇菌培养4 h(转速250 r/min)。反应体系10.0 μl:待检测papA模板1.0 μl,M13上游引物0.4 μl, M13下游引物0.4 μl(终浓度均为0.4 μmol/L),2×PCR Mix 5.0 μl,灭菌三蒸水3.2 μl。PCR反应条件为98 ℃预变性5 min;95 ℃ 30 s,55 ℃ 10 s,72 ℃ 1 min,共35个循环;72 ℃延伸5 min,16 ℃ 维持5 min。扩增产物用1%琼脂糖凝胶电泳。
1.7 papA基因碱基序列测定与分析
选取阳性克隆摇菌并抽提质粒:PCR产物凝胶电泳后选取阳性克隆,取60 μl菌液加入到3 ml LB培养基(含Amp),37 ℃摇菌培养过夜(转速250 r/min),用质粒抽提试剂盒抽提质粒。取10 μl质粒送生工生物工程(上海)股份有限公司进行测序。通用测序引物:
M13 F:5′-CGCCAGGGTTTTCCCAGTCACGAC-3′
M13 R:5′-AGCGGATAACAATTTCACAGAGGA-3′
通过Snap Gene和DNA-Star等生物分析软件对测定的基因碱基序列进行分析、比对,鉴定出HJ2及TK3菌株P型菌毛papA基因是否属于基因11型。将HJ2及TK3菌株P型菌毛papA基因碱基序列进行比对,分析相互之间的同源性。通过模拟翻译得出HJ2及TK3菌株P型菌毛PapA蛋白的氨基酸序列进行比对,同时与亲缘关系相近的基因13型(F13)、基因14型(F14)和F165基因碱基序列及其编码的氨基酸序列进行对比,分析其同源性及其变异特点。
2 结果与分析
2.1 PCR扩增结果
以提取的菌种基因组为模板,用引物1从HJ2及TK3模板中均扩增出产物,电泳结果见图1。从图1可以看出,电泳泳道1和2均有1条DNA条带,大小接近300 bp,与预定的281 bp相近。

M:标准DNA对照;1:HJ2;2:TK3;3:阴性对照。图1 引物1扩增HJ2及TK3菌株基因组papA基因片段电泳结果Fig.1 Electrophoresis results of amplifying papA gene fragments in HJ2 and TK3 genomes using primer 1
以HJ2和TK3菌株基因组为模板,运用引物2和引物3进行了PCR扩增,结果如图2和图3。引物2仅从HJ2菌株基因组中扩增出产物,大小接近522 bp;引物2未能从TK3菌株基因组中扩增出产物。引物3从TK3菌株基因组扩增出产物,大小接近943 bp,但用引物3未能从HJ2菌株基因组中扩增到产物。
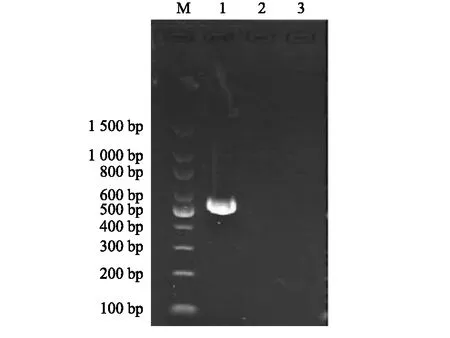
M:标准DNA对照;1:HJ2;2:TK3;3:阴性对照。图2 引物2扩增HJ2及TK3菌株基因组papA基因片段电泳结果Fig.2 Electrophoresis results of amplifying papA gene fragments in HJ2 and TK3 genomes using primer 2

M:标准DNA对照;1:TK3;2:HJ2;3:为阴性对照。图3 引物3扩增TK3菌株基因组papA基因片段电泳结果Fig.3 Electrophoresis results of amplifying papA gene fragments in TK3 genomes using primer 3
2.2 papA基因克隆与筛选鉴定
PCR扩增产物的连接与转化:以扩增产物为模板,再次进行PCR扩增,结果在同样的位置均获得更粗和更亮的DNA条带,将含有扩增产物的可溶性胶切块回收DNA,连接后获得了待鉴定的重组质粒。以筛选待鉴定的重组质粒为模板,运用M13通用测序引物进行PCR扩增、验证,筛选到3种扩增产物阳性克隆,PCR所扩增的片段大小与预期的产物相近。以引物1和引物3扩增产物的重组质粒为模板,用M13上下游引物进行PCR扩增,结果见图4和图5。

M:标准DNA对照;1~7:阳性条带;8:阴性对照。图4 以引物1扩增产物的重组质粒为模板进行PCR鉴定克隆papA基因片段电泳结果Fig.4 The electrophoresis results of the cloned papA gene fragment identified by PCR using the recombinant plasmid of amplified product by primer 1 as the template
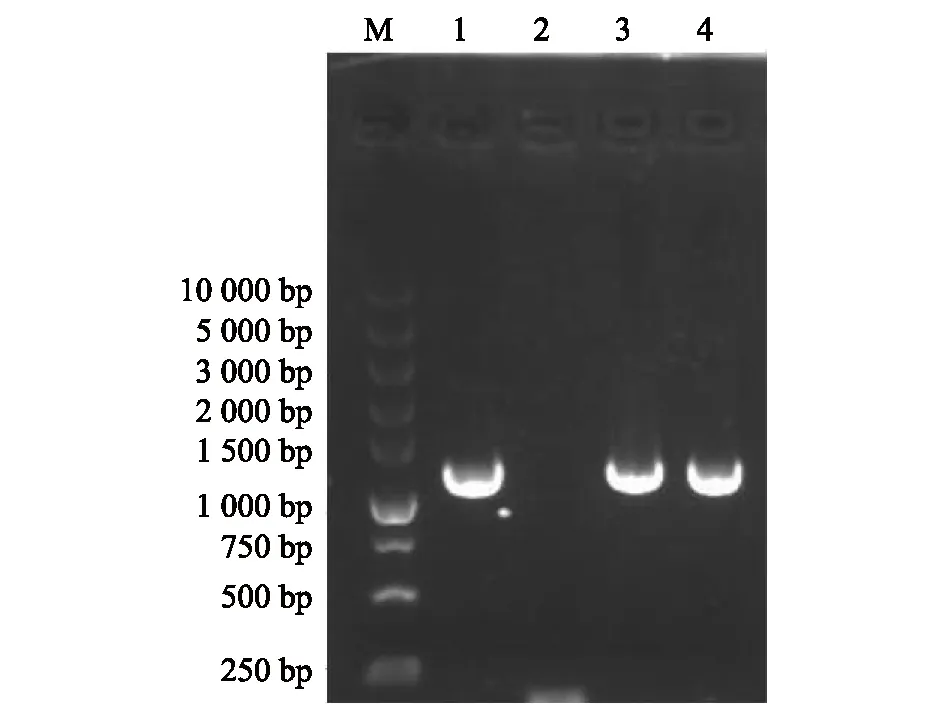
M:标准DNA对照;1、3、4:阳性条带;2:阴性对照。图5 以引物3扩增产物的重组质粒为模板进行PCR鉴定克隆papA基因片段电泳结果Fig.5 The electrophoresis results of the cloned papA gene fragment identified by PCR using the recombinant plasmid of amplified product by primer 3 as the template
2.3 papA扩增产物测序结果
2.3.1 引物1扩增的产物序列 运用M13通用测序引物对所扩增的所有DNA产物进行序列测定,获得了不同片段大小的papA基因碱基序列。运用Snap Gene生物软件分析比对,发现用基因11型扩增引物获得的HJ2和TK3菌株基因组的扩增产物大小为281 bp,两者papA片段相似度达99.5%以上,仅1个碱基有差异(图6)。将HJ2和TK3菌株基因组扩增产物序列与GenBank中已发表的禽大肠杆菌papA基因11型碱基序列(基因序列登记号L07420,含有基因11型)[11]进行比对,发现HJ2菌株的papA基因与比对的papA基因11型区域碱基序列相同,但TK3菌株的papA基因11型有1个碱基发生变异,由A变为C(图7阴影标注),说明扩增到APEC菌株HJ2和TK3的papA基因均属于基因11型。

下划线表示引物1所在位置,有一处碱基变异,标有阴影,TK3菌株中为C,HJ2菌株中为A。图6 以引物1从TK3、JI2菌株基因组中扩增出的papA基因片段与基因11型碱基序列比较结果Fig.6 Comparison of the sequence of papA gene fragments amplified from TK3 and JI2 genomes by primer 1 with the sequence of type 11 papA gene
2.3.2 引物2和引物3扩增的产物序列 引物2从HJ2菌株基因组中扩增的产物大小为522 bp,涵盖从papA基因序列第4位至525位碱基位,有编码7个氨基酸的碱基序列不在扩增范围内。引物3扩增的产物大小为943 bp,经碱基序列测定比对发现其包含了papA全部序列(549个bp),TK3菌株 P型菌毛papA基因共有549个碱基对,其编码182个氨基酸。
2.4 APEC菌株TK3及HJ2 P型菌毛papA基因变异分析
经比对,菌株TK3、HJ2与F13、F14、F165之间存在一定的同源性,主要表现为papA基因碱基序列的5′,从起始密码子到基因扩增分型的共同上游引物(图7中的阴影部分)的碱基序列完全相同,这正是所有基因分型papA扩增可共用同一上游引物的原因。相比之下,不同分型papA基因碱基序列的的3′端碱基序列有着明显的差异性,由图8可以看出,不同分型papA基因碱基序列的3′末端近60个碱基差异比较明显,在可供比较的序列中,至少有6处碱基出现变异,而同为基因11型的禽大肠杆菌TK3与HJ2,在引物2所扩增区域间(图8阴影处)二者之间有2处碱基不同,这可能正是引物2能够扩增出HJ2菌株的papA基因片段而不能从TK3菌株扩增出片段的原因。

阴影部分表示基因分型上游通用引物所在区域,方框内为碱基差异部分。图7 TK3、HJ2菌株papA基因与基因13型(F13)、基因14型(F14)及基因165型(F165) papA基因5′端部分碱基序列同源性比较Fig.7 Homology comparison of papA gene amplified from TK3 and HJ2 strains with type 13 papA gene, type 14 papA gene and type 165 papA gene in 5′ end

○表示未检测;阴影部分表示引物2下游引物所在区域,方框内为碱基差异部分。图8 TK3、HJ2与F13及F165 papA基因3′端部分碱基序列同源性比较Fig.8 Homology comparison of papA gene amplified from TK3 and HJ2 strains with type 13 papA gene and type 165 papA gene in 3′ end
2.5 TK3及HJ2菌株PapA蛋白氨基酸变异分析
经检测分析,TK3与HJ2菌株的papA基因同属于基因11型,而F165与F11大肠杆菌papA基因的之间的相似度达95.3%[14],将TK3、HJ2与F165和F11大肠杆菌PapA蛋白氨基酸序列进行比对,结果见图9。结果显示PapA蛋白同源性较高,由182个氨基酸组成,相互之间绝大多数氨基酸序列一致,有5处氨基酸变异,分别位于第20、31、107、147、151位,而在TK3菌株和HJ2菌株之间,PapA蛋白仅有3处出现氨基酸变异,位于第20、147、151位(图9)。TK3菌株和HJ2菌株作为二个不同血清型大肠杆菌,拥有同一基因分型的papA基因,说明papA基因分型与菌体血清型关联不大。
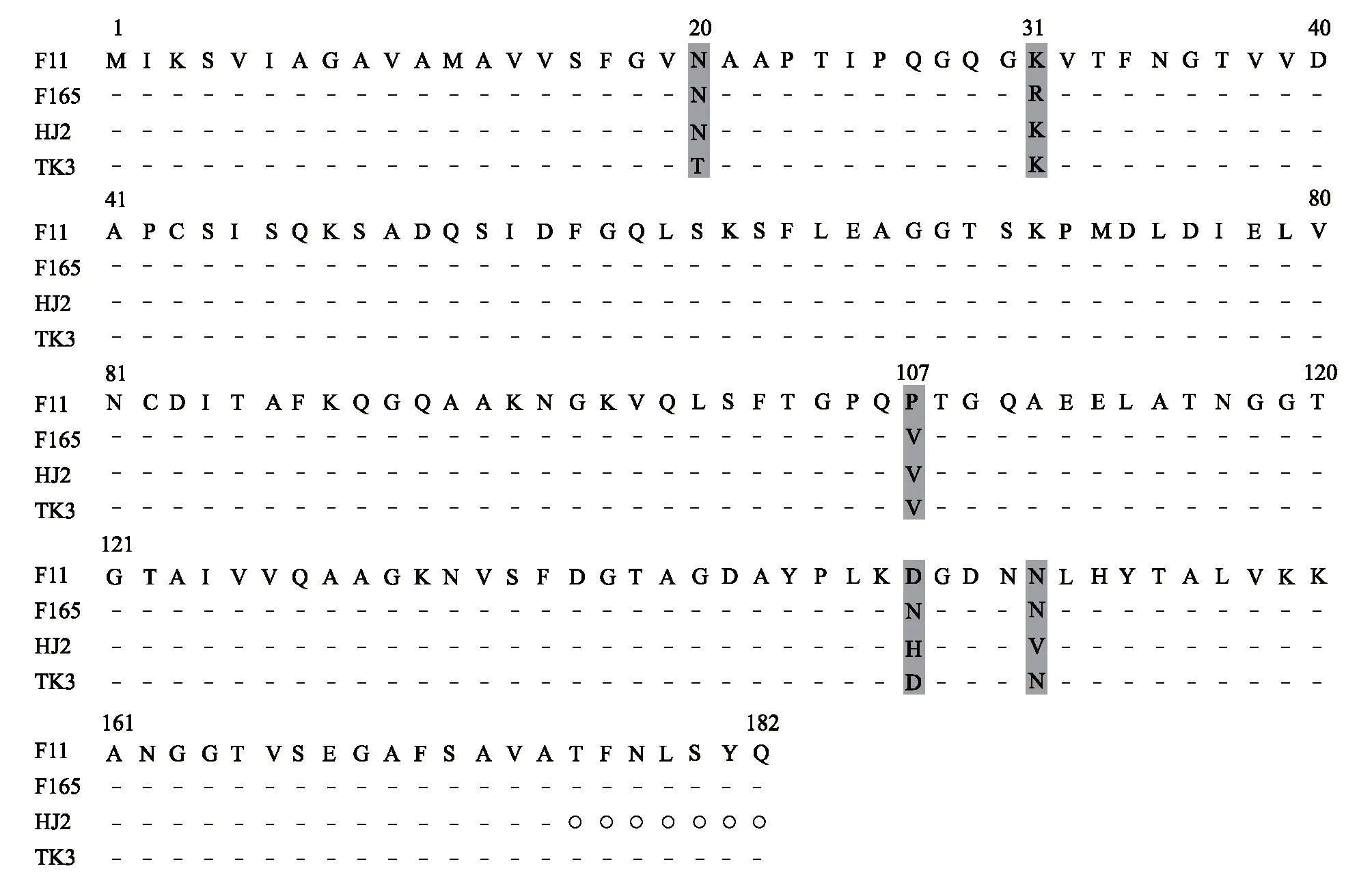
○表示未检测;阴影部分表示氨基酸差异部分。图9 TK3、HJ2与基因型F11及F165菌株PapA蛋白氨基酸序列比较Fig.9 Comparison of the amino acid sequence of PapA protein between TK3, HJ2 and genotype F11 and F165 strains
3 讨论
P型菌毛是禽致病性大肠杆菌(APEC)重要的毒力因子,主要起到黏附人和动物宿主细胞的作用,从而有助于细菌的定居繁殖,引发病理变化,甚至造成死亡。不仅人大肠杆菌具有P型菌毛,禽大肠杆菌也有P型菌毛,所不同的是人大肠杆菌菌毛黏附的是尿道上皮细胞,引起尿道感染,而禽大肠杆菌P型菌毛则是与禽类深部呼吸道结合导致感染[1,8-9]。研究结果表明,P型菌毛是APEC的重要毒力标记,其流行分布率虽然不高[9],但可能还有变异类型未能检出。国内很少有关于APEC的papA基因克隆与基因分型的报道。目前国外文献报道的APEC的P型菌毛papA基因均为基因11型,因此,采用基因11型的扩增引物可以检测出同基因类型的papA基因片段。但基因11型片段仅有281 bp,而完整的papA基因片段为549 bp,该基因片段则位于完整papA基因的第35至314位。因此基因11型扩增引物检测出的papA基因片段并不能反映完整的papA基因信息。
本研究采用能够扩增基因11型的引物扩增到两个菌株的papA部分基因片段。为了弄清APEC的不同分离株P型菌毛完整的papA基因之间的差异性,采用了引物2对位于基因分型片段之外的5′和3′之间的序列进行了扩增,引物2针对的范围从起始密码子到终止密码子前23个碱基处,有编码7个氨基酸的碱基序列不在其内,含有papA绝大多数碱基序列。PCR扩增结果发现,针对HJ2菌株基因组能够扩增到522 bp片段,而未能从TK3菌株中扩增到产物,这说明同为基因11型的APEC的P型菌毛papA基因碱基序列在基因11型碱基序列之外的区域存在一定的差异。为进一步弄清不同菌株完整的papA基因碱基序列的差异,又运用引物3对TK3菌株的完整papA基因进行扩增,并测定了碱基序列,但未能从HJ2菌株中扩增到完整的papA基因碱基序列。基因碱基序列比对后发现,HJ2菌株和TK3菌株菌毛papA基因的5′端有相同的碱基序列,而3′则存在多处不同的碱基,仅在下游引物序列中就有2个碱基存在差异,这就是引物3能从用HJ2菌株中扩增出产物而不能从TK3菌株中扩增出产物的根本原因。将测得的TK3菌株和HJ2菌株菌毛PapA蛋白氨基酸序列进行了比对,发现分型引物间的区段基因编码的氨基酸序列基本相同,但对TK3菌株来说,PapA蛋白氨基酸第20位氨基酸为苏氨酸(T),HJ2的第20位则为天冬酰胺(N),TK3菌株和HJ2菌株的其他PapA部位也有2处氨基酸存在变异,分别位于第147和151位。这说明即使同属于同一个基因分型,不同菌株的papA基因和编码的氨基酸序列也不是完全相同的,且papA基因分型与菌体血清型关系不大。
为了更全面比较分析不同血清型菌株papA之间的差异,通过DNA-Star软件分析,将TK3菌株的PapA蛋白氨基酸序列与相似度较高的F165 PapA和来自人尿道感染的大肠杆菌P型菌毛PapA蛋白氨基酸序列进行了比对,结果发现分型引物间的区段序列基本相同。在分型区外的区域,5′端同源性较高,3′端变异非常明显。值得注意的是,TK3菌株虽然属于papA基因11型,却是以基因14型的papA上下游序列为模板设计的引物3扩增出来的。该引物扩增papA区域外的papB和papH之间的序列,其5′端位于papA上游papB基因的3′端,3′端则位于papA下游papH基因的5′端,该对引物能够扩增出完整的papA基因。由此可见,虽然本研究扩增papA具有偶然性,但恰好说明了papA基因分型不同的菌株其papB和papH基因却可能存在较大的相似性。相反,运用引物3却未能从HJ2菌株中扩增到完整的papA片段,这反映了即使papA基因分型相同,其上下游papB和papH基因却可能存在变异,从另一个方面证明了通过现有基因分型划分APEC P型菌毛不一定具有代表性,提示用papA基因扩增分型对APEC P型菌毛进行检测分类有一定的意义,但是其他分子生物学特征则需要综合分析。
papA是编码P型菌毛PapA蛋白的基因,约1 000个PapA蛋白亚基组装形成弹簧状菌毛杆,从而形成菌毛的主体结构[8,10]。PapA蛋白虽然不直接参与细菌的宿主作用,但仍然与细菌的致病性存在密切的关系。主要表现在菌毛杆连接着黏附性蛋白PapG,没有PapA蛋白,PapG蛋白将失去支撑。而弹簧状菌毛杆也可以通过伸缩来调节菌毛的长度,便于接近宿主细胞。目前,人源大肠杆菌papA基因分布较广,且因变异出现14个基因型,但这些变异不影响菌毛的表达和黏附作用。禽大肠杆菌papA基因型均属基因11型,其变异与致病性的关系尚不知晓。大多数APEC缺乏完整的操纵子基因簇,因而较少能够克隆到表达菌毛的基因簇重组载体[9]。究其原因,可能存在新的变异位点而没有检测出来。有的菌株papA基因还插入了抗生素抗性基因,与细菌耐药性保护机制有关[9],这也会影响到PCR扩增检测结果。本研究测定的papA基因未发现有抗生素抗性基因插入的现象,有关机制尚需进一步研究。
综上,本研究通过设计合成的多对引物,获得了papA基因的克隆,经比对分析发现属于基因11型,从而获得papA基因克隆重组菌,为致病性大肠杆菌菌毛毒力因子的检测、菌毛亚单位疫苗的研制提供了一定的依据。研究结果还证实,APEC不同菌株P型菌毛papA基因虽然同属基因11型,但仍然处于变异过程之中,随着检测样品数量的不断积累,新的变异类型可能还会被发现。

