常见益生菌耐药性研究进展
吉 星, 李 俊, 王 冉, 何 涛
(江苏省农业科学院农产品质量安全与营养研究所/省部共建国家重点实验室培育基地——江苏省食品质量安全重点实验室,江苏南京210014)
益生菌是一种具有活性的微生物,当摄入适当的量时,可对人体产生有益的效果[1]。目前已有大量的益生菌资源被挖掘,如乳杆菌,芽孢杆菌,双歧杆菌和肠球菌等。益生菌通常应用在奶、肉等食品发酵、日常饮食补充或配合抗生素给药治疗等[2]。还有一些研究结果证明益生菌对一些慢性疾病具有治疗或预防作用,如肥胖、糖尿病、心血管疾病和慢性肠炎等[3]。除此之外,随着世界各国对养殖及饲料产业“减抗、禁抗和替抗”的政策要求,益生菌作为热门的抗生素替代产品,也越来越多地出现在饲料添加剂中。
尽管传统上常用的益生菌被证实对人类无害,但从监管角度来看,并非所有的益生菌都可以被称为“公认安全”状态(Generally Recognized As Safe,GRAS)。近年来,由于抗生素的过度使用及超级耐药病原菌的出现,越来越多的人担心细菌耐药性将对全球公共健康产生威胁。益生菌作为在自然环境和人体内大量存在的常驻菌群,可能成为潜在的耐药基因储存库,并存在传播和扩散耐药基因的风险[4]。在全球关注公共卫生和食品安全的背景下,益生菌的耐药性及其耐药基因转移性的研究具有重要的科学意义。本综述旨在归纳和讨论从发酵食品、益生菌产品中分离的常见益生菌对抗生素的耐药情况和耐药基因转移风险,以期对益生菌的安全规范管理和使用提供理论依据。
1 中国允许使用的益生菌种属
中国通常以菌种名单列表和行政许可公告的形式发布允许使用的益生菌菌种。目前,国家卫生健康委员会发布了《可用于食品的菌种名单》、《可用于婴幼儿食品的菌种名单》和《可用于保健食品的益生菌菌种名单》,规定了人类使用的益生菌主要为双歧杆菌和乳杆菌。此外,农业农村部还针对养殖业使用的微生物菌种发布了《饲料添加剂品种目录》,其中除常见的乳杆菌和双歧杆菌外,还包括肠球菌和芽孢杆菌等。
乳杆菌最早在20世纪初由Elie Metchnikoff于保加利亚发酵乳中分离,并由此提出了最早的“益生菌”概念[5]。乳杆菌为厚壁菌门厌氧或兼性厌氧的革兰氏阳性杆菌,不产生孢子,主要包括嗜酸乳杆菌、干酪乳杆菌、鼠李糖乳杆菌、植物乳杆菌和罗伊氏乳杆菌等。双歧杆菌最早于1900年健康婴儿粪便中分离,为放线菌门严格厌氧的革兰氏阳性杆菌,不产孢子,主要包括长双歧杆菌、两歧双歧杆菌、动物双歧杆菌、青春双歧杆菌和婴儿双歧杆菌等[6]。芽孢杆菌也是最常见的益生菌之一,已被广泛使用了60多年。芽孢杆菌为厚壁菌门需氧革兰氏阳性杆菌,可产芽孢,主要包括枯草芽孢杆菌、解淀粉芽孢杆菌、凝结芽孢杆菌和地衣芽孢杆菌等[7]。肠球菌为厚壁菌门需氧或兼性厌氧革兰氏阳性菌,不产芽孢,主要包括粪肠球菌和屎肠球菌等[8]。
2 益生菌的药物敏感性评价标准和方法
根据各国益生菌使用基本准则和微生物耐药性防控的要求,益生菌在使用前需要进行抗菌药物敏感性试验,但药敏试验结果会受测试菌属、培养基组成、培养条件及培养时间的影响。目前关于益生菌的抗生素敏感性评价尚未有统一的标准。
根据益生菌菌种不同,常参考美国临床实验室标准协会(CLSI)、欧洲食品安全局(EFSA)和国际标准化组织/国际乳制品联合会 (ISO/IDF) 推荐的微量肉汤稀释法或琼脂稀释法进行抗菌药物敏感性测试。例如,对于乳杆菌属益生菌的抗菌药物最小抑菌浓度(MIC)测试可结合CLSI M45、ISO/IDF-10932标准和EFSA发布的《细菌对人类和兽医重要抗菌药物的敏感性评估指南》进行;双歧杆菌属益生菌可参考CLSI M11和ISO/IDF-10932等标准。除了以上这些参考标准和方法,也可使用纸片扩散法和抗生素浓度梯度法(E-test法)对益生菌进行药物敏感性测试。有报道称纸片扩散法和E-test法得到的嗜酸乳杆菌MIC结果与标准的微量肉汤稀释法结果具有一致性[9]。尽管这些方法都可以得到有效的益生菌药敏数据,但实验室内不同批次相同种属的细菌应使用同一种方法,才能保证数据的可重复性和可比较性。
3 常见益生菌的耐药性
与很多致病菌一样,益生菌也会表现出对多种抗菌药物的耐药性(表1),包括固有耐药性和获得性耐药性两种类型。固有耐药性主要是益生菌染色体基因编码的,例如DNA位点的自发突变、药物外排泵的存在、抗生素降解酶的分泌和细胞外膜结构药物靶点的缺乏等[10]。而获得性耐药性是指细菌通过接合、转化和转导等方式获得外源的基因片段而获得耐药性,这些耐药基因通常位于可移动元件上,如质粒、整合子、转座子和噬菌体等[11]。一般来讲,益生菌的固有耐药性不具有水平转移扩散风险,而获得性耐药性具有转移到其他致病菌的风险,应引起高度重视。
3.1 益生菌的固有耐药性
3.1.1 乳杆菌 大多数乳杆菌对头孢菌素、氨基糖苷类药物、磺胺类药物和硝基咪唑类药物具有天然耐药性,这可能和细胞壁的低渗透性和某些基因的自发突变有关,其具体机制有待进一步阐明[11-12]。有结果表明乳杆菌中染色体基因的突变会产生抗生素抗性,如鼠李糖乳杆菌菌株23S rRNA 基因中的单一位点突变降低了红霉素对核糖体的亲和力,赋予了其对大环内酯类药物的抗性[13]。值得注意的是,几乎所有的乳杆菌对万古霉素具有天然耐药性,这可能是由于乳杆菌的肽聚糖D-丙氨酸残基被D-乳酸或D-丝氨酸取代,从而阻止了万古霉素和乳杆菌的结合,维持了细胞壁的正常合成[14]。
3.1.2 肠球菌 部分肠球菌对β-内酰胺类药物具有一定程度的天然耐药性,是由于这些肠球菌表达的青霉素结合蛋白PBP(如屎肠球菌编码的PBP5和粪肠球菌编码的PBP4)与β-内酰胺类抗生素结合能力较弱,从而使药物不能作用于肠球菌细胞壁[15]。此外,粪肠球菌对氨基糖苷类药物也具有一定的固有耐药性,这可能是位于染色体的保守基因aac(6′)-Ii编码的氨基糖苷6′-N-乙酰转移酶和efmM基因编码的甲基转移酶导致核糖体靶位变化有关[16-17]。同时,肠球菌的固有耐药性也和一些ATP 结合盒超家族外排泵有关,如lsa基因可介导粪肠球菌或屎肠球菌对大环内酯类-林可霉素-链阳性菌素类抗生素(MLS)的抗性[18]。此外,肠球菌还具有从环境中直接吸收叶酸的能力,这导致甲氧苄啶-磺胺甲噁唑不能竞争抑制细菌的四氢叶酸合成途径而产生了固有抗性[19]。
3.1.3 双歧杆菌 双歧杆菌对莫匹罗星具有天然抗性,其机制是一种特殊的异亮氨酰-tRNA合成酶基因(ileS)的表达导致了莫匹罗星的竞争抑制作用丧失,从而恢复了细菌的蛋白质合成能力[20]。此外,大多数双歧杆菌对氨基糖苷类药物不敏感,其原因是由于其缺乏细胞色素介导的药物转运功能[21]。还有部分短双歧杆菌中编码核糖体亚单位蛋白S12的rpsL基因突变可导致其对链霉素的高水平抗性[22]。
3.1.4 芽孢杆菌 芽孢杆菌对大多数的抗生素是敏感的,其固有耐药性研究较少。目前有相关报道称bcrA编码的ABC 转运蛋白可介导地衣芽孢杆菌、枯草芽孢杆菌等对杆菌肽的固有抗性[23]。此外,位于染色体的erm(D)和erm(K)基因可介导副地衣芽孢杆菌和地衣芽孢杆菌对大环内酯、林可酰胺和链阳菌素-B类抗生素的耐药性[24-25]。
3.2 益生菌的获得性耐药性特征
3.2.1 乳杆菌 乳杆菌最常见的获得性耐药基因为四环素类耐药基因。迄今为止,已在罗伊氏乳杆菌、鼠李糖乳杆菌和发酵乳杆菌等多种乳杆菌中检测到位于质粒或转座子上的四环素类抗性基因,包括编码核糖体保护蛋白的基因tet(W)、tet(M)、tet(S)、tet(O)和tet(Z)和外排泵编码基因tet(K)和tet(L)[26-27]。此外,乳杆菌属益生菌还可携带其他常用药物的耐药基因,如cat基因可介导嗜酸乳杆菌、德氏乳杆菌等对氯霉素的耐药性[28],erm(A)、erm(B)和erm(C)基因可介导多种乳杆菌对红霉素等大环内酯类药物的耐药性[29],lnu(A)基因可介导罗伊氏乳杆菌对林可酰胺类药物抗性[30],aac(6′)-aph(2″)、ant(6)和aph(3′)-IIIa可介导植物乳杆菌对氨基糖苷类抗生素的抗性[31]。值得注意的是,除了植物乳杆菌中常见的blaZ基因,少数乳杆菌还携带β-内酰胺抗性相关基因blaTEM和碳青霉烯类耐药基因blaOXA-48[32-34]。
3.2.2 肠球菌 肠球菌也具备获得多种外源性耐药基因的能力,如从奶制品中分离的屎肠球菌或粪肠球菌被检测出多种抗性基因,如四环素耐药基因tet(K)、tet(L)、tet(M)和tet(S),氯霉素耐药基因cat,氨基糖苷类耐药基因aadE、aph(3′)-IIIa和ant(6′)-Ia,红霉素抗性基因erm(B)[35-36]。以上耐药基因通常是由质粒和转座子介导转移的,例如Inc18质粒、pAMβ1质粒、Tn917和Tn916等[37]。粪肠球菌还可获得ABC 转运蛋白基因lsa(E)从而对林可酰胺、截短侧耳素和链阳菌素A类药物产生联合耐药性[38]。除了常见的药物外,少数屎肠球菌因对一线药物产生耐药性而备受关注,如Tn3家族转座子携带的vanA,vanB,vanC和vanM可编码D-乳酸取代细胞壁五肽前体中的末端D-丙氨酸而介导肠球菌的万古霉素抗性[39]。质粒携带的optrA、poxtA和cfr基因可通过编码ATP 结合盒超家族外排泵或改变细菌23S rRNA的方式介导肠球菌对利奈唑胺等恶唑烷酮类药物的抗性[40]。
3.2.3 双歧杆菌 有关双歧杆菌所携带耐药基因的报道相对较少,主要为四环素类和大环内酯类耐药基因。在嗜热双歧杆菌和动物双歧杆菌中位于转座子Tn5432上的编码核糖体保护蛋白的基因erm(X)可介导其对大环内酯类药物的耐受性[41]。tet(W)、tet(M)和tet(O)等四环素耐药基因也在长双歧杆菌、短双歧杆菌、动物双歧杆菌和噬热双歧杆菌等双歧杆菌中检测到,其中以tet(W)最为普遍[42-43]。也有报道称,尽管双歧杆菌中的tet(W)基因整合在染色体中,但该基因的侧翼通常是转座酶靶序列或转座酶编码序列,在适当的条件下可能发生转移[43-44]。
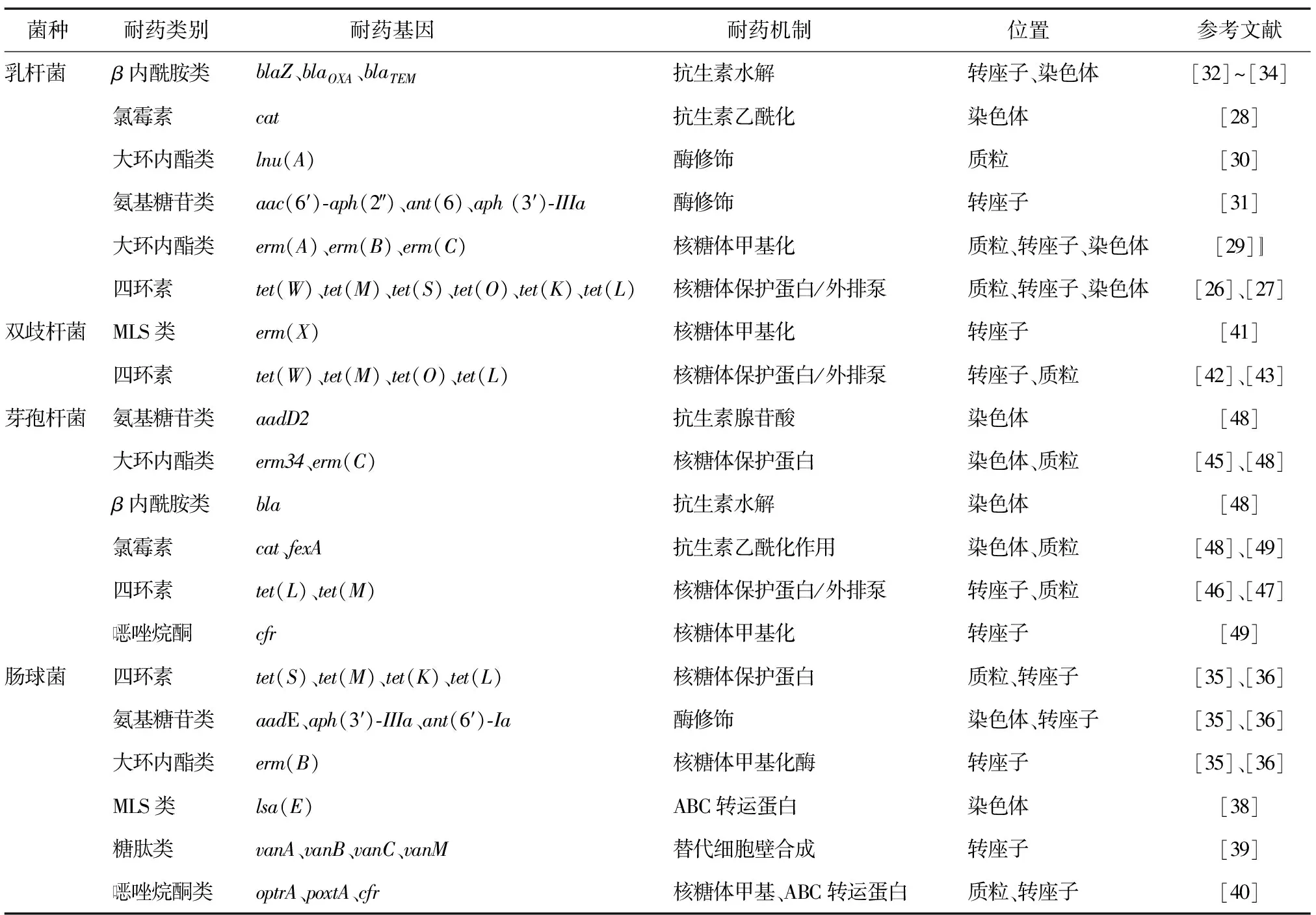
表1 益生菌菌种中鉴定的耐药基因及其相关特征
4 益生菌耐药基因的可转移性
益生菌大多数是革兰氏阳性菌,外源性的耐药基因主要通过接合性质粒、转座子和整合性接合元件等获得或传播到其他共生细菌中。目前益生菌中耐药基因转移报道较多的为四环素和大环内酯类耐药基因,例如发酵乳杆菌、唾液乳杆菌携带的erm(B)和植物乳杆菌、短乳杆菌携带的tet(M)可在体外条件下以0.29×10-5CFU至1.39×10-5CFU(供体菌)的频率水平转移至粪肠球菌中[50]。唾液乳杆菌和罗伊氏乳杆菌携带的erm(B)、tet(M)、tet(W)和tet(L)基因不仅可在体外转移至粪肠球菌中,也可在体内环境下转移至其他肠道共生菌中,转移频率为2×10-3CFU(供体菌)左右[51]。除此之外,植物乳杆菌携带的tet(M)和erm(B)阳性质粒也可在体外和动物体内环境转移到乳酸乳球菌和粪肠球菌中[52-54]。
除乳杆菌外,芽孢杆菌和双歧杆菌的四环素耐药基因也具有可转移性。如Tn916家族介导的tet(M)基因和质粒携带的tet(K)基因可通过接合转移的方式在芽孢杆菌、大肠杆菌、肠球菌和金黄色葡萄球菌中转移[55-56]。双歧杆菌和粪肠球菌的tet(M)基因的遗传规律高度一致,表明相互间曾发生了水平基因转移[42]。在体外条件下,tet(W)基因及上游区域的转座酶基因,可低频率地在长双歧杆菌和青春期双歧杆菌之间转移[57]。值得注意的是,除四环素和大环内酯类耐药基因外,万古霉素耐药基因vanA可在肠球菌不同菌种间转移,并可向嗜酸乳杆菌转移[58-59]。以上研究结果表明肠球菌不仅可与本菌属其他菌种也可与其他共生细菌进行耐药基因的交换,因此在益生菌的耐药基因转移过程中扮演重要角色(图1)。

图1 耐药基因在益生菌及致病菌间的水平转移Fig.1 Horizontal transfer of drug resistance genes between probiotics and pathogenic bacteria
5 结论与建议
总体来说,益生菌产品作为人体内细菌的补充,可能成为耐药基因的储库,同时具有传播耐药基因的风险。益生菌中的耐药基因像一把“双刃剑”,在提高益生菌抵抗不良环境能力的同时,还可能通过水平转移的方式传播到共生菌和其他病原菌中,从而引起严重的健康问题。
中国人用和畜禽养殖用益生菌行业正在快速扩张[60-62],但目前仍缺乏完善的益生菌产品安全使用管理规范,特别是对于益生菌的耐药性问题尚未形成完善有效的评价标准。在未来的益生菌生产和使用中,亟需制定完善益生菌产品中使用菌种的安全性评估体系,严格做好益生菌产品中菌种的质量控制,同时需要对益生菌的耐药基因和可移动元件进行全面检测,从分子水平上评估益生菌耐药基因的转移风险,并采取适当的措施防止益生菌耐药基因在使用过程中通过日常饮食、临床治疗以及畜禽养殖等过程的转移和扩散,严格管控携带可移动耐药基因和具有传播风险的益生菌菌株。

