不同高级氧化技术降解邻苯二甲酸二甲酯的对比研究
余可,王志鹏,陈蕾
(南京林业大学 土木工程学院,江苏 南京 210037)
邻苯二甲酸酯不易挥发、性质稳定,因具有良好的可塑性和柔韧性,作为增塑剂被广泛使用[1-3]。由于邻苯二甲酸酯在使用过程中难以与其他分子形成新的共价键,因此在生产、使用和废弃过程中,易被释放至环境中,导致环境中污染,对生态系统甚至人类健康产生威胁[4]。
传统的吸附法、生物降解法等处理含邻苯二甲酸酯的废水时存在成本高、去除效率低或者易造成二次污染等问题[5-6]。高级氧化技术具有操作简单、降解速率快等优点[7]。虽然目前已有一些采用高级氧化技术降解邻苯二甲酸酯的研究,但是缺少不同高级氧化技术之间系统的比较研究。
本文以邻苯二甲酸酯二甲酯(DMP)模拟废水为对象,研究臭氧氧化法、UV/H2O2法、Fenton法对水中DMP的去除效果,采用单因素研究法考察DMP降解的影响因素,采用响应面分析法优化以寻得最佳反应条件,并对3种方法进行了成本比较分析。研究结果可为有效处理含邻苯二甲酸酯的工业废水提供一定的理论指导。
1 实验部分
1.1 试剂与仪器
邻苯二甲酸二甲酯(DMP)、七水硫酸亚铁、邻菲罗啉、氢氧化钠、硫代硫酸钠、过氧化氢(质量分数为30%)、甲醇均为分析纯;微孔滤膜(0.45 μm), 由美国Millipore公司提供;无菌注射器(10 mL),由天津科亿隆实验设备有限公司提供;超纯水,自制。
Centrifμge 5418型离心机;NPF3W 型臭氧发生器;LC 2010型高效液相色谱仪;CJJ-6型磁力加热搅拌器;HH-4型恒温水浴锅;PB-10型pH计;MiLiQ型纯水仪;FA2014A型分析天平;JH-GHX型光化学反应仪。
1.2 DMP的降解实验
1.2.1 臭氧降解DMP实验 臭氧通过臭氧发生器制得,在3 h内,持续将制备的臭氧通入臭氧水制备柱内超纯水中,使得溶液中臭氧水维持在一定浓度。参与反应时,根据具体实验需要的臭氧浓度,将臭氧水和超纯水准确转移至1 000 mL的50 mg/L DMP水溶液中。反应一段时间后,取20 mL反应溶液,立即使用0.10 mol/L的Na2S2O3终止反应,用0.45 μm 滤膜过滤后测定DMP的浓度。
1.2.2 UV/H2O2降解DMP实验 调节光反应器内紫外灯的功率,将一定量的H2O2加入1 000 mL的50 mg/L DMP水溶液中,用六联磁力加热搅拌器进行充分的搅拌。反应一段时间后,取20 mL反应溶液,加入0.10 mol/L的Na2S2O3终止反应,用0.45 μm滤膜过滤之后测定DMP的浓度。
1.2.3 Fenton降解DMP实验 将一定量的H2O2和Fe2+溶液加入1 000 mL的50 mg/L DMP水溶液中,用磁力加热搅拌器进行充分的搅拌。反应一段时间后,取20 mL反应溶液,加入0.10 mol/L的Na2S2O3终止反应,用0.45 μm滤膜过滤后测定DMP的浓度。
1.3 DMP浓度的分析方法
DMP的浓度采用高效液相色谱仪进行检测。检测参数如下:色谱柱采用C-18(4.6 mm×150 mm)、 紫外检测器的波长为230 nm、流动相为甲醇和水(体积比为60∶40)、流速1.2 mL/min、柱温35 ℃、进样量10 μL。以DMP的实际浓度为横坐标,单位为mg/L,以峰面积为纵坐标绘制标准曲线。计算所得的标准曲线的回归方程为:Y=17 530X+3 710(R2=0.999)。
1.4 响应面优化法
响应面优化法(RSM)是一种实验条件寻优的方法,包括试验设计、建模、验证模型的准确性、寻找最佳的实验条件。该方法通过对过程的回归拟合和相应曲面、等高线的绘制,可方便的计算出相应的各因素的水平响应值。在各因素的水平响应值基础上,可以寻找并预测最优的响应值及其实验条件[8]。
在DMP降解实验中,设计了3因素3水平的实验方案,根据实验数据拟合了影响DMP降解率的二次多项回归模型。通过方差分析,对模型的显著性、实验因素的显著性、因素间交互作用的显著性及试验值的可靠性进行了检验;通过响应面优化找到了DMP降解的最佳条件和最大降解率。
2 结果与讨论
2.1 O3降解DMP的单因素优化实验
2.1.1 溶液初始pH值的影响 当反应温度为25 ℃、 臭氧浓度为15 mg/L时,反应溶液的pH值对臭氧降解DMP的影响见图1。
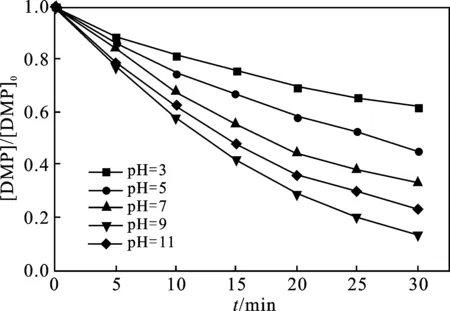
图1 初始pH值对DMP降解效果的影响Fig.1 Effect of initial pH value on degradation of DMP
由图1可知,当臭氧浓度为15 mg/L,溶液pH值分别为3,5,7,9,11时,反应30 min之后,对应的臭氧对DMP的降解率分别为38.02%,54.48%,67.26%,86.61%,76.83%。随着溶液碱度的增大,DMP降解率随之增大增幅显著,最大提升幅度为48.59%;当pH值大于9时,继续增大溶液pH值,DMP降解率减小。因此,臭氧降解DMP的最佳pH值为9。
臭氧的氧化还原电位为2.01 V,可能通过两种途径对有机污染物进行降解:一方面,臭氧直接氧化降解有机污染物,分解难以自然降解的有机物[9];另一方面,通过生成的·OH间接氧化污染物。·OH 与DMP的反应速率远大于臭氧直接氧化DMP的速率。当pH值较低时,溶液中溶解的臭氧未被分解成为活性自由基,臭氧直接氧化占主导地位,反应具有高度选择性,但此时反应速率较慢[10]。随着pH值的增加,臭氧逐渐分解产生·OH,反应速率升高。但当pH值大于9时,臭氧分解产生·OH 的速率过快,溶液中产生了过量的·OH,易发生链式反应,臭氧利用率降低,导致被用以降解DMP的·OH减少,DMP的降解效率降低[11]。因此得出臭氧降解DMP的最佳pH值为9。
2.1.2 臭氧浓度的影响 当反应温度为25 ℃,pH值为9时,臭氧浓度对臭氧降解DMP的影响见图2。
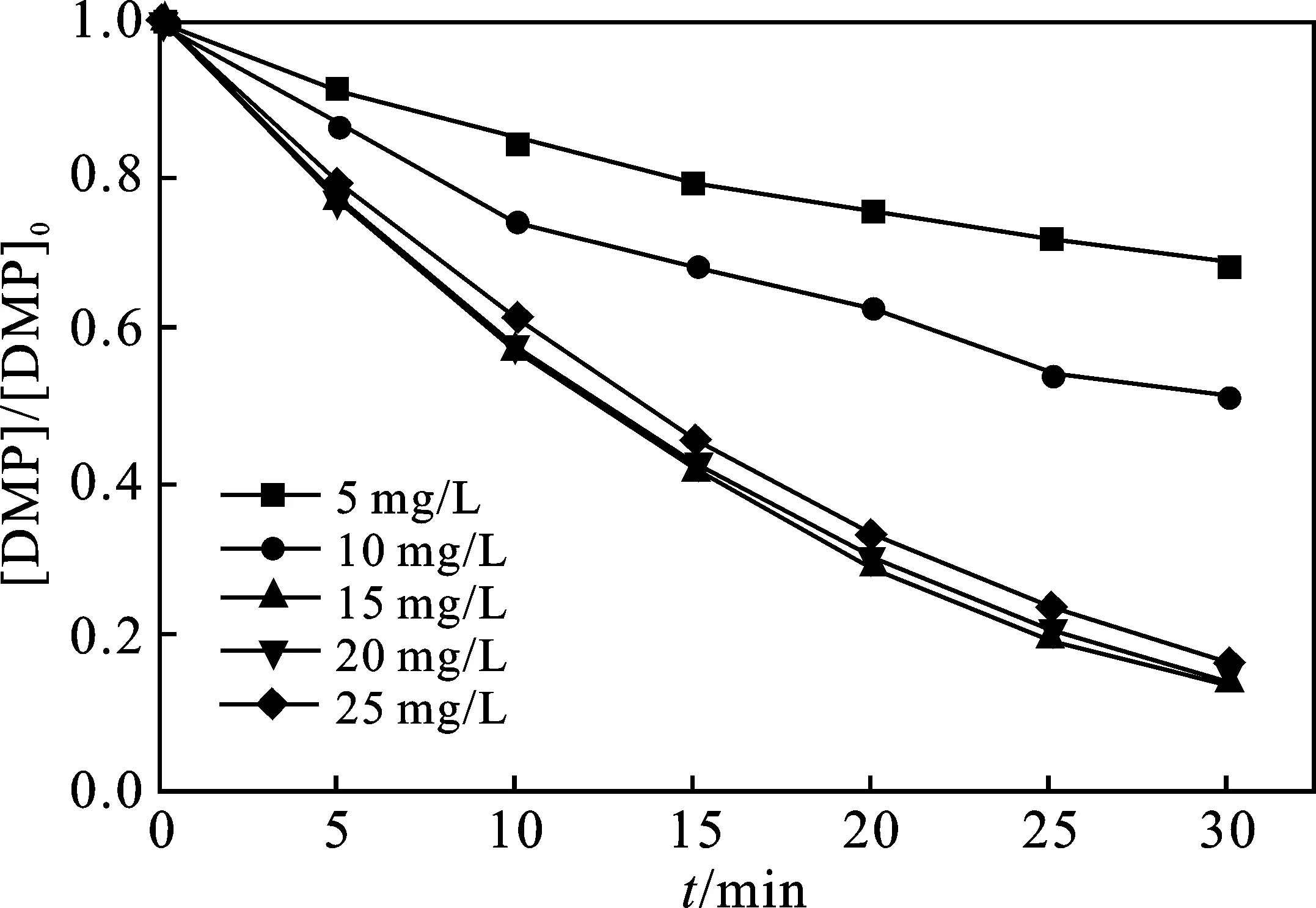
图2 臭氧浓度对DMP降解的影响Fig.2 Effect of ozone concentration on DMP degradation
由图2可知,在臭氧浓度分别为5,10,15 mg/L的条件下,反应30 min后,DMP的降解率分别由31.26%增大至86.61%,当投加量在不超过15 mg/L, 随着臭氧浓度的增大,溶液中·OH的浓度增大,DMP的降解率增大;当投加量从15 mg/L增加至20 mg/L 和25 mg/L时,DMP的降解率从86.61%下降至85.31%和83.13%,随着臭氧浓度的增大,DMP的降解率降低。因此,臭氧降解DMP的最佳的臭氧浓度为15 mg/L。
随着臭氧浓度的增加,一部分溶液中的臭氧从溶液中转移至气相中,未参与DMP的氧化中,降低了臭氧的利用率[12];然而溶液中的·OH增多,提升了DMP的降解率,而当臭氧浓度增大至一定值时,溶液中发生链式反应,降低了溶液中·OH的含量。因此,臭氧的投加量存在一个最佳值,使用最佳的臭氧浓度不仅能提高降解率,而且从工程实际考虑更为经济。
2.2 UV/H2O2降解DMP的单因素优化实验
2.2.1 UV功率的影响 当反应温度为25 ℃,溶液pH值为5,H2O2浓度为180 mg/L时,UV功率对DMP降解的影响见图3。
由图3可知,DMP的降解率随着光照强度的增大而增大。当增大UV功率至300 W,反应30 min后,DMP降解率达到100%。原因是UV功率增大导致H2O2的光解速率增加,溶液中·OH浓度随之增大,溶液中增多的·OH,增大了与DMP的接触反应机会,提升了DMP的降解率。

图3 UV功率对DMP降解的影响Fig.3 Effect of UV power on DMP degradation
2.2.2 溶液初始pH的影响 当反应温度为25 ℃, UV功率为300 W,H2O2初始浓度为180 mg/L时,不同pH值对光降解的影响见图4。

图4 pH值对DMP降解的影响Fig.4 Effect of pH on DMP degradation

2.2.3 H2O2浓度的影响 当反应温度为(25±1) ℃,UV功率为300 W,pH值为5时,H2O2投加量对DMP降解率的影响见图5。
由图5可知,当H2O2浓度由30 mg/L增大至180 mg/L(H2O2与DMP的摩尔比为20.6),DMP的去除效果逐渐提升,由63.78%增大至100%;若继续增大H2O2的浓度,反应30 min后,降解率略有降低。

图5 H2O2投加量对DMP降解的影响Fig.5 Effect of H2O2 dosage on DMP degradation
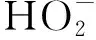
2.3 Fenton降解DMP的影响因素
2.3.1 Fe2+浓度的影响 当反应温度为25 ℃、pH值为3、H2O2浓度为180 mg/L时,Fe2+浓度对邻苯二甲酸二甲酯降解的影响结果见图6。

图6 Fe2+浓度对Fenton降解DMP的影响Fig.6 Effect of Fe2+ concentration on the degradation of DMP by Fenton
由图6可知,Fe2+是Fenton体系中的催化剂,是反应产生·OH的必要条件[15]。当Fe2+浓度从15 mg/L增加到60 mg/L时,反应进行30 min后,DMP的降解率从17.53%增加至48.76%,Fe2+浓度的增加显著提升了DMP的去除效果。继续增大Fe2+浓度,当Fe2+浓度从60 mg/L增加至75 mg/L时,反应30 min后,降解率仅提高了0.65%。这表明当Fe2+浓度达到一定范围,继续增加Fe2+浓度对DMP去除影响有限。其原因可能一方面,随着Fe2+浓度的增加,溶液中产生的·OH越来越多,过量的Fe2+与DMP竞争·OH,影响DMP的降解效率,虽然Fe3+能通过Fe2+与Fe3+的循环再生,继续催化H2O2产生·OH,但是Fe3+转化为Fe2+的速率较低,反应整体较慢。所以Fe2+的最佳浓度为 60 mg/L。
2.3.2 H2O2投加量的影响 当溶液初始pH值为3、Fe2+初始浓度为60 mg/L时,H2O2浓度对邻苯二甲酸二甲酯降解的影响结果见图7。

图7 H2O2投加量对Fenton降解DMP的影响Fig.7 Effect of H2O2 dosage on Fenton’s degradation of DMP
由图7可知,当H2O2浓度从30 mg/L增加至180 mg/L时,反应30 min后,DMP降解率从14.55%增加48.76%,可见H2O2浓度的增加显著提升了DMP的去除效果。H2O2是Fenton反应的重要氧化剂,随着溶液中H2O2浓度的增加,·OH含量增加,增大了对DMP的降解率。当H2O2的浓度从180 mg/L增加至240 mg/L时,DMP的降解率从48.76%降低至45.41%。这是因为在Fenton体系中多余的H2O2不能转化为·OH去除DMP,部分·OH降解中间产物,多余的H2O2会与·OH反应生成氧化能力较弱的·H2O[15],从而降低整个反应体系中的DMP的降解率。因此H2O2是·OH的生成剂,又是羟基自由的抑制剂,Fenton反应中的H2O2浓度要控制在一定范围内。结合前文可得出Fe2+与H2O2的最佳摩尔比为1∶3,二者最佳浓度分别为60,180 mg/L。
2.3.3 pH值的影响 在反应温度为25 ℃,H2O2初始浓度为180 mg/L,Fe2+初始浓度为60 mg/L时,溶液初始pH值对DMP降解的影响见图8。

图8 pH值对Fenton降解DMP的影响Fig.8 Effect of pH on Fenton’s degradation of DMP
由图8可知,当pH值为3.0时降解率最大,为48.76%。目前普遍认为,pH值因能改变Fe2+的水解进程而影响到整个体系降解DMP的效能,反应方程式如下(1)和(2),反应中由于Fe2+与H2O2生成的Fe(OH)+活性高于Fe2+,更易与H2O2反应,对H2O2进行无效的消耗[16]。在pH值为3.0~4.0时,因H+含量丰富,抑制了(1)和(2)的进行,溶液中的Fe2+保持在一个平衡值,此条件益于·OH 的产生,DMP 降解效率较佳;然而,在pH值为2.0时,DMP的降解率降低,这可能是过量的H+消耗·OH 引起的,·OH 含量的下降会降低其对于DMP的降解;在pH为5.00~6.0时,H+的浓度较低,同时由于体系中存在的H2O2消耗Fe(OH)+,促进了反应(1)的正向进行并降低了溶液中的Fe2+含量,最终导致·OH的产量减少而降低DMP的降解率。当溶液为碱性环境中时,过高的pH值导致Fe2+/Fe3+沉淀,从反应体系中排出,抑制·OH的产生进而导致DMP降解率的降低。因此Fenton体系下DMP降解的最佳pH值为3.0。

(1)

(2)
2.4 响应面分析与比较
通过响应面模型分析计算,3种高级氧化技术降解DMP的最佳反应条件和最高降解率见表1。

表1 各工艺最佳反应条件和最高降解率Table 1 Optimum reaction conditions and maximum degradation rate of each process
由表1可知,经过响应面分析法优化后3种单独的高级氧化法对DMP的降解率由高至低仍为UV/H2O2(100%)>O3(88.73%)>Fenton(49.51%),这个顺序与单因素实验得到的结果是一致的。
2.5 成本分析与比较
在单因素实验得出的各个工艺最佳反应条件下,对3种高级氧化技术去除1 kg/m3DMP的成本进行了计算,其中所用药剂单价按市场价格计算,电费按0.5元/(kW·h)计算,结果见表2。
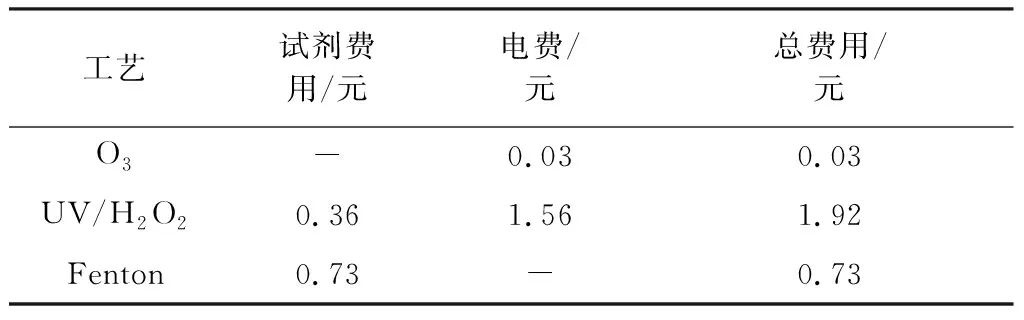
表2 各工艺去除1 kg/m3 DMP的成本计算Table 2 Cost calculation of each process for the removal of 1 kg/m3 DMP
由表2通过比较可知,去除1 kg/m3DMP的成本由高至低分别为:UV/H2O2(1.92元)>Fenton(0.73元)>O3(0.03元)。
3 结论
通过单因素实验研究了反应条件对O3氧化、UV/H2O2、Fenton法降解水中DMP的影响,并通过响应面优化分析,得出3种高级氧化法对DMP的降解效果依次为:UV/H2O2>O3>Fenton,同时对3种技术去除1 kg/m3DMP的成本进行了分析,由高至低分别为:UV/H2O2>Fenton>O3。综合考虑对DMP的降解率与经济成本,O3氧化法在去除含邻苯二甲酸酯的工业废水方面具有更大的应用前景。

