mNGS技术诊断11例人类免疫缺陷病毒相关进行性多灶性白质脑病及其临床特征☆
钱娟 黄锐 曹齐 张维 袁婧
进行性多灶性白质脑病(progressive multifocal leukoencephalopathy,PML)是一种由JC病毒感染导致的亚急性脱髓鞘疾病,于1958年首次报告[1]。好发于免疫功能低下人群,如人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染、恶性肿瘤、器官移植、使用免疫抑制剂等患者,致死率高,随着HIV全球流行,该病发病率逐渐升高[2]。PML起病隐匿,早期临床表现缺乏特异性,传统检测方法阳性率较低,可能造成疾病延误诊治。鉴于此,本研究回顾性分析了2019年1月至2021年6月重庆市公共卫生医疗救治中心经过脑脊液宏基因组二代测序(metagenomic next-generation sequencing,mNGS)确诊的11例HIV相关进行性多灶性白质脑病患者临床资料,探讨mNGS在PML诊断中的应用价值,并结合相关文献复习,旨在提高对该病认识,为临床诊疗提供帮助。
1 对象与方法
1.1 研究对象 研究对象为2019年1月至2021年6月重庆市公共卫生医疗救治中心收治的HIV相关进行性多灶性白质脑病住院患者。纳入标准:①患者均确诊HIV感染;②接受脑脊液mNGS技术检测;③诊断为PML。HIV诊断标准:HIV诊断符合《中国艾滋病诊疗指南》(2021版)[3],HIV抗体筛查试验阳性和抗体补充试验阳性。PML诊断:根据患者的临床表现、脑脊液常规、生化、典型头颅MRI表现、mNGS技术检测出脑脊液JC病毒基因序列。排除标准:感染HIV前已经存在明确的神经系统病变。本研究通过重庆市公共卫生医疗救治中心伦理委员会审核批准。
1.2 方法
1.2.1 样本采集 行腰椎穿刺术留取无菌脑脊液适量,采集后一管立即封口至-20℃冰箱冻存,冷链运输至广州赛哲生物科技股份有限公司进行高通量测序;其余送至我院检验科行常规和生化检测。
1.2.2 JC病毒测序方法及数据分析 脑脊液标本经过离心富集得到的样本富集液,使用微生物DNA提取试剂盒结合磁珠进行核酸提取与纯化,提取试剂盒采用MAGEN(中国广州)试剂盒,严格按照说明书进行操作。提取好的核酸按照标准流程进行宏基因组文库的构建,并以qPCR技术(Bio-Rad CFX96,USA)进行精准定量后,将加有不同index接头序列的文库等量混合,再运用Illumina Nextseq 550 DX测序平台进行高通量测序。测序数据经FastQC软件进行数据基本过滤后获得为Cleanreads数据,再与人类基因组参考序列(版本:GRCh38)进行对比,所用软件为BWA(Burrows-Wheeler Aligner),去除人类序列后,与经赛哲生物专属的病原微生物数据库进行比对分析,获得病原微生物的鉴定与定量结果。
1.2.3 资料收集 查阅住院电子病历系统,并对所有患者进行门诊及电话随访。整理收集艾滋病合并PML患者的性别、年龄、HIV感染途径、既往病史、合并感染情况、临床表现、实验室和影像学检查、治疗及预后等结果,总结其临床特征,同时复习相关文献。
2 结果
2.1 一般资料 共11例艾滋病合并PML患者符合入选标准,且患者均来自于重庆地区,编号1~11。其中男7例,女4例,年龄(45.9±10.9)岁。8例患者经异性性传播感染HIV,另外3例经同性性传播感染。CD4+T淋巴细胞计数的中位值为52(20~146)个/μL。除2例患者(病例3和10)确诊HIV感染数年一直未治疗外,其余患者均因此次入院才发现HIV感染。11例患者中有1例(病例8)合并重症肺孢子菌肺炎(pneumocystis pneumonia ,PCP),1例(病例2)合并口腔念珠菌感染及高血压病史,其余无合并感染及基础疾病。见表1。
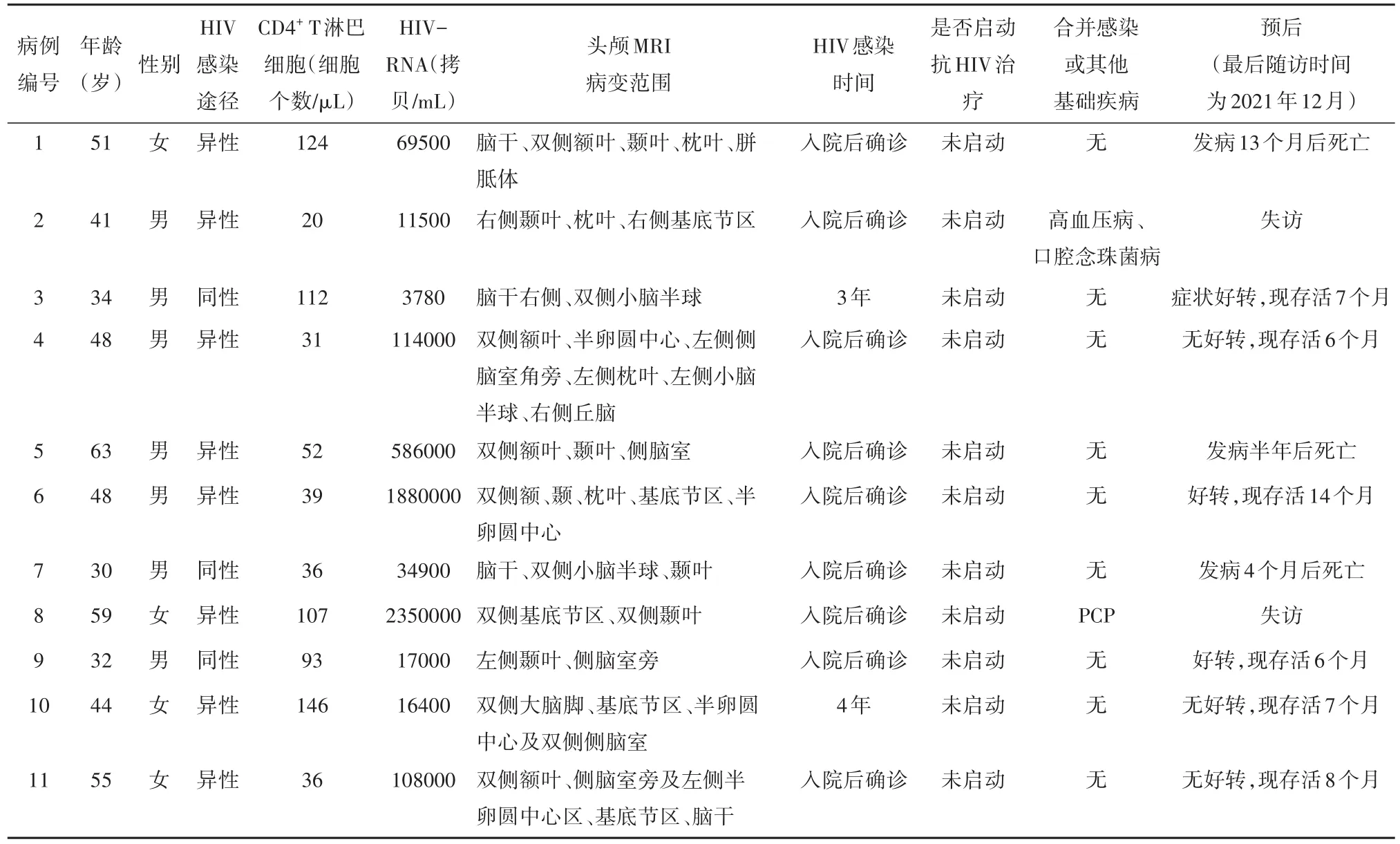
表1 患者基线资料
2.2 临床表现 11例HIV合并PML患者最常见的临床症状为肢体乏力、认知功能障碍和头晕,分别占10/11、8/11和5/11;而恶心、视物模糊、精神异常较少出现,仅占2/11、1/11和1/11,见表2。

表2 11例艾滋病合并PML患者的临床表现
2.3 头颅磁共振表现 11例HIV感染合并PML患者头颅磁共振均提示有广泛病变,病变范围包括脑干、双侧额叶、颞叶、枕叶、胼胝体、小脑半球、基底节区、半卵圆中心等,可见多发条片、斑片状异常信号。见图1。

图1 HIV感染合并PML患者的头颅MRI表现 A,双侧额顶叶内见多发斑片状、片状异常信号区,T2WI呈高信号影。B,左侧小脑半球多发斑片状异常信号,T2WI呈稍高信号。C,双侧半卵圆中心多发斑片状长T2信号影,FLAIR序列呈高信号影。D,左侧额顶叶、右侧半卵圆中心见片状及斑片状长T2信号影。
2.4 脑脊液检测结果 11例患者行腰椎穿刺术送检脑脊液检测, 2例患者测脑脊液压力升高,其余9例均正常;4例患者脑脊液蛋白质轻度增高,7例正常;2例脑脊液细胞数目轻度升高,9例正常;糖、氯化物均在正常范围内。见表3。
2.5 病原微生物基因检测结果 11例HIV感染合并PML患者脑脊液送检 mNGS,均检测出JC病毒,其序列数为1~467条不等。见表3。
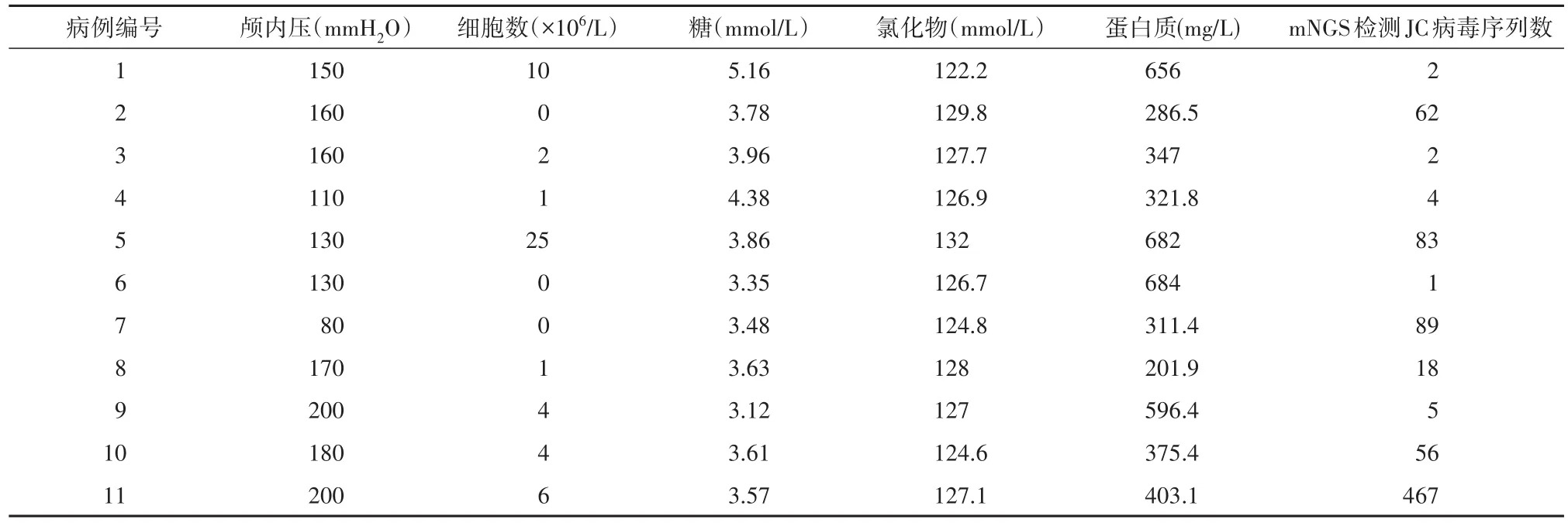
表3 脑脊液实验室检查结果
2.6 治疗及预后 入院后患者均接受抗HIV病毒治疗。病例8因合并重症肺孢子菌肺炎,故经抗PCP治疗2周后启动抗HIV治疗,其余患者一经确诊便立即开始高效抗逆转录病毒疗法(highly active antiroviral therapy,HARRT)治疗,7例患者使用拉米夫定/富马酸替诺福韦/多替拉维钠抗HIV,其余4例使用拉米夫定/富马酸替诺福韦/依非韦伦抗HIV治疗。同时给予营养支持、调节免疫力等治疗,对于肢体功能障碍者进行康复训练。至最后随访时间(2021年12月),11例患者中有6例存活,存活的患者中有3例(病例3、6、9)临床症状较入院时好转,3例(病例4、10、11)病情稳定;2例患者失访;3例死亡(病例1、5、7)。确诊PML至死亡时间为4~13个月。见表1。
3 讨论
JC病毒属于多瘤病毒科(polyomaviridae)中的一种,其基因组是一条无包膜闭合环状双链DNA分子,基因全长为5130 kb[4]。JC病毒最早于1971年在1例 PML 患者大脑中首次分离出来[5]。90%以上的人群在儿童期发生初次感染,此时一般无症状或轻微的呼吸道症状,随后病毒以潜伏状态存在于人体。当人体出现免疫抑制时,JC病毒发生激活并大量增殖,进而引发PML,但其致病机制目前尚不清楚。有文献[6]显示JC病毒主要使大脑中少突胶质细胞裂解破坏和进行性脱髓鞘,表现为严重的多节段髓鞘病变,故大脑白质中可分布多个病灶,包括脑干、基底神经节、丘脑、脑半球和小脑等。随着HIV流行,HIV患者PML发病率逐渐升高,PML在艾滋病中的发生率为1.0%~5.3%[7]。在HIV患者中,CD4+T淋巴细胞计数<200个/μL是PML的危险因素,但部分患者CD4+T淋巴细胞计数亦可高于200个/μL。某些病例显示PML可在HARRT治疗后被发现,这可能与免疫重建或者HARRT治疗失败有关[8]。
PML病理组织学的主要特征是JC病毒感染的少突胶质细胞,细胞核增大肿胀,其内具有病毒颗粒的集合,在光镜下可见包涵体和染色质结构的损失,最终导致细胞溶解,使得少突胶质细胞所支持的髓鞘破坏。部分研究发现,相邻皮质中的神经元也可能被病毒感染[8],可能是因为脱髓鞘导致轴突功能障碍,脱髓鞘的轴突更加容易受神经胶质细胞释放的细胞产物的伤害,轴突损伤又可导致神经元细胞体的逆行损伤,神经元的损伤可能是永久性的[7]。
PML通常起病隐匿,疾病早期症状通常不会引起患者的重视,大多数患者只有在认知或运动功能明显受损时才会就诊。其临床表现无特异性,与病变累及大脑的部位有关。大脑半球病变相关的临床特征是最常见的症状,超过50%的患者出现运动功能障碍[9]。本组11例患者中,肢体乏力、认知功能障碍、头晕最多见,与文献报道相符。本病呈亚急性起病,随病灶的扩大融合,患者的症状加剧并增多,后期神经损害症状更加突出,可导致残疾或死亡。
由于JC病毒主要感染少突胶质细胞和星形胶质细胞,导致皮层下白质广泛性脱髓鞘,呈现在颅脑MRI可显示出典型脑白质病变,因本质上是多灶性的,故大脑多个区域均可受累。典型PML病变呈双侧多发、非对称性分布,少数病变为单侧发病,双侧大脑半球、顶叶最易受累,其次是额叶,额顶叶受累,胼胝体受累也常见,脊髓受累少见[9]。病变早期在T1加权像呈低信号,在T2加权像和FLAIR像上显示出多个高信号强度病变,累及皮层下“U”形纤维呈“扇贝”形,由于很少或者没有炎症改变,通常增强扫描无占位效应,文献报告中有极少部分病变亦可累积大脑灰质[10]。本组病例中额叶、颞叶、枕叶、胼胝体、小脑半球、半卵圆中心、右侧丘脑、基底节区等部位均有病变,与文献报告一致。
脑脊液(CSF)检查对排除其他中枢性病变有较大帮助,细胞数目一般不超过20×106/L,部分病例脑脊液蛋白轻度升高,糖及氯化物基本正常。通过PCR技术检测脑脊液中的JC病毒DNA具有重要的诊断价值,PCR的敏感性为72%~92%,特异性为92%~100%[11-13]。但阴性结果并不排除PML,有可能因脑脊液中病毒量较低造成假阴性。另外有研究表明在无PML的正常人脑脊液中可检测到JC病毒,HAART治疗或者CD4较高情况下,PCR检测JC病毒的能力大大降低,可能会使实验室诊断变得困难,这对于开始接受HAART治疗但仍发展为PML患者进一步诊断提出新的挑战[11]。病变脑组织活检特异性为100%,可为确诊金标准,但此为有创性操作,临床实施较为困难,患者接受度较低。且脑脊液mNGS技术近年来广泛运用于各种病原菌检测中,可快速对DNA或RNA的碱基序列进行测序,对筛查中枢神经系统感染具有较高价值,可识别未知或罕见病原体,其快速、简便、特异度及灵敏度均较高。本组病例除检测出JC病毒外,均未检出其他病毒,再结合患者免疫缺陷、临床表现、MRI等典型表现,均可作出HIV相关性PML诊断。
当前没有针对PML的有效疗法,预后差,其中位生存期为6个月,发病1年后不到10%存活率[14]。就艾滋病而言,HARRT治疗是目前被证实的唯一有效治疗方法[15]。国外也有尝试于其他抗病毒药或免疫调节剂的研究,但均以失败告终。有研究或个案报告用阿糖胞苷经静脉或鞘内给药、多西福韦、托泊替康、干扰素-2β、米氮平对患者进行治疗,但均未能得到理想效果,相反,因其往往合并较多药物毒副反应,对患者总体预后无显著改善[16-19]。总之,自采用高效抗逆转录病毒疗法(HAART)以来,艾滋病合并PML患者的中位生存时间增加了,但存活的患者往往合并神经后遗症。本组研究中所有患者确诊PML后均给予HAART治疗,至最后随访截止日期生存时间最长为14个月,但存活患者中50%临床症状并未得到明显改善。有研究提出采用五联方案抗病毒治疗,生存期可能得到改善,可能优于传统三联HAART方案[20],但目前尚无更多证据支持。
自1971年JC病毒被发现以来,其引起的HIV相关PML受到了广泛关注,但对JC病毒的流行病学、发病机制、分子生物学以及PML的治疗方法的研究还不够深入。如今PML的发病率和死亡率逐年增高,而对JC病毒的快速检出,无论是对实验室进行基础研究还是临床上实现早期诊断都有重要意义,所以建立灵敏度高、特异性好的检测方法尤为重要,传统PCR法检测JC病毒存在局限性,而脑脊液mNGS能有效的检测出JC病毒,具有一定优势。目前无针对PML治疗的有效方法,预后差,有效的HARRT治疗可能改善患者预后。

