ADC 值改善少突胶质细胞肿瘤分级诊断效能的初步研究
杨海婷,蒋 健,周俊林
(兰州大学第二医院放射科 医学影像人工智能甘肃省国际科技合作基地,甘肃 兰州 730030)
少突胶质细胞肿瘤是成人颅内最常见的脑胶质瘤亚型之一,约占所有颅内肿瘤的2%~5%[1-2]。2021年WHO 中枢神经系统肿瘤分类将其分为少突胶质细胞瘤(Oligodendroglioma,OD,WHO 2 级)和间变性少突胶质细胞瘤(Anaplastic oligodendroglioma,AOD,WHO 3 级)[2]。少突胶质细胞肿瘤患者临床治疗方案及预后与其病理分级密切相关,OD 患者预后相对较好,而AOD 侵袭性较强,对化疗也更为敏感,术后常积极辅助放化疗以改善患者预后[3-4]。因此,术前准确评估少突胶质细胞肿瘤分级对患者治疗及预后评估具有重要意义。OD 和AOD 影像学表现部分交叉重叠,常规MRI 征象对于少突胶质细胞肿瘤分级诊断价值有限,由弥散加权成像(Diffusion weighted imaging,DWI)所衍生出的表观扩散系数值(Apparent diffusion coefficient,ADC),已广泛应用于脑胶质瘤的诊断、鉴别诊断及预后评估之中[5-7]。本研究拟比较不同分级少突胶质细胞肿瘤常规MRI 征象及ADC 值间差异,旨在探讨常规MRI 征象结合ADC 值对少突胶质细胞肿瘤分级的价值,为临床诊断及治疗提供参考依据。
1 资料与方法
1.1 一般资料
回顾性分析2014 年1 月—2022 年4 月兰州大学第二医院经病理证实的65 例少突胶质细胞肿瘤患者。其中OD 患者30 例(OD 组,WHO 2 级),男14 例,女16 例,年龄11~56 岁,平均(38.23±14.43)岁;AOD 患者35 例(AOD 组,WHO 3 级),男15 例,女20 例,年龄14~72 岁,平均(46.23±14.19)岁。所有患者术前均接受MRI 平扫、增强及DWI 扫描。本研究经兰州大学第二医院伦理委员会批准(批准号:2020A-070),所有患者均签署知情同意书。
1.2 仪器及方法
采用SiemensVerio 3.0T 超导扫描仪,患者取仰卧位,32 通道头线圈。扫描序列和参数:①快速自旋回波TSE-T1WI:TR 250 ms,TE 2.48 ms,FOV 22 cm×22 cm,矩阵256×256,层厚5 mm,层间距1.0 mm;②TSE-T2WI:TR 4 000 ms,TE 96 ms,FOV 22 cm×22 cm,矩阵256×256,层厚5 mm,层间距1.0 mm;③平面回波成像EPI 序列DWI:TR 4 500 ms,TE 102 ms,层厚5 mm,层间隔1.0 mm,矩阵256×256,b 值分别为0、1 000 s/mm2;④经肘静脉高压团注对比剂(Gd-DTPA)0.1 mmol/kg,流率3 mL/s,获得轴位、矢状位和冠状位T1WI 增强图像。
1.3 图像分析
由2 名具有10 年以上经验的神经影像诊断医师,对所有图像采用双盲法进行阅片,意见不一致时通过协商达成一致。评估的常规MRI 征象包括肿瘤部位、瘤周界面、跨越中线、坏死囊变、出血、瘤周水肿、强化程度;参考Liu 等[5]测量方法,避开肉眼可见的坏死囊变及出血区,在每个病灶所在的ADC 图像层面放置8~12 个大小为10~15 mm2的圆形感兴趣区(Region of interest,ROI),以获得肿瘤组织的最小ADC 值(ADCmin)、平均ADC 值(ADCmean),同时测量病灶对侧脑白质的ADCmean,用肿瘤ADCmean除以对侧脑白质的ADCmean以计算相对ADC 值(rADC)。根据肿瘤主体所在位置,将肿瘤定位于额叶、顶叶、颞叶、枕叶和其他;瘤周界面不清晰定义为≥1/3 瘤脑界面不清晰,且连续2 个以上层面;在轴位图像测量水肿边缘距肿瘤边缘间的最大间距,以2.0 cm 为临界值,将肿瘤水肿程度分为无/轻度水肿和中/重度水肿[6];依据肿瘤与海绵窦强化程度间差异,分为轻度强化(低于海绵窦)、中度强化(接近海绵窦但肿瘤内部结构可辨认)和重度强化(肿瘤内部结构不可辨认)[8]。
1.4 统计学分析
采用MedCalc 软件进行统计分析,P<0.05 认为差异有统计学意义。计数资料以例(%)表示,组间比较采用χ2检验,计量资料用均数±标准差表示,并使用独立样本t 检验进行组间差异性比较。使用二元Logistic 回归分析分别构建临床-常规MRI 征象模型和临床-常规MRI 征象-ADCmin模型。绘制受试者工作特征曲线(ROC)评估各参数对少突胶质细胞肿瘤分级诊断的效能。
2 结果
2.1 临床指标及常规MRI 征象比较
见表1。OD 组平均发病年龄明显小于AOD 组,组间差异有统计学意义((38.23±14.43)岁 vs.(46.23±14.19)岁,P=0.028);而两组性别间差异无统计学意义(P=0.399)。OD 组和AOD 组在瘤周界面、坏死囊变、瘤周水肿程度、强化程度间差异均具有统计学意义(P<0.05),AOD 患者更容易出现瘤周界面不清晰、坏死囊变、中/重度瘤周水肿和中度以上强化;而在肿瘤部位(P=0.934)、跨越中线(P=0.122)、出血(P=0.256)间差异均无统计学意义(图1,2)。
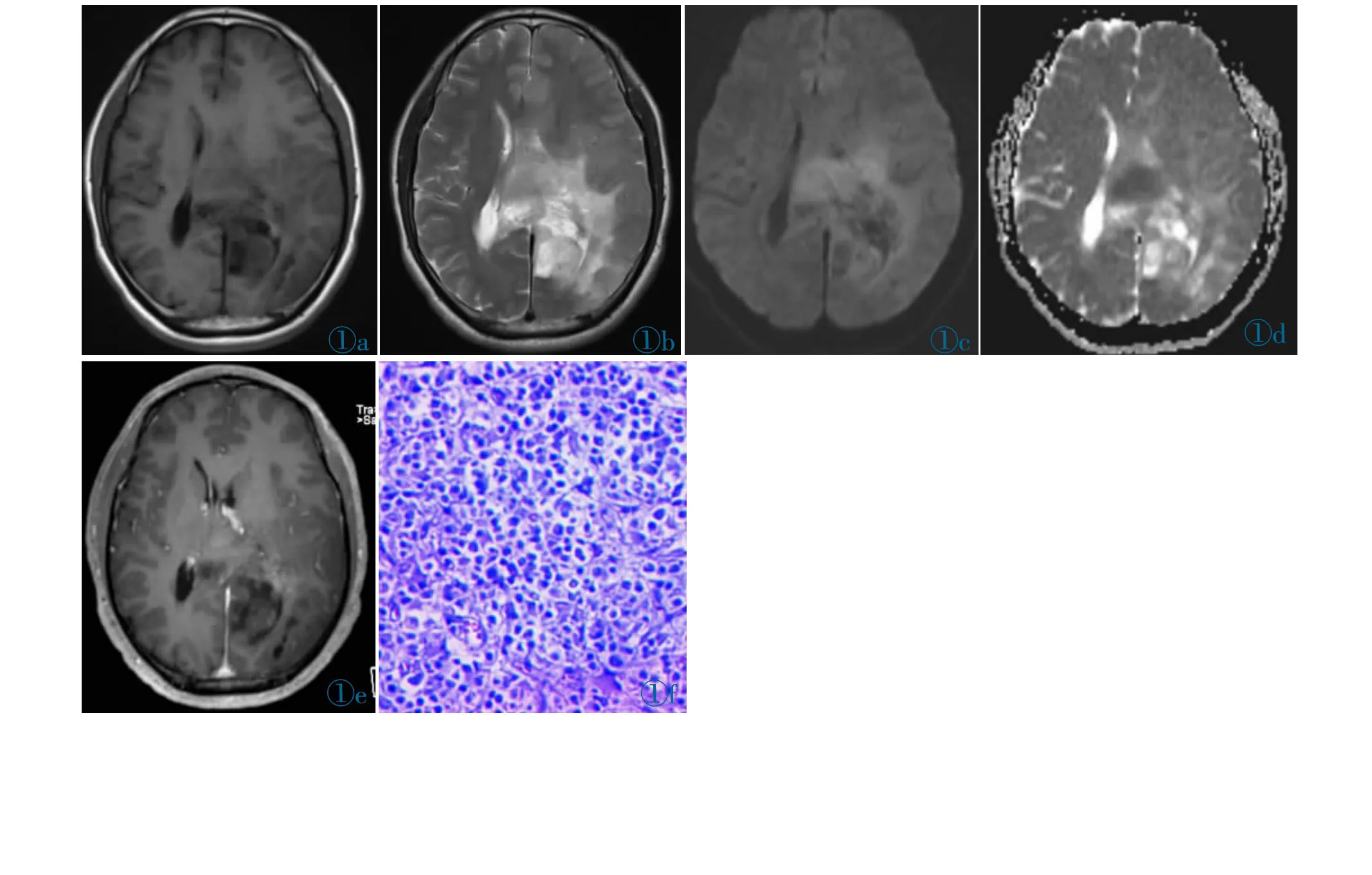
图1 男,46 岁,左侧枕叶OD。图1a 和1b 分别为轴位平扫T1WI 和T2WI 图像,示左侧枕叶跨中线生长的混杂信号占位,内可见囊变坏死,与周围组织分界不清晰,并可见中度水肿。图1c 和1d 分别为轴位DWI 和ADC 图像,病灶实性成分DWI 呈高信号,ADC 呈低信号。图1e 为增强T1WI 图,病灶呈不均匀性轻度强化。图1f 为病理图示瘤细胞呈片状排列,核大小较为一致、核轻度异型(HE)。Figure 1.Male,46 years old,OD in the left occipital lobe.Figure 1a and 1b show the axial T1WI and T2WI image,a mixed-signal lesion of the left occipital lobe growing across the midline,with visible cystic necrosis,poorly demarcated from surrounding tissue,and moderate edema.Figure 1c and 1d show the axial DWI and ADC image,the solid component of the lesion shows a high signal on DWI and a low signal on ADC.Figure 1e shows a contrast-enhanced T1WI image,and the lesion shows heterogeneous mild enhancement.Figure 1f shows the pathological image,the tumor cells are arranged in sheets,with relatively uniform nuclear size,and mild nuclear heterotypic(HE).
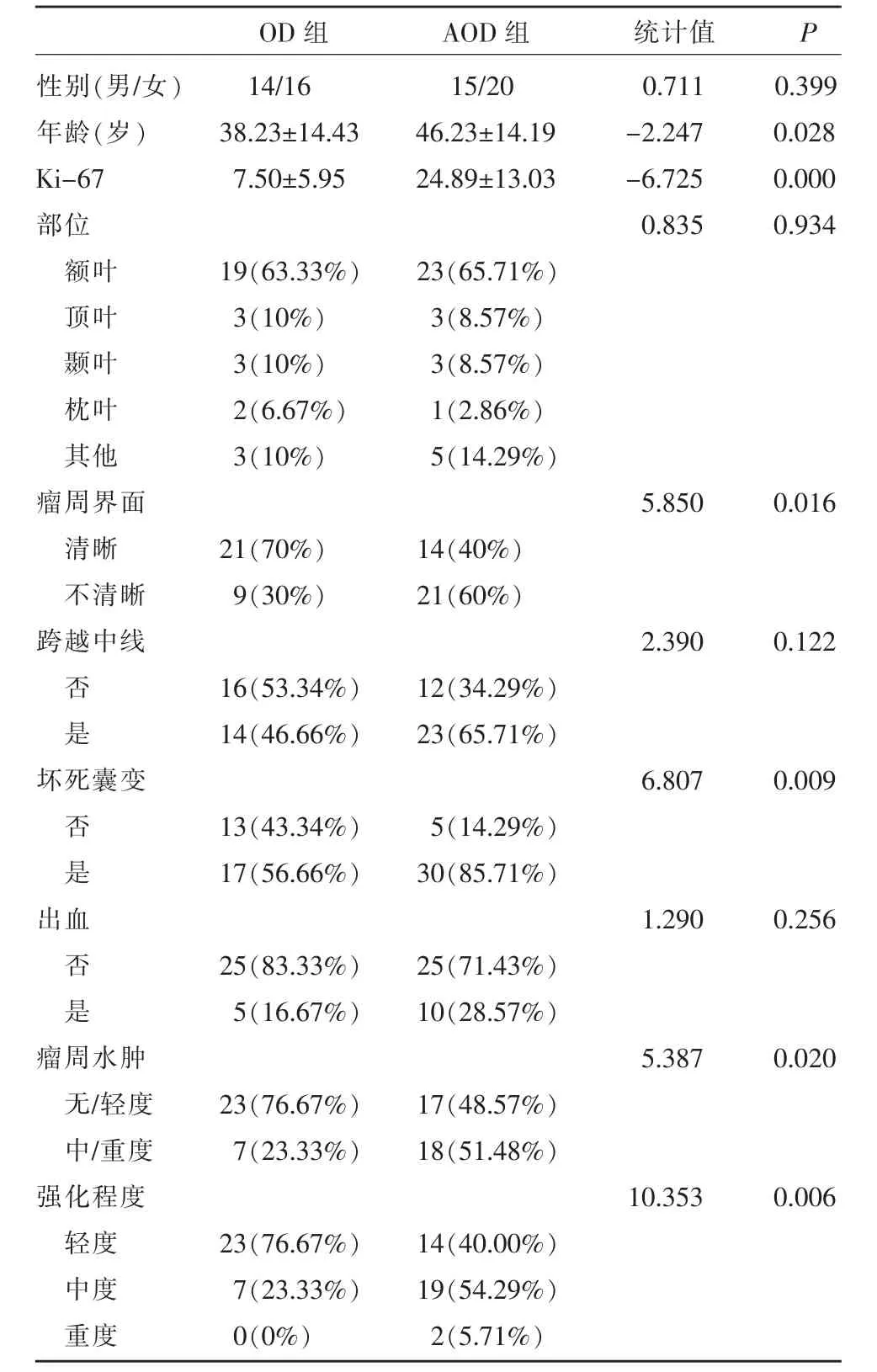
表1 OD 组和AOD 组主要临床指标及常规MRI 征象比较
2.2 ADC 值比较
OD 组和AOD 组间ADC 值间差异性比较见表2。OD 组 的ADCmin、ADCmean和rADC 均大于AOD组,组间差异均具有统计学意义(P<0.05)。
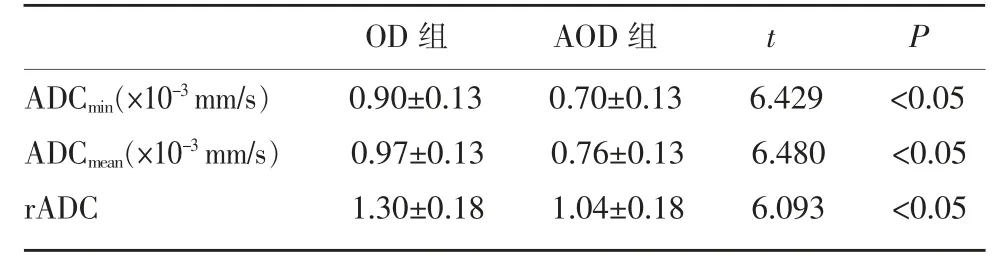
表2 OD 组和AOD 组ADC 值比较
2.3 ROC 曲线分析
ROC 曲线结果显示,ADCmin、ADCmean、rADC、临床-常规MRI 征象模型和临床-常规MRI 征象-ADCmin模型对于少突胶质细胞肿瘤均具有较高的分级诊断效能(表3)。ADC 值中,ADCmin分级效能最佳,以0.811×10-3mm/s 作为截止值,对应的AUC、敏感度、特异度、阳性预测值、阴性预测值和准确度分别 为 0.869、82.86%、76.67%、80.60%、79.30% 和80.00%(图3);临床-常规MRI 征象模型(包括年龄、瘤周界面、坏死囊变、瘤周水肿程度、强化程度)分级的AUC、敏感度、特异度、阳性预测值、阴性预测值和准确度分别为0.822、80.00%、70.00%、75.70%、75.00%和76.92%;而临床-常规MRI 征象-ADCmin模型(包括年龄、瘤周界面、坏死囊变、瘤周水肿程度、强化程度和ADCmin)的分级能力显著提高,分级的AUC、敏感度、特异度、阳性预测值、阴性预测值和准确度分别为0.907、88.57%、86.67%、88.60%、86.70%和87.69%(图4)。

图3 ADCmin、ADCmean、rADC 对少突胶质细胞肿瘤分级的ROC曲线,ADCmin 分级效能最优,AUC 值为0.869。Figure 3.The ROC curves of ADCmin,ADCmean,and rADC for oligodendroglial tumor grading,ADCmin grading performance is the best with an AUC value of 0.869.
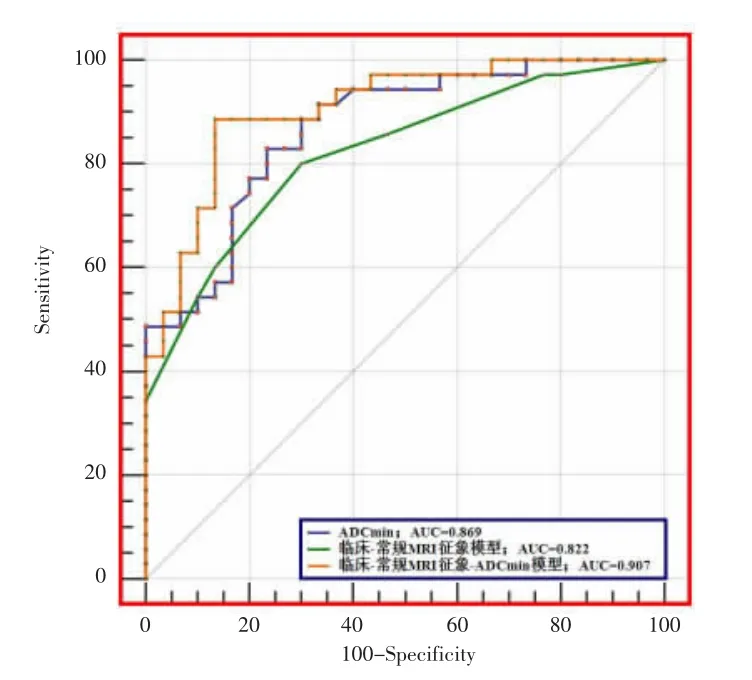
图4 ADCmin、临床-常规MRI 征象模型和临床-常规MRI 征象-ADCmin 模型对少突胶质细胞肿瘤分级的ROC 曲线,临床-常规MRI征象-ADCmin 模型分级效能最佳,AUC 值为0.907。Figure 4.The ROC curves of ADCmin,clinical-conventional MRI signs model,and clinical-conventional MRI signs-ADCmin model for oligodendroglial tumor grading.The clinical-conventional MRI signs-ADCmin model grading performance is the best with an AUC value of 0.907.
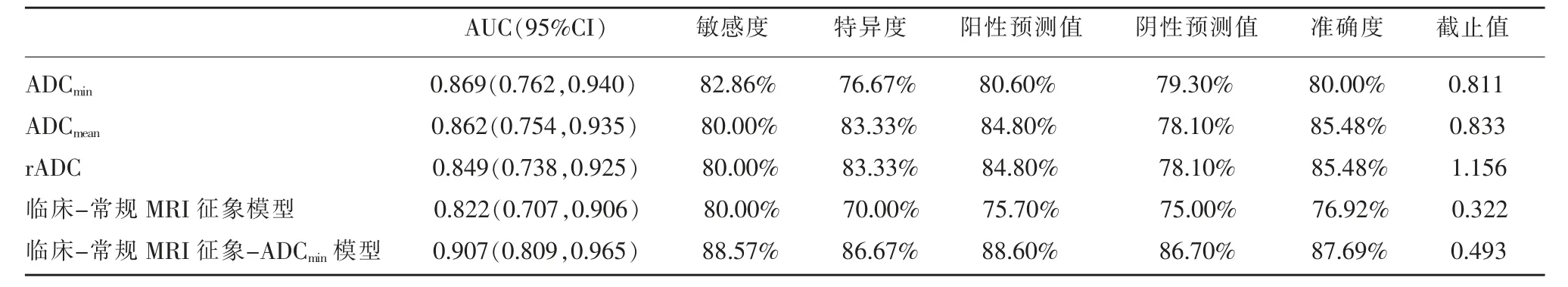
表3 不同参数对少突胶质细胞肿瘤分级诊断的ROC 曲线分析
3 讨论
不同分级少突胶质细胞肿瘤患者临床特征及影像学表现部分重叠,但其治疗方式及预后存在一定差异,故准确的术前分级对少突胶质细胞肿瘤患者的综合管理而言具有重要意义[9-10]。本研究结果表明常规MRI 征象结合ADC 值可有效提高对少突胶质细胞肿瘤分级诊断的准确性。
既往研究表明[11]少突胶质细胞肿瘤多见于中老年人,且AOD 患者发病年龄常大于OD,Zhang 等[3]回顾性分析51 例OD 和50 例AOD 患者的临床资料,结果显示OD 和AOD 平均发病年龄分别为38.7岁和47.1 岁,且两组性别间差异无统计学意义,与本研究结果相一致,故可以认为年龄是进行少突胶质细胞肿瘤分级时参考的重要临床指标之一。
本研究结果显示,常规MRI 征象中,AOD 更容易出现瘤周界面不清晰、坏死囊变、中/重度瘤周水肿和中度以上强化。瘤周界面不清晰病理学基础主要是由于增殖活跃的瘤细胞向周围组织浸润性生长所致,恶性程度较高的肿瘤,瘤细胞增殖活跃程度明显增高,也更容易浸润侵犯周围组织,因此瘤周界面不清晰也更容易出现[12],本研究中AOD 组瘤周界面不清晰发生率(60%)明显高于OD 组(30%),与病理学改变相符。既往研究表明[13]少突胶质细胞肿瘤瘤体内部较易出现坏死囊变,且AOD 坏死囊变更为多见,本研究中AOD 出现坏死囊变的比例(85.71%)明显高于OD(56.66%),推测原因,可能是由于AOD属于恶性程度较高的WHO 3 级肿瘤,瘤细胞增殖活跃,当滋养血管的血供不能满足瘤细胞生长需要时,就会导致瘤组织的相对性缺血,继而出现坏死囊变等表现。瘤周水肿程度对少突胶质细胞肿瘤分级具有重要意义[14-15],恶性程度较高的肿瘤,瘤周血脑屏障破坏程度也更为严重,瘤周水肿程度也会明显增加,本研究中AOD 组中/重度瘤周水肿率(51.48%)高于OD 组(23.33%),符合文献报道。肿瘤强化程度主要反映瘤体微血管密度及细胞增殖活跃程度,肿瘤恶性程度较高,肿瘤细胞数目和瘤周新生血管明显增多的同时,还会伴随新生血管结构和功能的改变,导致血管形态不规则、血管壁不完整和微血管通透性的增加,对比剂更容易进入肿瘤组织,从而表现为较高的强化程度[3,16-18],本研究中AOD 多表现为中度以上强化,而OD 以轻度强化为主,与文献报道相符。有学者研究表明[19]AOD 瘤体内更容易出现出血,本研究中OD 和AOD 间瘤体出血征象无明显差异,推测原因,可能与本研究纳入的样本量相对过少有关。此外,本研究还发现,不同分级少突胶质细胞肿瘤常规MRI 征象中的部位和跨越中线间差异均无统计学差异,与文献报道基本一致[13,19]。
DWI 作为MRI 功能成像技术之一,主要通过反映组织内水分子扩散运动的变化情况来提供有关肿瘤微环境的信息,由其所衍生出的ADC 值能对肿瘤进行简单有效的定量评估[20-21]。相关研究表明[22-23],肿瘤细胞的数量、体积、增殖速度和核异型性等均会随着肿瘤分级的增加而明显增加,恶性肿瘤细胞增殖活跃,导致肿瘤细胞数目增多,相对缺氧引起的细胞毒性水肿还会导致肿瘤细胞体积增大,细胞数目和体积的同步增加,减少了水分子内外运动的空间,多方面因素综合作用,最终引起ADC 值的降低。本研究结果显示AOD 组ADCmin、ADCmean和rADC 值均显著低于OD 组,与既往研究结果相一致[5,12]。殷敏敏等[12]对比7 例OD 和13 例AOD 间ADC 和rADC值间差异后发现,OD 组ADC 和rADC 值均明显大于AOD 组,与本研究结果相吻合。本研究还发现,在少突胶质细胞肿瘤分级时,ADC 值参数中,以ADCmin的分级诊断效能最佳,其区分OD 和AOD 的AUC、敏感度、特异度、阳性预测值、阴性预测值和准确度分别为0.869、82.86%、76.67%、80.60%、79.30%和80.00%,推测原因可能是由于ADCmin代表肿瘤组织内细胞增殖最活跃、肿瘤细胞最密集的区域,能最真实客观的反映肿瘤的恶性程度。有学者[24]使用不同ADC 值进行巨细胞型胶质母细胞瘤与胶质母细胞瘤的鉴别,结果发现ADCmin具有最佳的鉴别诊断效能,与本研究结果相仿,以上结果表明ADCmin或更有利于脑肿瘤的分级和鉴别诊断。
鉴于不同分级少突胶质细胞肿瘤临床指标、常规MRI 征象和ADC 值间均存在不同程度的差异,故本研究分别构建了临床-常规MRI 征象模型和临床-常规MRI 征象-ADCmin模型,以评估日常临床诊断工作时多种因素联合使用对不同分级少突胶质细胞肿瘤的分级评估效能,结果显示临床-常规MRI征象-ADCmin模型分级诊断效能最佳,其区分OD 和AOD 的AUC、敏感度、特异度、阳性预测值、阴性预测值和准确度分别为0.907、88.57%、86.67%、88.60%、86.70%和87.69%,提示在临床工作中综合考虑临床指标、常规MRI 征象,并结合ADC 值,能显著提高对少突胶质细胞肿瘤分级诊断的准确性。
本研究也存在一些不足之处,首先本研究所有病例均来自于单一中心,病例数也相对较少;其次只探讨了常规MRI 征象结合ADC 值对少突胶质细胞肿瘤的分级诊断效能,未结合其他MRI 定量参数,如PWI、DSC 等,未来将联合多个中心、扩大样本量并结合多种MRI 定量参数,对少突胶质细胞肿瘤分级进行进一步的研究。
综上所述,常规MRI 征象和ADC 值对于少突胶质细胞肿瘤分级均具有一定的价值,联合使用时可进一步提高对少突胶质细胞肿瘤的分级诊断效能,为患者临床治疗方案制定及预后评估提供参考依据。

