辛伐他汀联合阿司匹林防治缺血性脑血管病的效果及药学分析
谭 川
(达州市中西医结合医院药学科,四川 达州 635000)
ICVD是脑血管意外发生的症状,也是导致发生各种疾病和残疾的主要原因。近年来,脑血管疾病患者数量逐渐攀升,严重威胁着人们的身心健康,大部分患者在完成治疗之后存在预后差异问题,如何给予患者及时、高效的治疗,以提高预后效果是当前临床领域研究的课题之一。因而可知,脑血管病的治疗已成为迫切需要解决的ICVD基础问题,SIM可以刺激内皮细胞再生并增强内皮细胞的肌肉功能,预防动脉中的血块[1]。因此,它已经成为用于治疗脑血管疾病的药物,并且能够抑制巨噬细胞的活性,增加内皮介导的血管舒张,并保护内皮细胞最近的研究表明辛伐他汀(SIM)具有减弱作用[2]。阿司匹林(ASA)是一种具有双重抗菌活性的非特异性环氧化酶(COX)抑制剂,可以限制COX-1并抑制血栓烷A2的合成,介导血小板活化。COX-2抑制可以减少MMP和前列腺素的释放,减慢细胞外基质的降解,细胞迁移以及炎性化合物的合成[3]。内皮细胞释放的NO影响血管舒张:NO具有三种控制酶:e NOS,i NOS和n NOS ASA可以蛋白质乙酰化,目标是剩余的COX和赖氨酸酶,低浓度的ASA可以激活NOS赖氨酸乙酰化[4-5]。SIM以时间依赖性方式促进内皮细胞分泌NO,与降脂作用无关[6]。根据大量的研究试验结果表明,在耐药方面,ASA和他汀类药物的联合使用优于单独使用ASA或他汀类药物的效果。鉴于此,我院在2019年1月-2019年12月期间抽选120例ICVD患者为样本,讨论SIM药联合ASA药的临床效果,及对ICVD患者病情的影响。以下即是本次研究的详细内容。
1 资料与方法
1.1 一般资料
选取我院120例ICVD的患者(包括重症患者)。入选对象均为本院缺血性脑血管重症患者;患者家人均支持并自愿加入此研究;符合本院医学伦理委员会标准者;临床资料完整者。剔除认知功能及精神功能障碍者、癌症患者;肾脏、肝脏功能存在严重病变者;凝血功能异常者。随机分为对照组和观察组,对照组60例,男性30例,女性30例,年龄介于35到67岁范围,中位年龄(50.32±3.22)岁;病发至入院时间为0.6h到4h,均值(2.15±0.36)h;体质量介于52.6至78.9kg,均值(65.42±3.12)kg;体质指数17.2到33.1kg/m2,均值(25.34±1.67)kg/m2;观察组60例,男性29例,女性31例,年龄介于35到68岁范围,中位年龄(50.44±2.54)岁;病发至入院时间为0.6h到4h,均值(2.18±0.33)h;体质量介于52.8至78.3kg,均值(65.45±3.29)kg;体质指数17.5到33.2kg/m2,均值(25.39±1.62)kg/m2。两组基础资料无统计学差异,P>0.05。
1.2 方法
对照组接受口服ASA(拜耳医药生产,100mg/片,国药准字HJ20160685);观察组接受口服ASA和SIM(SIM药由上海信谊万象药业生产,10mg/片,国药准字H19980054);观察组中接受ASA和SIM治疗的患者均接受其他方式的治疗。两组患者单独或联合口服该药物,并接受了8周的治疗。
1.3 观察指标
(1)不同浓度的SIM和/或ASA对LPS诱导的HUVEC中IL-6,IL-8,VCAM-1,ICAM-1和e NOS mRNA表达的影响。
(2)中国医院标准为:IL-6,IL-8,VCAM-1和ICAM-1 mRNA表达改善程度为90%即显效;IL-6,IL-8,VCAM-1和ICAM-1 mRNA表达改善且评分降低60-80%为有效;无效即IL-6,IL-8,VCAM-1和ICAM-1 mRNA表达改善程度少于60%或更少且治疗前后无明显变化;总有效率为显效百分比与有效百分比之和。
(3)治疗一年后,对两组患者进行了随访,以观察心肌梗塞,短暂性缺血和复发性缺血性脑血管疾病的发生率。
1.4 统计学方法
2 结果
2.1 分析不同浓度下细胞因子和基因表达的影响
在三种不同的SIM浓度下,IL-6,IL-8,VCAM-1和ICAM-1 mRNA表达的HUVEC值增加(P<0.05)。在所有药物干预组中,单独使用或与两种药物联合使用的辛伐他汀和ASA均可调节IL-6,VCAM-1和ICAM-1 mRNA的表达(P<0.05)。与SIM(1.10μmol/ L)和ASA(1.2.5 mmol / L)组相比,它可以有效地减少IL-6 mRNA表达的调节。(详见图1、图2)。
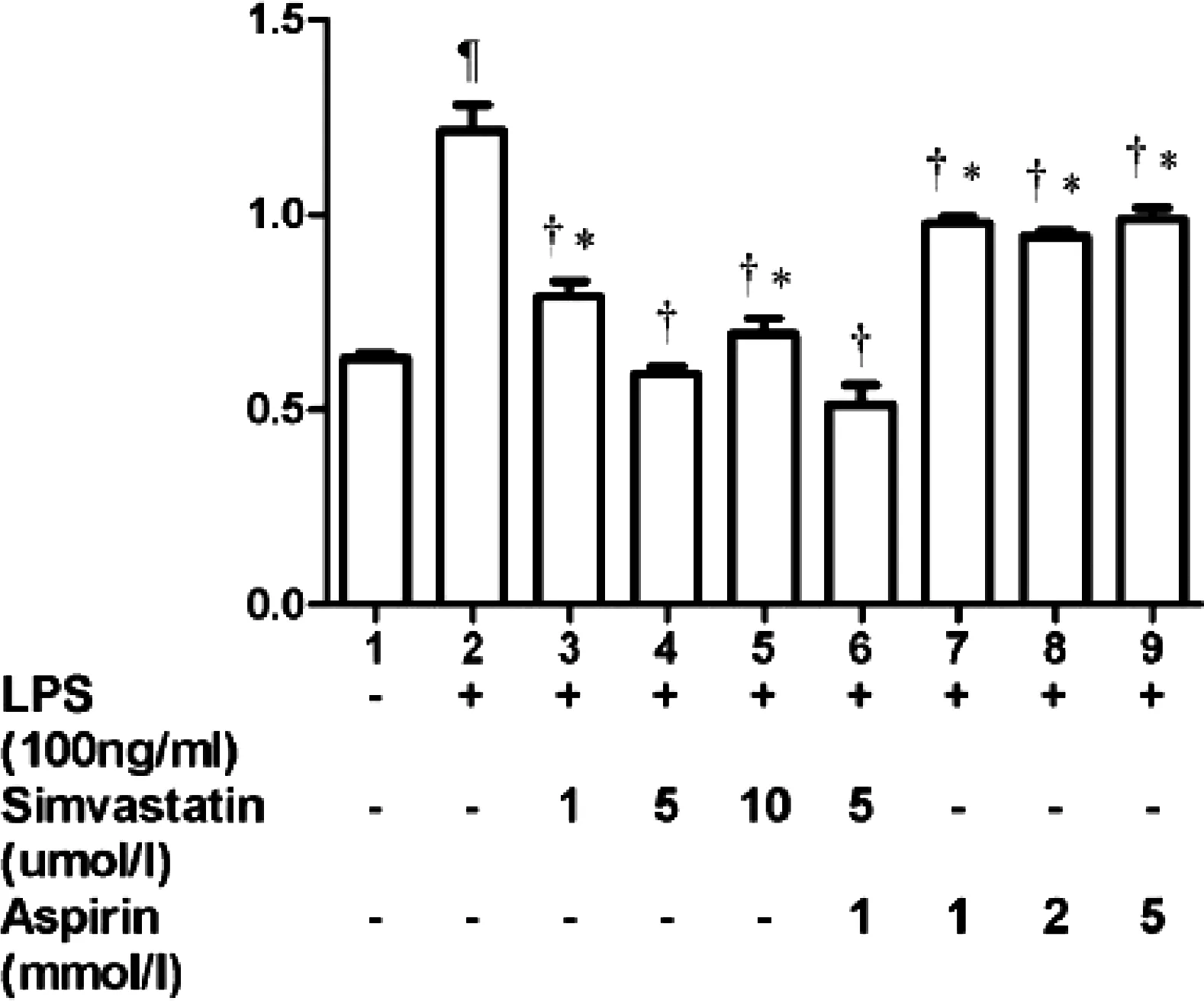
图1 不同浓度SIM和/或ASA 诱导的 VCAM-1 m RNA 表达
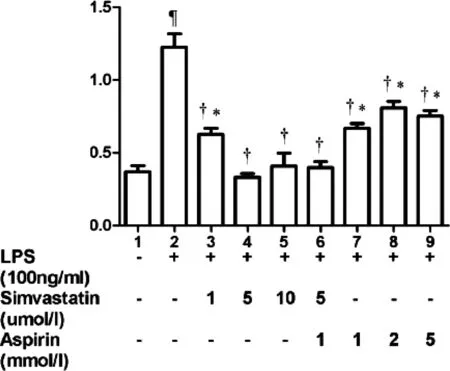
图2 不同浓度SIM和/或ASA干预的 VCAM-1 m RNA 表达
2.2 短期疗效
总效率观察组优于对照组,如表1所示。

表1 短期效果分析表[(n)%]
2.3 远期疗效
两组在治疗1年后随访,比较脑梗死或TIA以及心肌梗死的再发情况,脑出血以及患者死亡情况,详见表2。

表2 远期疗效表[(n)%]
3 讨论
缺血性脑血管病即脑部供血能力出现异常,从而产生坏死、变性等现象的脑血管病,属于神经系统疾病的一种,以抽搐、意识障碍、语言障碍、肢体麻木、呕吐等为常见临床表现,导致其发生的原因与血液流变学异常、心脏疾病等存在相关性[7]。根据大量临床试验表明,ICVD是临床试验中最常见的心血管疾病,在中年人和老年人中最常见,且疾病发生后,患者的肢体活动能力、日常生活能力等严重降低,及时运用高效治疗方案有保护患者生命作用[8-9]。控制脑血管疾病的存在是预防和减少发病率的关键。在很多试验中发现ICVD早期治疗具有重要意义,即能够减轻神经功能缺损程度,促使患者预后结局得到改善,这对于提高患者生活自理能力,提升生活质量有积极影响。
药物治疗方案在ICVD患者中较常使用,其中,ASA药物、SIM药物为常用药,ASA药为抗血小板药物之一,较常在心肌梗死、ICVD中使用,这是因为,此药物对血小板凝聚反应有较好疗效,且可以阻止血栓形成,其作用机制即对前列腺素环氧酶发挥抑制,继而发挥中止血小板聚集作用的药物,具有不可逆性特点[10]。SIM药对机体循环系统有改善作用,对血脂有调节效果,对动脉粥样硬化有抵抗疗效,且还可以抑制HMG辅酶A还原酶,继而阻止机体合成内源性的胆固醇,属于血脂调节剂药物的一种,能够高度选择肝脏,于其内的浓度较高,机体肝脏可吸收大量SIM药效,而后经胆汁排出体外;大部SIM药结合血浆蛋白,是疗效确切的药物[11]。临床在冠心病、心肌梗死、ICVD等疾病的治疗中均有使用,能够缓解病情。将ASA、SIM药同时运用,并用于治疗ICVD患者后,取得了优质成效,说明将此两种药物联合使用能够促进临床疗效,继而对患者病情进行治疗,减轻患者神经功能缺损病情,对保障患者拥有良好预后提供促进作用。研究中ASA于SIM的联合服用转归优于ASA或SIM单独使用(P<0.05),表明ASA和SIM联合使用更具优势,主要是由于抑制血小板凝集。SIM的血液凝固能力可以消除炎症并降低血脂[12]。使用双重组合可改善患者状况。此外,观察组心肌梗死,缺血性改变和复发性缺血性卒中的发生率低于对照组(P<0.05):治疗时间短,同时使用两种药物可以减少脑血管疾病的发生;作为环氧合酶抑制剂,ASA可以通过功能乙酰化丝氨酸,降低氧合酶对血栓烷2(TXA2)生物合成的抑制作用的加氧酶1 529是重要的血小板活化剂。因此,ASA可用于治疗ICVD。观察组加入SIM后,疗效优于对照组。尽管SIM可以减少脂肪沉积,但是SIM也可以提高内皮细胞的血管强度,增加内皮细胞溶解纤维蛋白和修复斑块的能力[13]。动脉粥样硬化,无论是附近的血管肌细胞还是血小板聚集,均可可以降低黏度,具有较好的治疗作用。更多临床应用预防和减少脑血管意外的关键是控制脑血管意外的危险因素,所有非心血管缺血性卒中患者都可以使用减脂疗法[14]。作为TIA抑制剂,环氧合酶1(ASA)可以乙酰化环氧合酶1中丝氨酸529的羟基,从而降低环氧化酶的生物活性。并且抑制血栓烷2(TXA2)的合成,TXA2的合成是血小板活化,抑制TXA2的合成和释放,抑制血栓形成的重要手段;因此,ASA可用于治疗ICVD[15]。SIM可以增加内皮细胞的血管运动,提高内皮细胞溶解纤维蛋白和稳定血管的能力,并阻止内皮细胞的增殖。血管平滑肌细胞和血小板聚集它可以降低循环液的黏度并具有良好的治疗效果,短期内同时使用SIM和ASA可能具有较好的治疗效果[16-17]。
综上所述,这项研究比较了SIM和ASA在ICVD治疗中单独使用或联合使用的应用效果和作用机制[11]。通过PI3K / Akt得出的基线与单独使用ASA相比,同时使用SIM和ASA可能在抑制炎症因子的表达和调节合成物的表达方面更为有效[12]。与单独使用SIM相比,e NOS可能与PI3K / Akt途径有关[13]。ASA的抗炎活性更高。SIM与ASA联用相比具有更强的抗炎作用[14]。

