广谱性识别H7 亚型禽流感病毒HA 蛋白的单克隆抗体制备与鉴定
王 勋,李 鸽,李青梅,吕镕州,孟泽锟,柴书军,杨继飞,郭军庆,张改平,4
(1. 河南农业大学 动物医学院,河南 郑州 450002;2. 河南省农业科学院 动物免疫学重点实验室,河南 郑州 450002;3. 西北农林科技大学 动物医学院,陕西 杨凌 712100;4. 扬州大学 江苏高校动物重要疫病与人兽共患病防控协同创新中心,江苏 扬州 225009)
禽流感病毒(Influenza virus,AIV)属于正黏病毒科(Orthomyxoviridae)流感病毒属(Influenza virus genus),部分亚型可引起人畜共患病[1-3]。2013 年,我国首次在上海和安徽出现人感染H7N9 的病例,2016-2017 年的第五波大流行中感染病例数最多,在一些H7N9 亚型禽流感病毒中检测到突变,这标志着一种新的高致病性禽流感病毒(HPAIV)出现[4-6],导致家禽发病率和死亡率增加,这种高致病性H7N9 病毒严重威胁着公众健康[7]。在我国农业农村部2020 年7 月发布的第314 号公告中,制定了4 种禽流感病毒(H5+H7)三价灭活疫苗的产品制造及检验试行规程、质量标准等。此次的疫苗更新主要是针对H7 亚型毒株的变异,由H7-Re2 抗原株变更为H7-Re3 抗原株,毒株的更新代表着禽流感病毒的快速变异[8-10]。流感病毒为单股负链RNA 病毒,编码8个不同的基因,以HA基因和NA基因的变异最为显著,由点突变引起的抗原漂移和不同毒株之间的基因重组引起的抗原转变是流感病毒实现快速变异的主要机制[11]。因此,病毒的快速、高度变异对流感的防控带来了挑战。
面对快速变异的H7N9 亚型禽流感病毒,快速检测技术也需要随之更新,以便对新变异的病毒实现快速识别并清除。单克隆抗体具有结构均一、特异性强、纯度高、效价高和交叉反应少等优点,被用于疫苗的生产、抗原的纯化和免疫学的基础研究,在病原检测和疾病诊断防治等方面也发挥了重要作用[12-16]。前期研制基于HA 蛋白单克隆抗体的H7亚型AIV 胶体金快速检测试纸可以实现对H7-Re2抗原株的检测,但无法检测到H7-Re3 抗原株[12]。而H7-Re3 变异株的出现使现有的基于单克隆抗体的抗原胶体金快速检测方法受限,因此,制备出广谱性识别H7N9 亚型禽流感病毒HA 蛋白的单克隆抗体迫在眉睫。鉴于此,将采用差速离心法纯化的H7N9(A/Chicken/Guangdong/SW154/2015)毒株鸡胚尿囊液作为免疫原免疫BALB/c小鼠,通过基于H7-Re3 变异株的血凝抑制试验(HI)、免疫过氧化物酶单层细胞试验(IPMA)和间接ELISA 方法对杂交瘤细胞株进行筛选,以期制备并鉴定特异性强、效价高和稳定性好的广谱性识别H7N9 亚型AIV HA 蛋白的单克隆抗体,旨在为H7 亚型禽流感病毒的快速检测提供技术支持。
1 材料和方法
1.1 供试动物、细胞系和毒株
SPF 级6~8 周龄雌性BALB/c 小鼠购自济南朋悦实验动物繁殖有限公司;SPF 级鸡胚购自北京勃林格殷格翰维通生物技术有限公司;所有H7N9 病毒试验均在华南农业大学生物安全三级(BSL-3)实验室进行;犬肾细胞(MDCK)和小鼠骨髓瘤细胞(SP2/0)由河南省农业科学院动物免疫学重点实验室保存;所有H7N9毒株均由华南农业大学提供;鸡新城疫病毒(NDV)由河南省农业科学院动物免疫学重点实验室保存;H7-Re2 和H7-Re3 抗原株由中国农业科学院哈尔滨兽医研究所馈赠。
1.2 主要试剂
HAT、HT 和融合剂PEG 1500 均购自Sigma 公司;HA 重组蛋白A/Anhui/1/2013(H7N9)购自Sino Biological 公司;小鼠阳性血清和阴性血清均由河南省农业科学院动物免疫学重点实验室保存;弗氏佐剂、羊抗鸡酶标二抗和羊抗鼠酶标二抗购自Jackson公司;鼠单克隆抗体亚型鉴定试剂盒购自Proteintech Group 公司;预染蛋白质分子质量标准、DMEM培养基和1640培养基购自北京索莱宝生物科技有限公司;胎牛血清购自Gibco公司。
1.3 H7N9亚型AIV的增殖和纯化
将 H7N9 亚 型 AIV(A/Chicken/Guangdong/SW154/2015)用无菌PBS 1∶1 000稀释,取0.1 mL接种于9~11 日龄SPF 鸡胚尿囊腔,在37 ℃孵化箱培养24~72 h,无菌收取尿囊液后,通过血凝(HA)试验测定其HA 效价,同时应用Reed-Muench 方法测定病毒尿囊液对MDCK 细胞的半数细胞感染量(TCID50)。将收集得到的病毒尿囊液用β-丙内酯灭活后采取差速离心法纯化,纯化后的病毒用BCA法测定蛋白质浓度,分装后保存于-80 ℃备用。
1.4 动物免疫
随机选取5 只6~8 周龄雌性BALB/c 小鼠进行免疫,免疫剂量为50 µg/只。首次免疫将H7N9 纯化病毒与等体积的弗氏完全佐剂混合乳化,进行颈背部皮下多点注射。在首次免疫后的第14、28天用弗氏不完全佐剂代替弗氏完全佐剂,采用与首免相同的方式对小鼠进行二免和三免。采用ELISA 方法对免疫小鼠血清的抗体滴度进行评估,选取效价最高的小鼠直接腹腔注射100µg的H7N9纯化病毒进行加强免疫,在3 d 后对加强免疫的小鼠进行采血,留血清作为阳性血清备用,并进行细胞融合。
1.5 细胞融合和阳性杂交瘤细胞株的筛选
无菌取出小鼠脾脏,研磨分离成单个脾细胞,与SP2/0细胞进行融合。用HAT培养基对融合细胞进行选择性培养7~10 d,取细胞上清,采用HI、IPMA 和间接ELISA 方法筛选阳性克隆,阳性孔细胞以有限稀释法进行亚克隆,建立稳定分泌抗H7N9 AIV HA蛋白单克隆抗体的杂交瘤细胞株。
1.6 腹水制备
以体内诱生腹水法制备抗H7N9 AIV 单克隆抗体,将(2~5)×106个细胞经腹腔注射弗氏不完全佐剂致敏的BALB/c 经产母鼠,7~10 d 后抽取小鼠腹水,通过HI试验和ELISA方法测定腹水的抗体效价。
1.7 单克隆抗体鉴定
1.7.1 HA 和HI 试 验 用PBS 将H7-Re3 抗原 株进行2 倍梯度稀释,加入96 孔V 形微量反应板中(50µL/孔),每孔加入等量0.5%鸡红细胞,室温静置30 min 后测定其HA 效价。将收集到的杂交瘤细胞上清原液,与4 个HA 单位的H7-Re3 抗原株混合。将抗体-病毒混合物在室温下孵育30 min 后与0.5%鸡红细胞混合。室温孵育30 min,观察红细胞凝集,以100%抑制凝集的最大稀释度为腹水HI效价。
1.7.2 间接ELISA 将HA 重组蛋白A/Anhui/1/2013(H7N9)用碳酸盐缓冲液(CBS)稀释至1µg/mL后,包被至96 孔板中(50 µL/孔),37 ℃静置孵育2 h,用PBST 洗5 遍;用含5%脱脂奶粉的封闭液于37 ℃静置封闭1 h,用PBST 洗5 遍;加入50µL 杂交瘤细胞上清,37 ℃静置孵育30 min,用PBST洗5遍;加入羊抗鼠酶标二抗,37 ℃静置孵育30 min 后,用PBST 洗5 遍;加入单组分TMB 显色液,室温显色10 min;加入终止液终止显色,用酶标仪读取每孔的OD450nm。
1.7.3 IPMA 试验 在96 孔细胞板中培养MDCK 细胞 至 密 度 为70%~90%,接 种H7N9(A/Chicken/Guangdong/SW154/2015)毒株,感染24 h 后弃培养上清,每孔加入预冷的无水乙醇室温固定10~15 min,用PBST 洗5遍;用含5%脱脂奶粉的封闭液37 ℃静置封闭1 h,用PBST 洗5 遍;加入待检抗体37 ℃静置孵育1 h,用PBST洗5遍;加入羊抗鼠酶标二抗37 ℃静置孵育1 h,用PBST洗5遍;加入AEC显色液室温显色10 min,在显微镜下观察显色情况。
1.7.4 亚型鉴定 用小鼠单克隆抗体亚型鉴定试剂盒对收集的杂交瘤细胞培养上清进行亚型鉴定,具体步骤参照试剂盒说明书。
1.7.5 IPMA 鉴定单克隆抗体特异性 按照1.7.3中的IPMA 方法检测单克隆抗体与H1N1、H3N2、H5N1、H7N9 和H9N2 亚型流感病毒的反应性。在培养MDCK 细胞的96 孔板中分别接种不同亚型毒株(表1),通过显色情况判断抗体反应的特异性。

表1 不同亚型流感病毒Tab.1 Different subtypes of influenza virus
1.7.6 广谱性鉴定 将不同株的H7亚型AIV(表2)感染MDCK 细胞,用IPMA 方法检测单克隆抗体与不同年份分离出来的H7亚型AIV的广谱反应性。
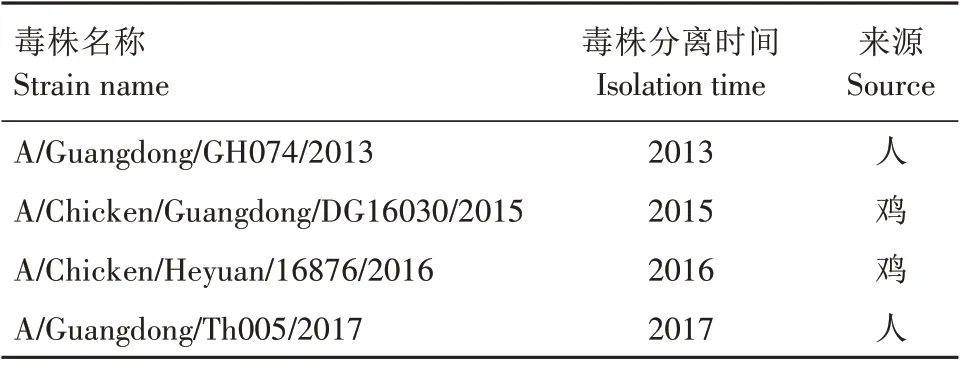
表2 不同年份分离的H7N9亚型流感病毒Tab.2 H7N9 subtype influenza virus isolated in different years
1.7.7 中和活性鉴定 按照1.7.3 中IPMA 方法,将单克隆抗体上清(以小鼠阳性血清为阳性对照,1 640 培养基为阴性对照)与100 TCID50H7N9 AIV混合,37 ℃反应1 h 后将病毒-抗体复合物感染MDCK 细胞,感染24 h 后,加入鸡H7N9 阳性血清(1∶500 稀释)作为一抗,HRP 标记的山羊抗鸡抗体作为二抗;加入AEC 显色液室温显色10 min,在显微镜下观察显色,检测单克隆抗体的中和活性。
1.7.8 与H7-Re2 和H7-Re3 反应性鉴定 用Dot blot 鉴定抗体与H7-Re2 和H7-Re3 反应性,具体操作:将H7-Re2、H7-Re3 抗原株和鸡新城疫病毒(NDV)依次各取2 µL,点印在6 张硝酸纤维素膜(NC)上;用含5%脱脂奶粉的封闭液在37 ℃恒温箱静置封闭2 h,用PBST 洗5 遍;分别加入5 株杂交瘤细胞上清作为一抗37 ℃反应30 min,用PBST 洗5遍;加入羊抗鼠酶标二抗,37 ℃孵育30 min,用PBST洗5遍后,用ECL显影液进行结果鉴定。
1.7.9 Western blot 检测 将HA 重组蛋白A/Anhui/1/2013(H7N9)和SDS-PAGE 上样缓冲液混合,煮沸15 min,进行SDS-PAGE 凝胶电泳,并转印至硝酸纤维素膜,用含5%脱脂奶粉的封闭液在37 ℃恒温箱静置封闭2 h,分别以5 株杂交瘤细胞上清作为一抗,用羊抗鼠酶标二抗孵育后进行检测。
2 结果与分析
2.1 H7N9亚型AIV的纯化结果
经Reed-Muench 法测定A/Chicken/Guangdong/SW154/2015毒株的TCID50为10-5.9/0.1 mL,鸡胚尿囊液的HA 效价为8 log2,经差速离心法纯化得到的蛋白质质量浓度为8 mg/mL。
2.2 抗H7N9 AIV HA蛋白杂交瘤细胞株筛选
采用有限稀释法对融合细胞进行3次连续亚克隆,筛选阳性杂交瘤细胞,通过HI、IPMA 和ELISA方法筛选获得了能稳定分泌抗体的5个杂交瘤细胞株。IPMA 单克隆抗体检测方法的结果如图1所示,5 株杂交瘤细胞上清(图1A—1E)和小鼠阳性血清(图1F)能够检测到在H7N9 AIV 感染的MDCK 细胞中与病毒特异性结合,结果呈阳性。小鼠阴性血清不与H7N9 AIV 感染的MDCK 细胞反应,结果呈阴性(图1G)。
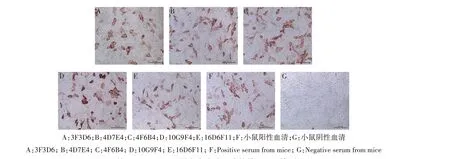
图1 抗H7N9 AIV HA蛋白杂交瘤细胞株的IPMA检测结果Fig.1 IPMA detection results of anti-H7N9 AIV HA protein hybridoma cell lines
2.3 抗H7N9 AIV HA蛋白单克隆抗体特性鉴定
2.3.1 间接ELSIA效价测定 通过间接ELISA测得5株杂交瘤细胞株诱导小鼠产生的腹水效价均为1∶1 000 000(表3)。
2.3.2 亚型鉴定 通过鼠单克隆抗体亚型鉴定试剂盒鉴定结果显示,4株单克隆抗体的重链为IgG1,1 株单克隆抗体的重链为IgG2b,5 株单克隆抗体的轻链均为κ链(表3)。
2.3.3 HI 效价测定 通过HI 试验测得5 株杂交瘤细胞株诱导小鼠产生的腹水针对H7-Re3 抗原株的HI效价均在7 log2~12 log2(表3)。
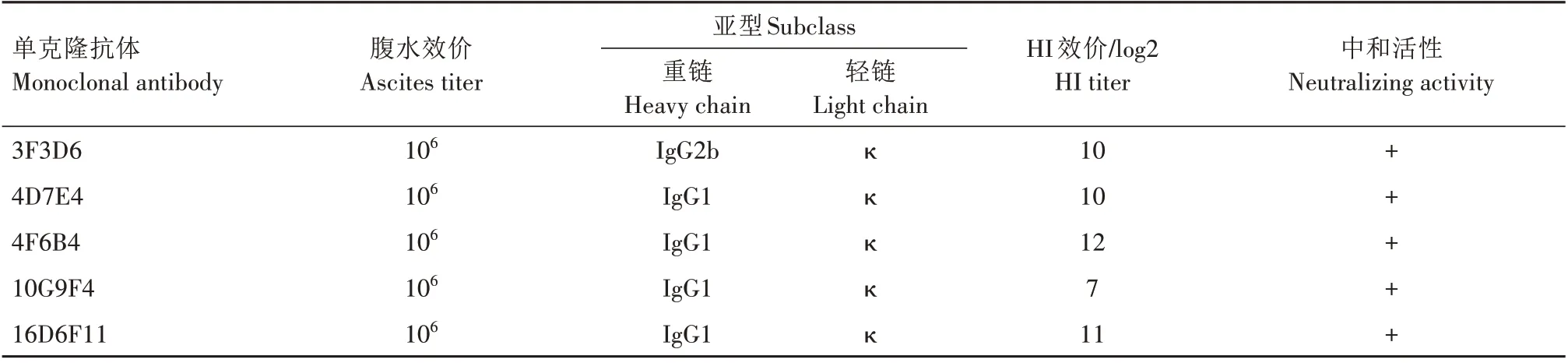
表3 单克隆抗体特性鉴定Tab.3 Monoclonal antibody characterization
2.3.4 特异性鉴定 IPMA 检测结果显示,5 株单克隆抗体只与H7 亚型AIV 发生反应,与表1 所示的H1N1、H3N2、H5N1和H9N2亚型AIV不反应(图2),具有较好的特异性。
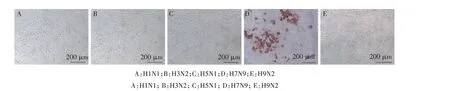
图2 抗H7N9 AIV HA蛋白单克隆抗体特异性鉴定Fig.2 Specific identification of anti-H7N9 AIV HA protein mAbs
2.3.5 中和活性鉴定 通过IPMA 方法对5 株杂交瘤细胞上清进行中和活性的测定,结果显示,检测孔(图3A—E)中感染细胞数小于阴性对照孔(图3G),证明5 株抗H7N9 AIV HA 蛋白单克隆抗体均具有中和活性。
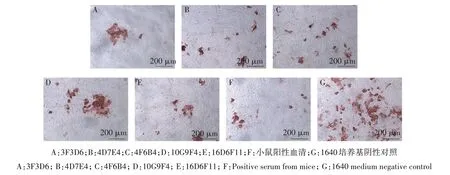
图3 抗H7N9 AIV HA蛋白单克隆抗体中和活性鉴定Fig.3 Identification of neutralizing activity of anti-H7N9 AIV HA protein mAbs
2.3.6 广谱性鉴定 不同年份的H7 亚型AIV 感染MDCK 细胞的检测结果显示,5 株单克隆抗体均可以与不同株的病毒发生反应(图4),表明筛选的单克隆抗体具有广谱反应性。

图4 抗H7N9 AIV HA蛋白单克隆抗体广谱性鉴定Fig.4 Broad-spectrum identification of anti-H7N9 AIV HA protein mAbs
2.3.7 与H7-Re2、H7-Re3 抗原株反应性鉴定 Dot blot 鉴定了5 株单克隆抗体与H7-Re2 和H7-Re3 抗原株的反应性,鉴定结果显示,5株抗体不仅识别变异株H7-Re3,也可识别H7-Re2抗原株(图5)。

图5 单克隆抗体与H7-Re2、H7-Re3抗原株的反应性鉴定Fig.5 Identification of the reactivity of mAbs with H7-Re2 and H7-Re3 antigenic strains
2.3.8 Western blot 鉴定 Western blot 检测结果显示,制备的5 株单克隆抗体均在约63 ku 处出现1 条特异性的条带(图6),说明制备的5 株单克隆抗体与HA 重组蛋白A/Anhui/1/2013(H7N9)具有较好的反应性,识别的是线性表位。

图6 抗H7N9 AIV HA蛋白单克隆抗体的Western blot鉴定Fig.6 Western blot identification of anti-H7N9 AIV HA protein mAbs
3 结论与讨论
由于流感病毒的多宿主性和高度变异性,使得现有的流感检测和诊断技术的有效性受到限制[17-19]。因此,研制广谱性识别流感病毒的单克隆抗体和检测试剂对流感病毒的监测与防控具有重要意义。本研究采用全病毒免疫小鼠的方法,改变单克隆抗体筛选方式,将2019 年后出现的H7-Re3变异株直接作为HI 试验的抗原检测杂交瘤细胞株的上清,并且结合基于全病毒的IPMA 试验和基于HA 蛋白的ELISA 筛选方法,筛选到可识别H7-Re2变异株和H7-Re3 变异株且具有较好中和活性的单克隆抗体。
HA 蛋白是流感病毒的主要表面抗原,感染宿主后可以诱导产生中和抗体。HA 蛋白的主要功能是与细胞表面受体结合以及介导膜融合,还可能在病毒粒子出芽和形态发生过程中发挥作用。流感病毒的快速变异使得现用疫苗的毒株持续更新,筛选到靶向HA 蛋白的中和抗体以及后续保守表位的研究可以为新型通用疫苗的设计提供思路。本研究筛选的5株具有广谱反应性的单克隆抗体不仅可以识别H7-Re2 抗原株,为2019 年以前的H7 亚型AIV 提供检测的技术手段,还可以与H7-Re3 抗原株发生反应,因此也可以检测到2019年以后发生变异的H7 亚型AIV,对目前H7 亚型AIV 的检测和监控具有重要意义。SUN 等[20]研制了一种基于2 株中和单克隆抗体的H7N9 特异型胶体金快速检测试纸,该试纸可以检测拭子和肺部样本,实现对H7N9 AIV 的快速检测。同样,YANG 等[21]建立了一种基于2 株HA 蛋白单克隆抗体的ELISA 方法检测H7N9 AIV,对HA 蛋白的检出限为3.9 ng/mL,也可以检测到H7N9 AIV,为H7N9 的检测提供技术支持。对于快速变异的流感病毒,基于单克隆抗体的胶体金快速检测试纸和ELISA 方法需要及时更新,本研究筛选的5株具有中和活性的单克隆抗体均可识别2019年前后的H7亚型AIV,后续可以这5株单克隆抗体为基础,建立快速检测技术,从而实现对H7亚型AIV的持续监测。
本研究采用杂交瘤技术成功制备5株具有较高特异性的单克隆抗体,具有较好广谱性,可以识别H7-Re2 抗原株和H7-Re3 变异株,为H7 亚型禽流感病毒快速检测方法的建立提供了技术支持。此外,5株靶向HA蛋白的单克隆抗体还具有较好的中和活性,为后续中和表位的研究提供参考。

