猪流行性腹泻病毒S1 蛋白的免疫原性评估
陈维聪,刘运超,周川杰,杨苏珍,魏 蔷,柴书军,张改平,,3
(1. 西北农林科技大学 动物医学院,陕西 杨凌 712100;2. 河南省农业科学院 动物免疫学重点实验室,河南 郑州 450002;3. 扬州大学 江苏高校动物重要疫病与人兽共患病防控协同创新中心,江苏 扬州 225009)
猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)为单股正链RNA 病毒,属于冠状病毒科[1]。PEDV 传染性强,对各年龄段的猪均能感染,多在寒冷季节暴发[2-3]。该病毒的传播途径主要是粪-口传播,气溶胶也是传播途径之一,饲料和原料成分也可将病原传播给仔猪。通常年龄较大的猪感染PEDV 病情较轻且病程短,死亡率低,但对哺乳期仔猪危害极大,常引起严重腹泻和呕吐,病死率可达50%以上[4]。PEDV 基因组包含7 个开放阅读框(Open reading frame,ORF),其中ORF1a 和1b 编码的2 种蛋白质被切割成多个非结构蛋白(nsp1—nsp16),参与PEDV RNA 的转录和复制[5]。ORF2—6依次编码4种结构蛋白,分别为S、E、M和N蛋白,其中S 蛋白位于病毒表面,由1 383 个氨基酸组成,在病毒与宿主细胞受体相互作用和刺激机体产生中和抗体方面起重要作用[6-7]。前人研究表明,在PEDV 入侵宿主细胞时,S蛋白由宿主蛋白酶切割成S1 和S2 亚基,S1 蛋白介导病毒与细胞受体的结合,能够诱导机体产生中和抗体,是研制PEDV 亚单位疫苗的重要靶标蛋白[8]。
目前,尚无针对PEDV 的特效药物,只能通过免疫接种疫苗进行预防。临床上广泛使用PEDV 的灭活疫苗或减毒活疫苗进行免疫,取得了良好的防控效果[9]。但是随着病毒的不断变异,尤其是G2b 亚型变异毒株的出现,使得PEDV 的防控压力逐渐增大[10-12]。同时,弱毒疫苗还存在排毒或毒力返强等问题,增加了生物安全风险。与弱毒疫苗相比,亚单位疫苗具有抗原特异性强、免疫原性好、生物安全性高等优点[13-14]。SUO 等[15]以哺乳动物细胞表达的PEDV S1 蛋白为抗原制备疫苗免疫妊娠母猪,可在血清中检测到抗PEDV 中和性抗体,对所产仔猪具有良好的保护作用。谭博敏等[16]在毕赤酵母表达载体中插入PEDV S1 蛋白基因,并成功在酵母染色体上整合了该基因,表达的目的蛋白与PEDV 阳性血清能发生特异性结合。之后,该团队构建了S1和M基因的共表达重组杆状病毒,其共表达产物与PEDV 多克隆抗体的反应具有很强的特异性,且具有良好的反应原性。前人研究表明,果蝇胚胎S2细胞为悬浮培养细胞,培养过程中不需要CO2,细胞培养工艺简单,生产成本低廉,便于规模化生产[17]。为此,利用果蝇胚胎S2 细胞重组表达PEDV 的S1 蛋白,将表达的目的蛋白纯化后制备疫苗进行动物免疫试验,对其免疫原性进行综合评估,旨在为研制新型PEDV亚单位疫苗奠定基础。
1 材料和方法
1.1 载体、细胞、主要试剂及供试动物
PEDV CH/HUBEI/2016 株、pMT/BiP/V5-S1-His A表达载体、果蝇胚胎S2 细胞、PEDV 阳性血清、ISA 50V 佐剂、HisTrap Excel 预装柱、Superdex 200 Increase 凝胶过滤层析柱、LPS 培养液、荧光标记抗体(CD3e-APC、CD4-FITC、CD8a-PE)均由河南省农业科学院动物免疫学重点实验室提供。
Vero 细胞购自中国科学院细胞库;RPMI-1640培养基、DMEM 高糖培养基、PBS、双抗(100 U/mL 青霉素、100 µg/mL 链霉素)、ECL 显色液试剂盒、Cell Counting Kit-8 试剂盒,均购自北京索莱宝公司;牛胰蛋白酶购自Sigma 公司;彩虹180 广谱蛋白质Marker 购自Thermo Fisher Scientific 公司;鼠抗组氨酸标签(His)抗体购自Proteintech 公司;辣根过氧化物酶(HRP)标记的羊抗鼠IgG 购自Abcam 公司;PEDV-IgG 抗体检测试剂盒、IL-4 检测试剂盒和IFN-γ 检测试剂盒均购自上海酶联生物公司;APC anti mouse CD3e、FITC anti mouse CD4、PE anti mouse CD8a 抗体均购自BD 公司;细胞转染试剂CellfectinⅡ、杀稻瘟菌素S(Blasticidin S)均购自Invitrogen 公司;4 周龄雌性昆明鼠(共20 只)购自郑州市实验动物中心。
1.2 重组蛋白的表达
将重组表达载体pMT/BiP/V5-S1-His A 和辅助载体pCoBlast 按19∶1 的比例共转染生长状态良好的果蝇胚胎S2 细胞,每隔72 h 更换含杀稻瘟菌素S的新鲜完全培养基进行筛选,经4~5轮筛选,待正常生长的细胞培养至密度(4~6)×105个/mL 时,加入终浓度0.75 mmol/L 的硫酸铜进行诱导表达,28 ℃、220 r/min 条件下培养5 d。收集诱导后细胞离心取上 清 进 行Western blot 检 测,以1∶5 000 稀 释 的PEDV阳性血清为一抗,以1∶2 000稀释的HRP标记的羊抗鼠IgG为二抗。
1.3 重组蛋白的纯化
收集诱导细胞,2 000 r/min 离心30 min 收集上清。使用pH 值8.8 的1.5 mol/L Tris-HCl 缓冲液调节细胞上清pH 值至8.0,4 ℃条件下10 000 r/min 离心30 min,经0.22 µm 滤膜过滤后用于纯化。首先使用5 mL HisTrap Excel 预装柱对表达的重组PEDV S1 蛋白初步纯化,收集不同浓度咪唑洗脱液进行SDS-PAGE 初步鉴定,将得到的洗脱液经超滤管浓缩后,然后用Superdex 200 Increase 凝胶过滤层析柱进一步纯化,收集洗脱液进行SDS-PAGE鉴定。
1.4 重组蛋白的免疫评价
1.4.1 免疫程序 将纯化的重组PEDV S1 蛋白与ISA 50V 佐剂按照1∶1(m/V)混合乳化制备疫苗。将20 只昆明鼠随机分为4 组,采取皮下多点注射法进行免疫。高剂量免疫组免疫S1 蛋白60 µg/只(S1 60 µg);低剂量免疫组免疫S1 蛋白20 µg/只(S1 20µg);灭活病毒免疫组免疫PEDV 灭活病毒液150µL/只(浓缩后TCID50=10-6/100µL);PBS 免疫组免疫PBS 150µL/只,作为阴性对照。首免后14、35 d各加强免疫一次。首免后分别于0、7、14、21、28、35、42、49、56 d 眼眶静脉丛采血分离血清,三免后10 d摘取脾脏,分别采用流式细胞术、ELISA、病毒中和试验和淋巴细胞增殖试验检测小鼠的免疫应答。
1.4.2 特异性抗体及细胞因子检测 采用双抗夹心法测定免疫小鼠特异性IgG 抗体产生水平,将待检血清50倍稀释,与标准品分别加入以PEDV S1蛋白抗原包被的微孔中,每组样品重复5 次,37 ℃孵育30 min,每孔加入150µL PBST 洗涤5 次;每孔加入50 µL 酶标二抗,37 ℃孵育30 min,洗涤5 次;加入显色液避光作用15 min,随即加入终止液,并于酶标仪以450 nm 波长进行读数(OD450)。以标准品质量浓度及OD450绘制标准曲线,结合样品稀释倍数计算样品质量浓度。以相同方法测定小鼠血清中IL-4和IFN-γ浓度。
1.4.3 病毒中和试验 采用二免后14 d 小鼠血清进行病毒中和试验。将加热灭活后的血清1∶10 稀释后,每孔按50µL 在96 孔板上作连续2 倍倍比稀释(1∶4、1∶8…1∶512),随后与200 TCID50PEDV 病毒液1∶1混合,37 ℃孵育1 h;将血清-病毒混合液加入提前接种Vero 细胞的96 孔板中,37 ℃培养箱中孵育3~5 d,显微镜下观察记录细胞病变孔数,中和抗体效价以完全抑制病毒感染的血清稀释倍数的倒数表示。
1.4.4 流式细胞术检测 采集各组小鼠100 µL 抗凝血进行T 细胞亚类检测,室温下每管加入荧光标记 抗 体:2 µL APC antimouse CD3e、1 µL FITC antimouse CD4 和1 µL PE antimouse CD8a,避光孵育25 min;每管加入红细胞裂解液室温孵育15 min,每隔4 min 颠倒混匀,2 000 r/min 离心3 min;每管加入300µL PBS重悬细胞,利用流式细胞仪进行检测。
1.4.5 脾细胞增殖试验 三免后10 d,各组随机选取2只小鼠进行淋巴细胞增殖试验。无菌摘取小鼠脾脏,利用注射器胶塞和尼龙筛网轻柔研磨收集脾脏单细胞,加入红细胞裂解液作用15 min,2 000 r/min离心3 min,将分离出的淋巴细胞以每孔5×105个铺设96孔板,每孔含100µL 1640培养基,37 ℃预培养16 h,再分别加入2µg/孔和5µg/孔的S1 蛋白,37 ℃孵育48 h,分别设立LPS 和1640 培养液为阳性和阴性对照,每孔加入10 µL CCK-8 试剂,37 ℃孵育1~4 h,于酶标仪以450 nm 波长进行读数,参考文献中方法计算淋巴细胞刺激指数[18]。
2 结果与分析
2.1 重组PEDV S1蛋白的表达
经过4~5 轮25 µg/mL 杀稻瘟菌素S 筛选,得到稳定分泌表达PEDV S1蛋白的S2细胞系,然后加入0.75 mmol/L 硫酸铜诱导5 d,离心取上清,对表达产物进行Western blot鉴定。结果显示,在100 ku处出现能与PEDV 阳性血清产生特异性反应的单一条带(图1),与预期蛋白质分子质量大小一致,表明重组PEDV S1蛋白成功表达。
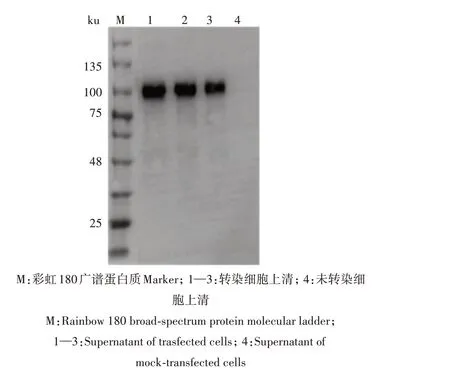
图1 重组PEDV S1蛋白的Western blot 鉴定Fig.1 Identification of recombinant S1 protein by Western blot
2.2 重组PEDV S1蛋白的纯化
从图2 可以看出,重组PEDV S1 蛋白能被50~500 mmol/L 咪唑洗脱下来,但杂蛋白较多。收集洗脱液通过超滤管离心,再经凝胶过滤层析柱纯化后,SDS-PAGE分析显示,重组PEDV S1蛋白的洗脱体积在12.2 mL处(图3A),杂蛋白得到有效去除,得到纯度较高的PEDV S1重组蛋白(图3B)。
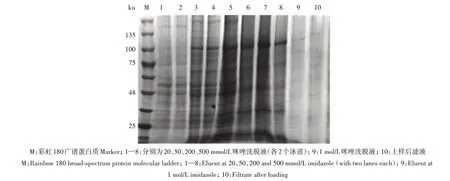
图2 重组PEDV S1蛋白的SDS-PAGE分析Fig.2 SDS-PAGE analysis of recombinant S1 protein

图3 重组S1蛋白的分子筛色谱(A)和SDS-PAGE分析结果(B)Fig.3 Resuluts of size-exclusion chromatography(A)and SDS-PAGE analyses(B)of recombinant protein S1
2.3 重组PEDV S1蛋白的免疫原性检测结果
2.3.1 特异性抗体水平 从图4 可以看出,与阴性对照相比,重组PEDV S1 蛋白能引起机体产生免疫应答反应,IgG 抗体水平首免后不断上升。高剂量免疫组IgG 抗体水平在28 d显著高于灭活病毒免疫组(P<0.05),在35 d 与灭活病毒免疫组相比差异极显著(P<0.01)。
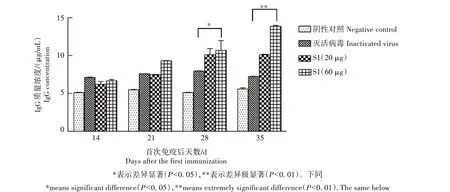
图4 重组PEDV S1蛋白免疫血清IgG特异性抗体水平检测结果Fig.4 Detection results of IgG-specific antibody in recombinant PEDV S1 protein immune serum
2.3.2 中和抗体效价 检测二免后14 d 各组小鼠血清,高、低剂量S1 蛋白免疫组和灭活病毒免疫组中和抗体效价分别为1∶320、1∶160 和1∶320,均高于阴性对照组(1∶40),表明纯化后的重组PEDV S1蛋白具有良好的免疫原性,能够诱导机体产生抗PEDV中和抗体。
2.3.3 细胞因子水平 采用双抗夹心ELISA 方法检测免疫后小鼠血清中IL-4 和IFN-γ 水平的变化,结果如图5、图6 所示,与阴性对照相比,重组PEDV S1 蛋白免疫组的IL-4 和IFN-γ 水平持续上升。首免后56 d,与灭活病毒免疫组相比,高剂量S1 蛋白免疫组IL-4 水平差异极显著(P<0.01);首免后42 d,高剂量S1 蛋白免疫组的IFN-γ 水平差异极显著(P<0.01)。
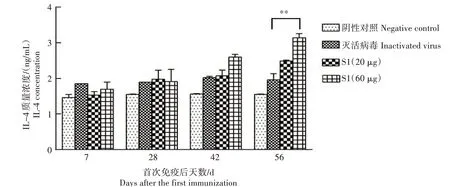
图5 重组PEDV S1蛋白免疫血清IL-4水平检测结果Fig.5 Detection results of IL-4 level in recombinant PEDV S1 protein immune serum
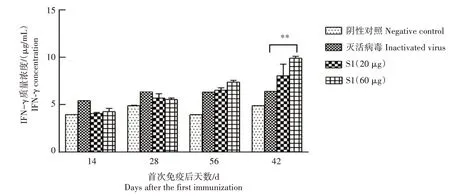
图6 重组PEDV S1蛋白免疫血清IFN-γ水平检测结果Fig.6 Detection results of IFN-γ level in recombinant PEDV S1 protein immune serum
2.3.4 脾淋巴细胞刺激指数 从图7 可以看出,2µg/孔的重组PEDV S1 蛋白刺激后,高剂量免疫组刺激指数与PBS 免疫组、灭活病毒免疫组相比差异性极显著(P<0.01);5µg/孔的重组PEDV S1 蛋白刺激后,高剂量免疫组与PBS 免疫组、灭活病毒免疫组相比差异显著(P<0.05)。
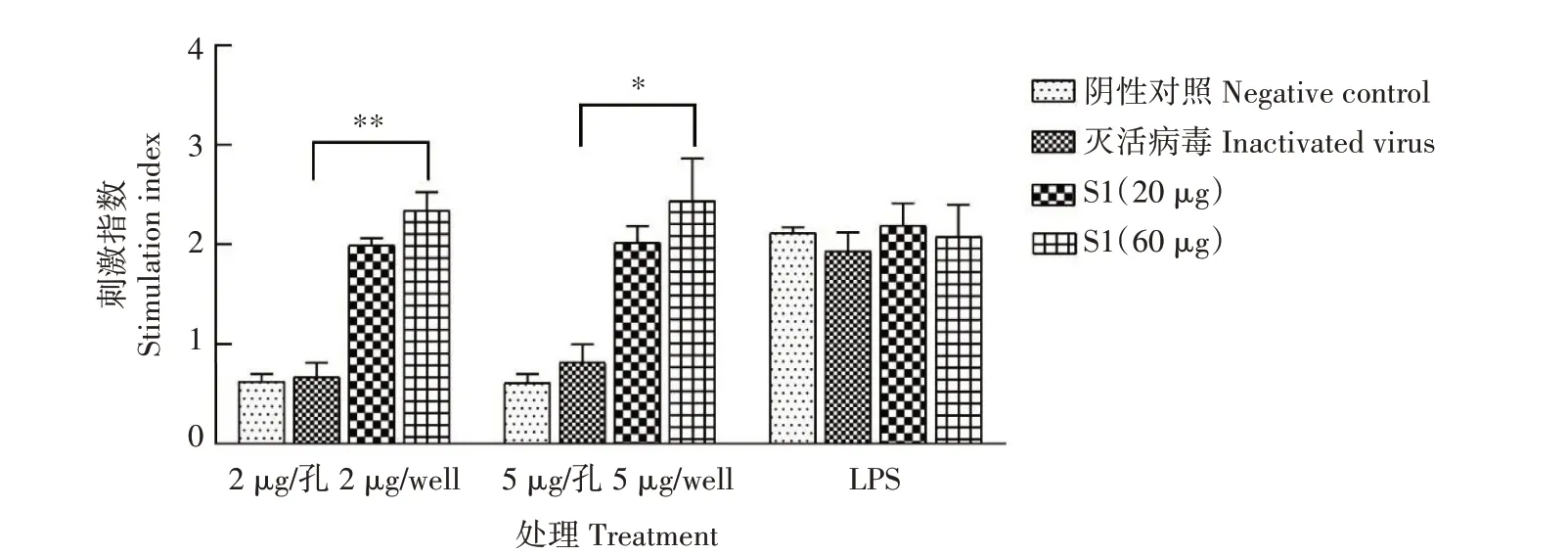
图7 重组PEDV S1蛋白免疫小鼠淋巴细胞增殖指数测定结果Fig.7 Detection results of lymphocyte proliferation index of mice immunized with recombinant PEDVS1 protein
2.3.5 外周血中CD3+T 细胞、CD4+/CD8+T 细胞比例 由表1 可知,重组PEDV S1 蛋白免疫组CD3+细胞百分比高于灭活病毒免疫组和PBS免疫组,CD4+/CD8+比值均高于对照组。

表1 小鼠外周血T淋巴细胞亚群变化检测结果Tab.1 Detection results of changes in T lymphocyte subsets in peripheral blood of mice
3 结论与讨论
猪流行性腹泻是一种传染性肠道疾病,可感染各年龄段的猪,主要依赖接种疫苗进行防控[19]。2006 年以来,PEDV 新流行毒株出现,CV777 株传统弱毒疫苗保护率降低,给我国养猪业造成巨大损失。PEDV S 蛋白是病毒表面纤突糖蛋白,参与病毒与宿主细胞表面受体结合,其中S1蛋白是诱发中和抗体的主要抗原和PEDV 亚单位疫苗研究的重要靶点[20-21]。果蝇胚胎S2细胞系来源于黑腹果蝇胚胎晚期的原代细胞培养物,能够在没有CO2的情况下以松散的半黏附和悬浮形式生长,该表达系统结合了哺乳动物细胞和杆状病毒表达系统的优点,能够对外源蛋白进行高效折叠,形成二硫键和糖基化修饰,使重组蛋白结构与功能更接近其天然状态[22]。同时,该细胞培养过程中无须使用血清,成本低,工艺简单,更利于工业化生产。
本研究利用果蝇胚胎S2 细胞表达系统重组表达了PEDV S1 蛋白,纯化后抗原纯度可达80%以上,能够与PEDV 阳性血清发生特异性反应。重组PEDV S1 蛋白以分泌表达形式存在于细胞培养上清中,利于分离纯化。重组PEDV S1 蛋白与佐剂混合后免疫昆明鼠,可诱导产生高效价的PEDV 特异性IgG。黄春娟[23]利用大肠杆菌表达系统串联表达的PEDV S 蛋白核心表位和大肠杆菌热不稳定肠毒素(Heat-labile enterotoxin B,LTB)免疫小鼠,产生的PEDV 特异性血清IgG 抗体显著高于灭活苗阳性对照。与黄春娟[23]的研究结果相比,本研究利用果蝇胚胎S2细胞表达的重组PEDV S1蛋白免疫小鼠,抗原使用量和注射剂量更少,且免疫效果更优。本研究中重组PEDV S1 蛋白诱导产生高效价的中和性抗体,60 µg 剂量免疫组小鼠的血清中和效价可达1∶320,远高于王加圆[24]研究中的中和效价(仅为1∶8)。提示本研究利用果蝇胚胎S2 细胞表达的重组S1蛋白能够更好地诱导体液免疫应答。
细胞因子检测结果显示,重组PEDV S1 蛋白免疫可刺激小鼠产生高水平IL-4 和IFN-γ,与聂民财等[25]的研究结果一致,表明重组PEDV S1 蛋白免疫可同时刺激体液免疫和细胞免疫应答。由于细胞因子试剂盒检测灵敏度较高,多次眼眶采血造成小鼠应激等因素,阴性对照组小鼠OD450检测值偏高,但与重组S1 蛋白免疫组和疫苗免疫组相比仍差异显著。重组S1 蛋白能够有效刺激小鼠脾脏淋巴细胞分裂增殖,免疫组小鼠CD3+T 细胞百分比和CD4+/CD8+细胞比值均得到提升,提示机体特异性细胞免疫应答被激活。史翠萍等[26]制备了展示PEDV S1 蛋白的重组杆状病毒活载体疫苗,免疫小鼠可诱导产生抗PEDV 特异性抗体和中和抗体,同时能够诱导小鼠脾脏淋巴细胞产生细胞免疫应答,与本研究结果一致。重组PEDV S1 蛋白作为抗原制备疫苗,能够有效激活宿主的体液免疫和细胞免疫应答,避免了弱毒疫苗存在的生物安全风险,是PEDV亚单位疫苗研究的一个重要方向。
综上,采用果蝇S2细胞表达系统成功分泌表达了PEDV S1 蛋白,以重组表达的S1 蛋白免疫昆明鼠,在小鼠血清中检测到高效价的PEDV 特异性抗体和中和性抗体,同时有效刺激了细胞免疫应答,这为PEDV S1 蛋白的功能研究和亚单位疫苗的开发奠定了基础。

