猪肌肉干细胞在三维水凝胶中的分化研究
陈彧,朱浩哲,陈益春,刘政,丁希,郭赟,丁世杰,周光宏
猪肌肉干细胞在三维水凝胶中的分化研究
陈彧,朱浩哲,陈益春,刘政,丁希,郭赟,丁世杰,周光宏
南京农业大学食品科技学院/国家肉品质量安全控制工程技术研究中心/教育部肉品加工与质量控制重点实验室,南京 210095
【目的】探究猪肌肉干细胞在三维水凝胶中的分化效果,为体外诱导肌肉干细胞分化成为肌肉组织提供方法指导。【方法】将一定数目的猪肌肉干细胞分别在二维和三维条件下诱导分化(二维条件指在培养皿中培养细胞,三维条件指在水凝胶中培养细胞),分别收取增殖阶段、预分化阶段、分化初期、分化成熟、分化末期的二维培养细胞的RNA和蛋白样品,以及分化7和14 d的三维培养细胞的RNA和蛋白样品。利用RT-qPCR技术检测细胞在两种条件下分化至不同阶段时成肌相关基因、、、的表达水平;利用Western Blot技术检测细胞在两种条件下分化至不同阶段时MYOG、MyHC蛋白的表达水平;利用免疫荧光染色技术观察猪肌肉干细胞在二维和三维条件下融合形成的肌管;使用氨基酸自动分析仪检测分化14 d培养肌肉组织的氨基酸含量及组成。【结果】二维培养的猪肌肉干细胞在分化第3天时开始发生肌融合,在分化第7天形成成熟肌管,随后进入分化末期,肌管开始脱落。三维培养的猪肌肉干细胞在分化第7天时还未完全伸展,细胞的和表达水平低;分化第14天时水凝胶内已形成多核肌管,和表达达到二维分化水平。三维分化有利于终末分化基因和的表达,分化14 d时的表达量是二维分化7 d的12倍,的表达量是二维分化7 d的4倍,但是MyHC蛋白的表达量仅为二维分化7 d时的1/6。氨基酸分析结果表明体外培养肌肉组织中17种水解氨基酸含量均低于猪肉,且必需氨基酸在总氨基酸的占比也低于猪肉,但是呈味氨基酸的占比相较猪肉更高。【结论】猪肌肉干细胞可以在三维胶原水凝胶中分化形成肌管,且三维条件有利于成肌分化相关基因表达,但要实现MyHC蛋白的高表达还需进一步研究,按此方法体外培养的肌肉组织有较高的呈味氨基酸含量,可能会有较好的风味。
猪肌肉干细胞;分化;水凝胶;肌管;细胞培养肉
0 引言
【研究意义】细胞培养肉是根据肌肉自我修复机理,通过动物上提取的干细胞在体外进行扩增培养和诱导分化形成肌纤维而生产的肉类,其无需通过动物养殖,具有环保、节能、高效、安全等诸多潜在优点[1]。肌肉干细胞是一种需要锚点的细胞,必须附着在一定基质或者附着在支架上才能增殖分化[2]。因此,要实现肌肉干细胞在体外分化形成肌肉组织,需要选用合适的支架对肌肉干细胞进行三维培养。【前人研究进展】细胞培养中常用天然水凝胶作为支架[3],如胶原蛋白、血纤蛋白等,这样的体系有利于肌细胞分化的融合和收缩[4]。早在1988年就有研究通过使用胶原对二维培养的禽类骨骼肌细胞分化形成的肌管进行包被,将肌管的培养时间从5—6 d延长至2—3周,实现了类似于三维培养的效果[5]。OKANO等[6]将C2C12小鼠成肌细胞和I型胶原混合注入毛细管模具中,构建了一种杆状的水凝胶体,经过7 d的培养,得到了可观察到多核肌管的肌肉组织。还有研究通过将多层三维水凝胶中培养的牛肌肉组织进行堆叠,制作出了具有一定厚度的培养肉牛排[7]。除了水凝胶支架外,常见的可用于肌肉干细胞培养的支架还有明胶纤维支架[8]、植物蛋白支架[9]等,相关研究还报道了在脱去细胞的植物组织上进行肌细胞的三维培养[10-12]。【本研究切入点】目前的研究较多通过组织染色或免疫荧光染色观察肌细胞融合后形成的肌管来表征肌肉干细胞在三维条件下的分化效果,但是这种方法不能较为准确地评价肌细胞的分化程度,且大部分关于肌细胞三维培养研究使用的细胞为小鼠成肌细胞C2C12,而生产细胞培养肉需要培养更符合人类食用习惯的物种的肌肉干细胞,如、鸡、鸭、猪、牛、羊等畜禽类和鱼类。【拟解决的关键问题】本研究利用一种基于胶原水凝胶用于猪肌肉干细胞的体外三维培养体系,通过RT-qPCR、Western blot、免疫荧光染色的方法来表征猪肌肉干细胞在水凝胶中的分化水平,并与二维分化的细胞进行对比以评价三维条件下的分化效果,为将来实现肌肉干细胞体外大规模分化生产细胞培养肉产品提供方法指导。
1 材料与方法
试验于2021年在南京农业大学国家肉品质量安全控制工程技术研究中心进行。
1.1 试验材料
1.1.1 试验动物 七日龄幼猪,幼猪品种为约克夏猪,由苏食集团生猪养殖基地提供。
1.1.2 主要试剂 胎牛血清(FBS)、马血清(HS)、F10培养基、DMEM培养基、100×双抗(PS)、磷酸盐缓冲溶液(PBS)、0.25%胰蛋白酶、碱性成纤维细胞生长因子(bFGF),购于美国GIBCO公司;鼠尾I型胶原、Matrigel,购于美国CORNING公司;胶原酶D、消散酶II,购于美国Roche公司;浓盐酸、冰醋酸、氢氧化钠、甲醇、乙醇、曲拉通X-100,购于国药集团化学试剂有限公司;脱脂奶粉、Trizol、DMSO(细胞培养级),购于索莱宝公司;牛血清白蛋白(BSA)购于美国SIGMA公司;RIPA裂解液(强)、PMSF,购于上海碧云天生物技术有限公司;培养细胞总RNA提取试剂盒购于天根生化科技有限公司;BCA蛋白质定量试剂盒、SuperSignal™ West Pico PLUS 化学发光底物,购于美国Thermo公司;ChamQ SYBR qPCR Master Mix(货号Q311-02)、HiScript III RT SuperMix for qPCR (+gDNA wiper)(货号R323-01),购于Vazyme公司;Loading buffer、彩虹预染蛋白Marker(10—250 kD)、Tris-MOPS-SDS电泳缓冲液、4%—20% SurePAGE™蛋白预制胶、免疫印迹PVDF膜、平衡液、转膜液、TBST,购于南京金斯瑞生物科技有限公司;MyHC一抗(货号:ab37484)、MYOG一抗(货号:ab238027)购于Abcam公司;GAPDH一抗(货号:MAB374)购于Millipore公司;鼠二抗(货号:CW2333S)购于Cwbiotech公司;免疫荧光鼠二抗(货号:A11005),购于美国Thermo公司;Antifade Mounting Medium with DAPI,购于Vector公司;鬼笔环肽购于美国Cell Signaling Technology公司。
1.2 试验方法
1.2.1 猪肌肉干细胞的分离与分选 将刚屠宰幼猪在75%乙醇中浸泡消毒后转移至超净台中,切取幼猪前后腿部的肌肉组织,并将其置于装有DMEM的离心管中漂洗2—3 min。将漂洗后的肌肉组织转移至盛有DMEM的培养皿中,用灭菌的手术剪将肌肉组织剪碎,并将剪碎后的肌肉组织收集至装有DMEM的离心管中。向离心管中加入1/6体积的胶原酶D和消散酶II溶液(浓度均为10 mg∙mL-1),混匀后反复抽吸肌肉组织,然后将离心管转移至37℃培养箱中孵育,每孵育15 min反复抽吸一次,直至溶液可顺利通过30 mL带针头的注射器。加入5 mL基础培养基(15% FBS+84% F10+1% PS)和适量PBS稀释酶解后的肌肉组织,并使用100 μm细胞滤器过滤溶液,滤液经过800×离心5 min后吸除上清液取沉淀。向离心管中加入5 mL红细胞裂解液重悬沉淀,裂解5 min后经800×离心5 min后吸除上清液取沉淀,用PBS清洗沉淀1—2次。使用40 μm细胞滤器过滤,使用血球计数板对滤液中细胞进行计数,按照计数结果将单细胞以1×107的接种量接种至预装有8 mL基础培养基的10 cm培养皿中用于流式分选,剩余细胞经过800×离心5 min后取细胞沉淀,按照1×106/mL冻存细胞。单细胞在培养的第2进行流式分选,首先用0.25%的胰蛋白酶消化细胞并用基础培养基终止消化反应,300×离心5 min后收集细胞沉淀。用含1% BSA的PBS溶液稀释的CD56-PE、CD29-488、CD31-APC、CD45-647荧光抗体1 mL重悬细胞,在冰上孵育30 min,300×离心5 min后用PBS溶液清洗2次,清洗后用300 μL含3%双抗的基础培养基重悬细胞并上机检测(Aria II SORP 流式细胞仪,美国BD公司),分选出CD56+、CD29-、CD31-、CD45-的猪肌肉干细胞为P0代细胞。
1.2.2 猪肌肉干细胞的体外增殖培养 复苏P2代猪肌肉干细胞,以1.5×105的接种量接种细胞到预铺了0.05%鼠尾I型胶原的10 cm培养皿上,每个培养皿中预先加入8 mL增殖培养基(15% FBS+84% F10+1% PS,bFGF浓度5 ng∙mL-1)。然后将培养皿放置在37℃、5% CO2的恒温培养箱中培养。每2 d对细胞进行换液,当细胞汇合度达到约40%时对细胞进行传代。传代时先使用0.25%胰蛋白酶将细胞从培养皿上消化下来,收集细胞并使用台盼蓝对细胞进行染色,用血球计数板计算活细胞数目,然后按照1.5×105的接种量接种到新的预铺胶原培养皿中。将细胞传代至P5代并增殖至足够数量,以P5代细胞作为研究对象。
1.2.3 猪肌肉干细胞的体外二维分化 将3×105的P5代猪肌肉干细胞接种到预铺了0.02% Matrigel的3.5 cm培养皿上,每个培养皿中预先加入2 mL增殖培养基。然后将培养皿放置在37℃、5% CO2的恒温培养箱中培养,每2 d对细胞进行换液。当细胞汇合度达到约90%时更换为分化培养基(2% HS+97% DMEM+1% PS),每2 d进行一次半换液。
1.2.4 猪肌肉干细胞的体外三维分化 用DMEM培养基将鼠尾I型胶原浓度稀释到2 mg∙mL-1,并用1 mol∙L-1NaOH溶液调节胶原pH至7.4。将9×106的P5代猪肌肉干细胞和1 800 μL胶原溶液,160 μL Matrigel混匀后接入定制的模具中,待其凝固后加入4 mL增殖培养基。然后将其放置在37℃、5% CO2的恒温培养箱中培养,培养24 h后将增殖培养基吸出更换为分化培养基,继续培养,每2 d进行一次半换液。
1.2.5 RT-qPCR检测相关基因的表达量 二维培养细胞直接使用Trizol裂解液裂解,三维培养细胞使用Trizol裂解液裂解,并用冷冻破碎仪破碎样品。按照天根的培养细胞总RNA提取试剂盒的操作流程提取样品的总RNA,使用超微量分光光度计测定RNA的浓度和纯度;使用Vazyme公司的HiScript III RT SuperMix for qPCR(+gDNA wiper)试剂,按照技术说明书对RNA进行逆转录,得到cDNA;使用Vazyme公司的ChamQ SYBR qPCR Master Mix试剂,按照技术说明书进行qPCR反应,使用2-△△CT方法计算目的基因的相对表达量(基因及引物信息见表1)。

表1 RT-qPCR引物信息表
1.2.6 Western blot检测相关蛋白的表达 二维培养细胞直接用RIPA裂解液(使用时加入1% PMSF)裂解细胞,三维培养细胞使用PIRA裂解液(使用时加入1% PMSF)裂解并使用冷冻破碎仪破碎样品。将裂解后的样品在12 000 r/min转速离心5 min后收集上清液,使用BCA试剂盒检测样品蛋白质浓度,并加入Loading buffer在95℃下加热5 min使蛋白变性。取适量变性后的蛋白样品进行SDS-PAGE凝胶电泳,电泳结束后通过快速湿转移将蛋白转印至PVDF膜上,切取对应蛋白分子量的条带(MyHC:220 kD;MYOG:34 kD;GAPDH:36 kD)置于5%脱脂奶粉中封闭2 h,然后4℃下孵育一抗14 h(一抗稀释比例为1﹕1 000),室温孵育二抗2 h(二抗稀释比例为1﹕2 000),二抗孵育结束后显影并拍照,使用Quantity one软件进行蛋白条带的灰度值分析。
1.2.7 免疫荧光染色观察肌细胞的融合情况 二维培养样品和三维培养样品用PBS清洗干净后均用4%多聚甲醛固定过夜,固定后的样品用PBS清洗后,使用0.5% Triton X-100通透30 min,然后用5% BSA溶液封闭30 min,MyHC一抗孵育(一抗稀释比例为1﹕800,4℃下孵育12 h);二抗孵育(二抗稀释比例为1﹕1 000,室温避光孵育1 h);F-actin染色(鬼笔环肽室温避光孵育20 min);滴加含DAPI的防荧光猝灭剂,盖上盖玻片,在共聚焦显微镜下观察采集图像。
1.2.8 氨基酸组成分析 分别取适量的分化14 d三维培养肌肉和新鲜猪肉(取自猪背最长肌)于顶空瓶中,加入3 mL的6 mol∙L-1HCl,抽真空并通入氮气,在110℃水解23 h。将水解后的样品稀释到25 mL,取1 mL稀释液进行氮吹,吹至干燥后用1 mL的0.02 mol∙L-1HCl复溶。复溶后过0.22 μm水相滤膜,将滤液收集至液相小瓶中,使用HITACHI-L8900氨基酸自动分析仪对样品的氨基酸组成和含量进行测定分析。
1.3 统计分析
使用SAS软件,采用One-way ANOVA检验方法对数据进行显著性差异分析,使用GraphPad Prism 7软件对数据进行统计分析。每组试验均设置3个生物学重复,所有数据均以“平均数±标准差”表示;图中不同字母表示两组数据平均值间存在显著性差异(<0.05)。
2 结果
2.1 二维条件下猪肌肉干细胞不同分化阶段的形态学观察
在光学显微镜下观察处于不同分化阶段的猪肌肉干细胞,处于增殖期的猪肌肉干细胞,可观察到其细胞形态主要为中间宽、两端拉长的梭形或者纺锤形,为干细胞的正常形态(增殖阶段,图1-A);当细胞汇合度达到90%以上时,细胞进行大规模接触(预分化阶段,图1-B),此阶段开始诱导分化;分化第3天可观察到细胞伸展更具方向性,并开始发生肌融合,能观察到较为细小的肌管形成(分化初期,图1-C);分化第4天已经能观察到大面积肌融合的发生,开始生成较粗较长的多核肌管(图1-D);分化第7天,肌细胞的融合程度达到最高,产生的肌管长度和直径都达到较高水平(分化成熟,图1-E);分化第8天,可以观察到肌管已经开始大面积地脱落并聚成团状漂浮在培养基中(分化末期,图1-F)。
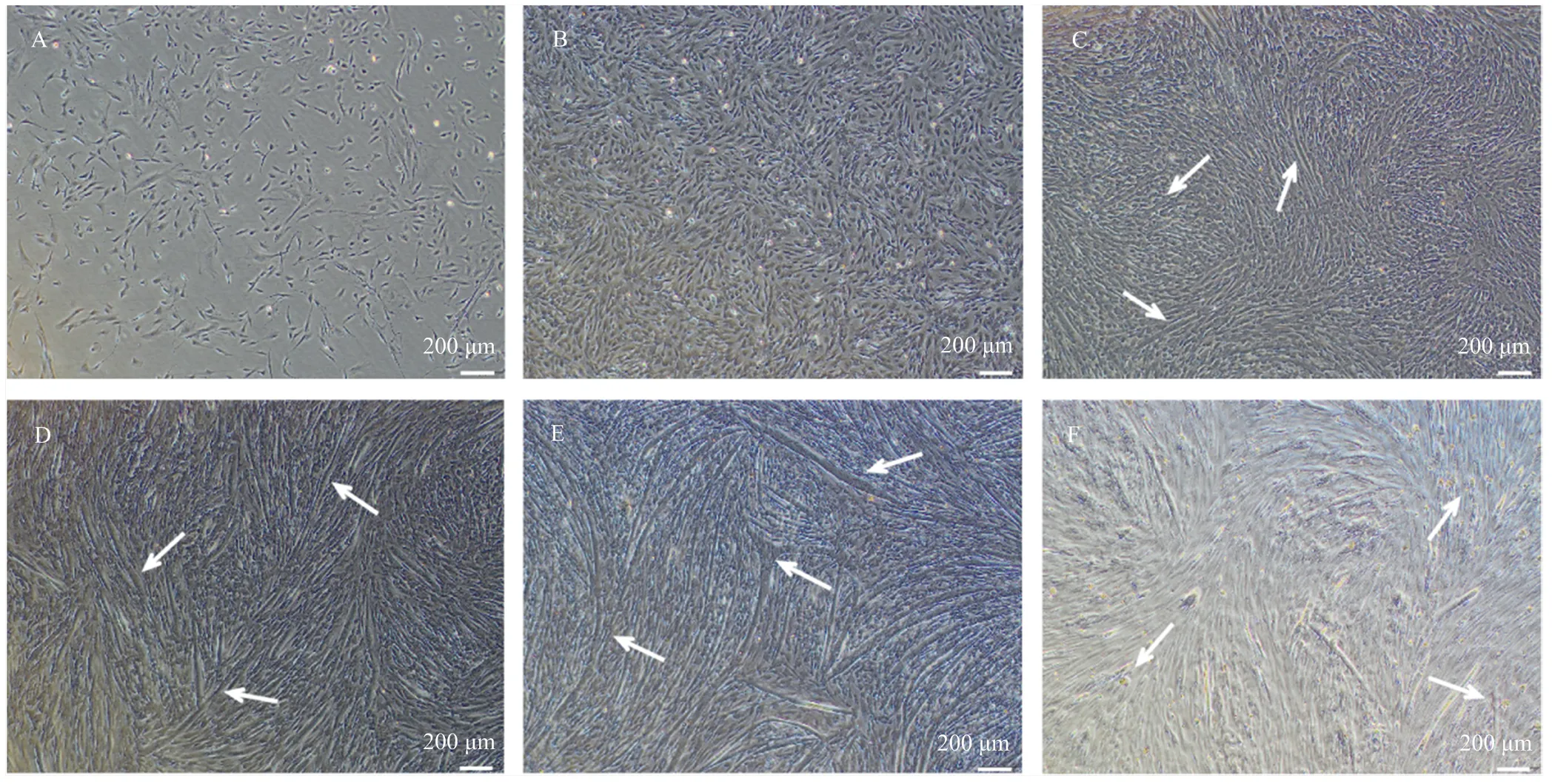
A:处于增殖期的猪肌肉干细胞(成肌细胞);B:分化0 d(预分化);C:分化3 d;D:分化4 d;E:分化7 d;F:分化8 d
2.2 三维培养肌肉组织在模具中的形态观察
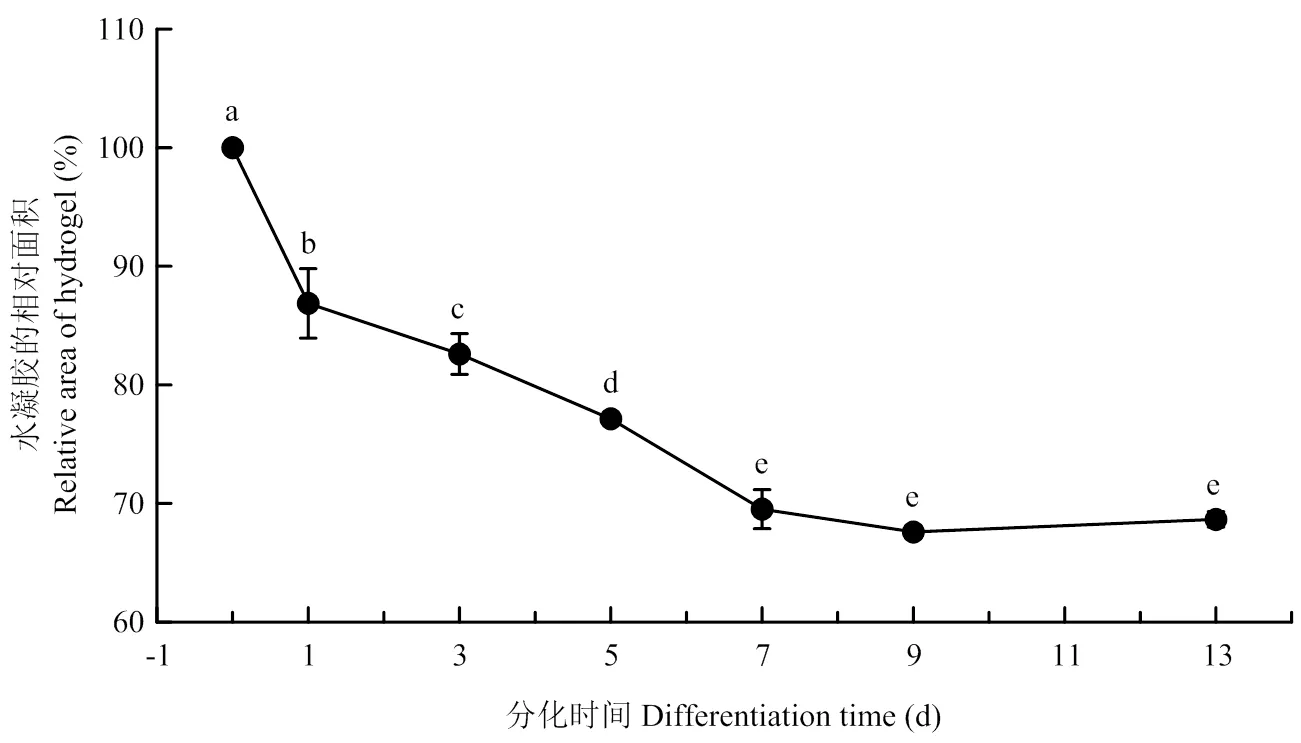
将猪肌肉干细胞和水凝胶预混后接入带微柱的模具中培养,模具中的微柱会调控细胞定向排列,可以促进细胞分化,对比分化0 d和分化7 d(图2),可以观察到模具中的水凝胶发生了明显的收缩,具体表现为水凝胶的面积变小,支柱周边的网孔面积增大,分化7—13 d(图3),水凝胶面积无显著变化。
2.3 猪肌肉干细胞分化至各阶段的免疫荧光染色
对二维和三维培养的细胞进行免疫荧光染色,通过激光共聚焦显微镜来观察其分化过程中肌管的成型。在二维培养中,可以观察到处于增殖期的细胞多处于梭形或者纺锤形(图4-A);当细胞增殖达到预分化阶段时,细胞数目多,细胞间相互接触但是排布无序(图4-B);当到达分化初期时,可观察到肌细胞的排布具有一定的方向性,细胞形态细长,相邻的细胞开始融合,出现多核细胞(图4-C);肌细胞分化进入成熟期后,可观察到宽数十微米,可长达数百微米的明显的多核肌管结构,多核肌管中的细胞核呈整齐的方向性排列,且MyHC蛋白信号强,其与肌管共定位(图4-D);这种多核肌管在分化末期仍能部分存在(图4-E)。在三维培养至第7天时,可观察到细胞大多为未伸展开的圆球形,无肌球蛋白重链(myosin heavy chain,MyHC)表达(图4-F),分化至第14天时大部分肌细胞形态变得细长,部分细胞发生融合形成较为细长的多核肌管,肌管直径与二维培养下有较大差距,但是其中的细胞核和二维培养条件下一致呈方向性排列,MyHC蛋白有表达(图4-G)。

A:分化0 d;B:分化7 d;C:分化13 d A: Differentiated for 0 day; B: Differentiated for 7 days; C: Differentiated for 13 days
不同小写字母表示差异显著(P<0.05)。下同 Different lowercase letters indicate significant difference (P<0.05). The same as below
以上结果表明,在胶原水凝胶中,猪肌肉干细胞可以分化并融合形成多核肌管,但是相比二维条件下细胞分化7 d就已产生成熟肌管,肌细胞在三维分化7 d时仍大部分呈球形,伸展程度较小,分化14 d时才可观察到细胞融合产生的肌管,且肌管的直径和长度及细胞的融合程度相比二维培养都有较大差距,肌细胞整体的分化进程较二维培养慢。
2.4 猪肌肉干细胞分化过程中各关键基因的表达变化
分别收取增殖期(Myoblast)、预分化期(pre-diff)、分化初期、分化成熟、分化末期的二维培养细胞RNA样品以及分化7、14 d的三维培养细胞RNA样品,通过RT-qPCR技术检测其成肌过程中关键基因的表达情况。肌细胞生成素(Myogenin,MYOG)属于MRFs家族,是成肌分化启动的标志基因,对分化的进行及肌管的形成起决定性的作用[13],微囊蛋白-3(caveolin-3,CAV-3)是细胞膜上微囊的主要组成成分,其特异地表达于肌细胞中[14],在肌细胞分化融合形成肌管的过程中起重要的作用,MyHC是肌细胞分化成熟产生的重要蛋白,是构成肌原纤维的重要成分,MyHC-slow和MyHC-2a是其两种亚型。结果显示在二维培养过程中,的表达在细胞进入分化初期时显著上调,并在到达分化成熟期前一直维持在较高的表达水平,在分化进入末期时表达显著下调,在三维培养过程中,在分化7—14 d表达显著上调,但在分化7 d时的表达相对较低,而分化14 d时表达量比二维分化初期更高。在二维分化的增殖期和预分化期基本不表达,在分化初期开始表达,并且在分化到末期表达开始下调,在三维分化7 d时已经开始表达但表达量低于二维分化初期,分化14 d时的表达量与二维分化初期和成熟期水平相当。二维分化中和都是在进入分化初期后才开始表达,其中随着分化的进行显著上调,在分化末期表达量较成熟期仍有显著的提升,而的表达在分化初期到分化末期无显著变化,在三维分化中,分化7 d时的表达量与同期的二维分化相比更高,的表达量与同期的二维分化相比无显著性差异,三维分化14 d时的表达量是二维分化7 d的12倍,的表达量是二维分化7 d的4倍。

A:增殖期的猪肌肉干细胞(成肌细胞);B:二维分化0 d;C:二维分化3 d;D:二维分化7 d;E:二维分化8 d;F:三维分化7 d;G:三维分化14 d
以上结果表明在三维水凝胶中,猪肌肉干细胞的分化进程与二维分化培养存在一定的差异,其表现在和的上调较二维分化慢,但是和的表达量可以达到甚至高于同期的二维分化,且在进行更长时间(14 d)的分化后其表达仍能显著提升,说明在基因水平上,猪肌肉干细胞在三维水凝胶体系中可以促进分化。
2.5 猪肌肉干细胞分化过程中各关键蛋白的表达变化
分别收取增殖期、预分化期、分化初期、分化成熟期、分化末期的二维培养细胞蛋白样品以及分化7、14 d的三维培养细胞蛋白样品,通过Western Blot技术检测其成肌过程中MYOG和MyHC蛋白的表达变化。在二维分化进程中,MYOG蛋白在增殖期和预分化期基本不表达,在开始分化时表达量显著提高,并随着分化的进行,表达量逐渐降低,三维分化中,MYOG蛋白在分化7 d时基本未表达,分化14 d时表达显著上调。MyHC蛋白在二维分化的增殖阶段和预分化阶段无表达,在分化后开始表达,且分化成熟时的表达量较分化初期有显著提高。当二维分化进入末期时MyHC的表达量显著降低,三维分化7 d时,MyHC蛋白基本无表达,分化14 d时有较少量的MyHC蛋白表达,但表达量与二维分化相比更低。
以上结果表明,在蛋白水平上,三维水凝胶中细胞的MYOG蛋白和MyHC蛋白的表达相比二维分化低,尤其是MyHC蛋白表达与二维分化相比差异较大。
2.6 三维培养肌肉组织的氨基酸组成分析
由表2可知,培养肌肉中的氨基酸含量与猪肉仍有较大的差距,其各项氨基酸含量均低于猪肉。培养肌肉中的必需氨基酸占总氨基酸的比例为23.39%,低于猪肉的37.12%,但是培养肌肉中的呈味氨基酸占总氨基酸的比例为53.19%,高于猪肉的44.39%。
3 讨论
3.1 猪肌肉干细胞的二维分化进程
肌肉干细胞也被称为肌卫星细胞[15],位于肌纤维膜和基底膜之间[16],正常条件下,肌卫星细胞处于静息状态,表达和,和是肌卫星细胞的标志基因,被认为是肌卫星细胞命运的主要调控因子[17-18],当肌肉受到机械损伤时,肌卫星细胞被激活,分化为成肌细胞(Myoblast),会激活并上调的表达,促进细胞进入增殖阶段,并抑制分化[19]。当肌卫星细胞收到诱导分化的信号,退出细胞周期并结束增殖,成肌细胞进一步分化为肌细胞(Myocyte),开始表达,细胞进入分化进程,在分化早期就开始表达[20],其对肌细胞融合形成多核肌管(Myotube)和肌纤维起着重要促进作用[21-22]。被证明与T小管的形成相关,其在肌细胞融合形成肌管时表达上调,并在分化成熟的过程中表达降低,在成人肌肉中几乎不表达[23]。本研究中发现,在二维培养的猪肌肉干细胞分化进程中,和在增殖阶段和预分化阶段基本不表达。当细胞进入分化初期,和的表达快速上调并随着分化的进行而表达量逐渐降低,终末分化基因的表达水平随着分化的进行不断提高,这与Schmidt等[24]的研究结果类似。该结果揭示了猪肌肉干细胞在二维分化条件下的分化进程,其中和表达水平可以用来判断猪肌肉干细胞在分化进程中所处的阶段。
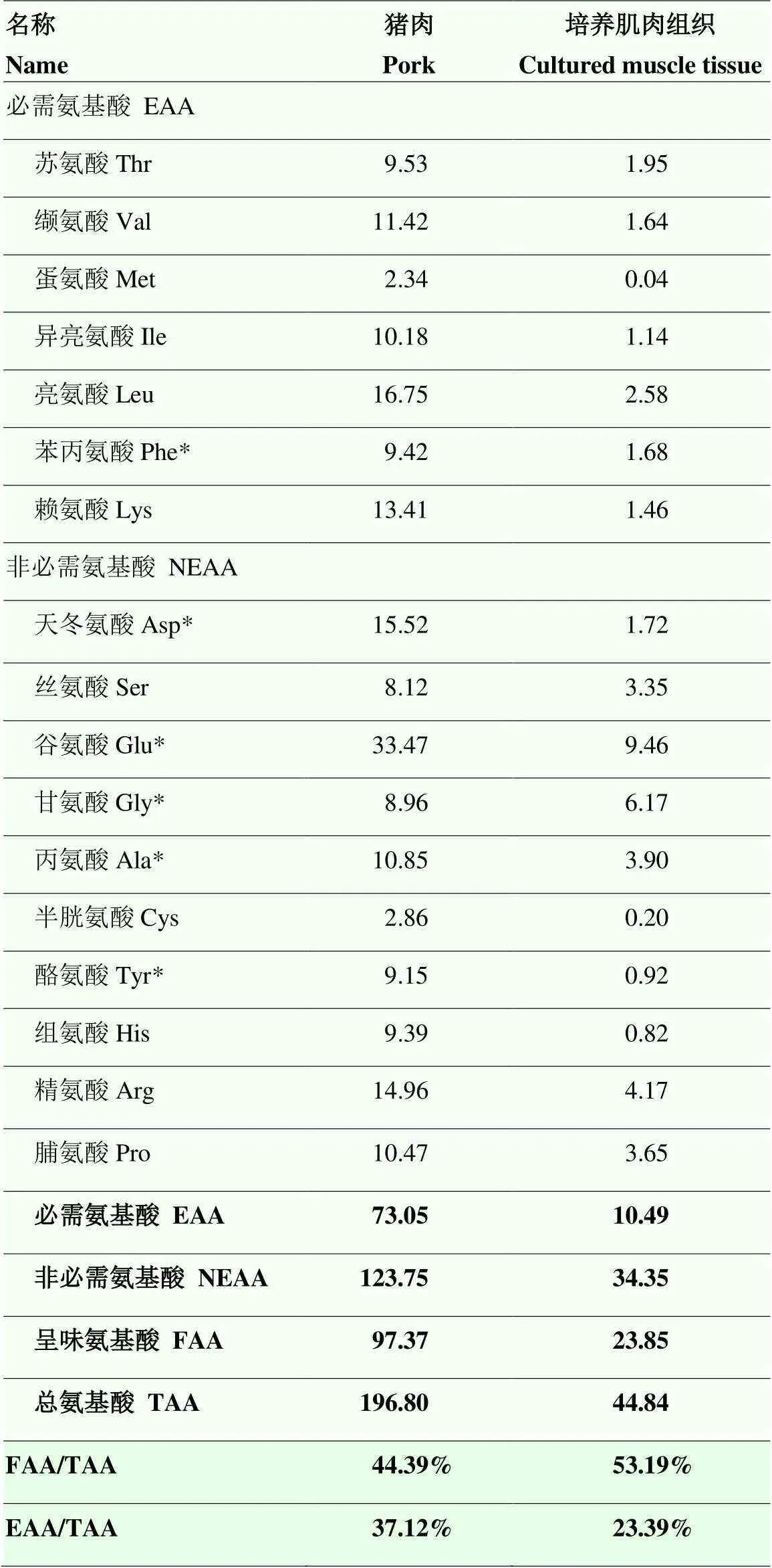
表2 猪肉和培养肌肉组织的氨基酸含量
*为呈味氨基酸 *Refers to flavoring amino acids
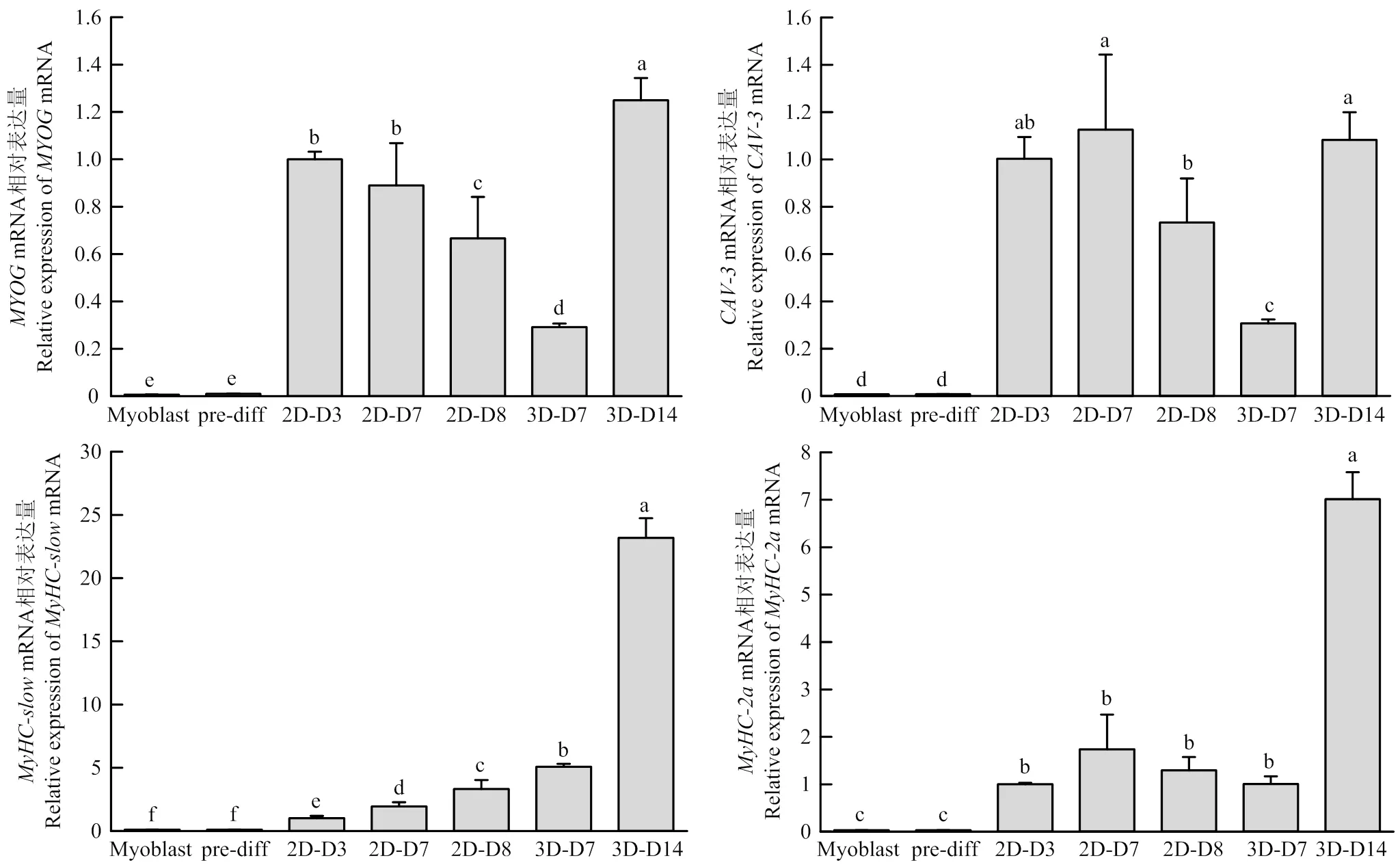
Myoblast:增殖期的猪肌肉干细胞;pre-diff:二维分化0 d;2D-D3:二维分化3 d;2D-D7:二维分化7 d;2D-D8:二维分化8 d;3D-D7:三维分化7 d;3D-D14:三维分化14 d。下同
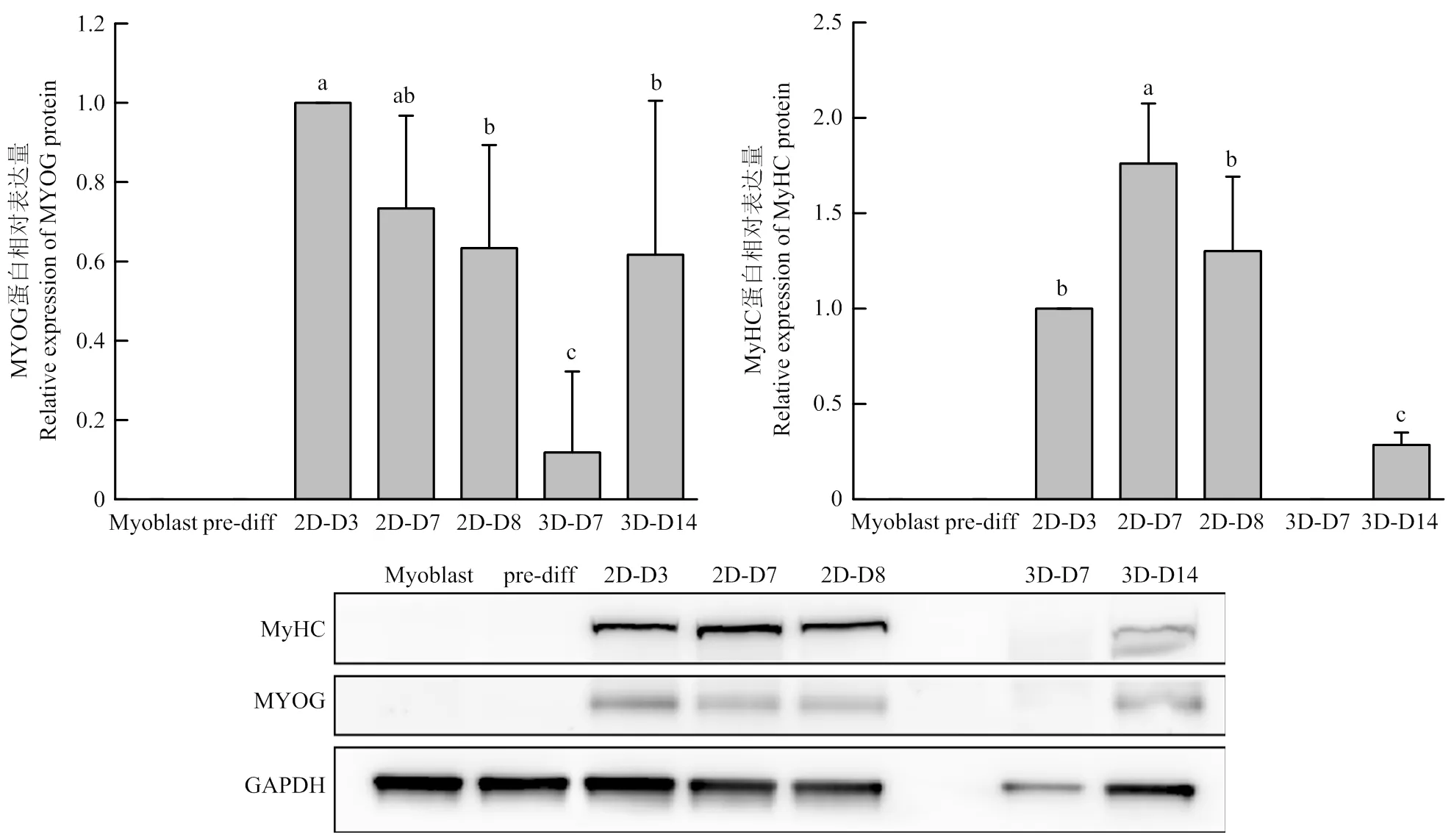
图6 猪肌肉干细胞分化过程中各关键蛋白的表达变化
3.2 猪肌肉干细胞在三维水凝胶的分化
本研究发现三维分化第7天时和表达水平低,分化14 d时才达到二维分化第7天时的水平,表明水凝胶中肌细胞的分化受到抑制,这很可能是水凝胶三维环境的作用。三维培养相较于二维培养,细胞所处的环境更加复杂,环境对细胞的影响更大。研究表明,细胞刚接入水凝胶时都是未展开的球形,细胞膜的表面会有一些受体用于感知外界环境,这些信息会传递到细胞内部并诱导细胞内肌动蛋白骨架发生变化,从而改变细胞的形态来适应环境,这种变化最终会影响细胞的功能和命运[25]。在本研究中,猪肌肉干细胞在水凝胶中分化第7天时细胞的伸展程度较小,肌融合未发生,在分化第14天时可观察到分化形成的多核肌管结构。肌细胞在水凝胶中的伸展较二维培养更缓慢,肌融合也随之受阻。这种细胞在水凝胶中延迟伸展的现象在Scott等[26]的研究中也有类似的报道,血管外膜成纤维细胞在不同强度的聚乙二醇水凝胶中培养7 d仍均保持球形,直至第14天才发生不同程度的伸展,且强度较大的水凝胶中细胞伸展程度较小,说明水凝胶的网络结构限制了细胞的形态变化。将肌肉干细胞接入强度适宜的胶原水凝胶中,细胞会逐渐结合胶原纤维上的锚点,纤维会给细胞牵引力诱导细胞形态发生变化,并使水凝胶发生收缩[27]。当水凝胶强度较大,即环境不适宜细胞伸展时,细胞会分泌一些基质降解酶来改变周围的环境,这就可能造成细胞在水凝胶中伸展延迟[28]。Hogrebe等[29]研究了不同强度自组装肽水凝胶中人间充质干细胞的伸展情况,在接种细胞1 d后,在强度为0.25 kP的水凝胶中,二维培养和三维培养的细胞均仍呈球形;强度为1.25 kP和5 kP的水凝胶中分别二维培养和三维培养的细胞均可以正常伸展;而在强度为10 kP的水凝胶中,二维培养的细胞可以正常伸展,三维培养的细胞却不能伸展开;对其进行较长时间的培养发现,在0.25 kP的水凝胶中,二维和三维培养的细胞仍为球形,而在10 kP的水凝胶中三维培养26 d时可明显观察到细胞伸展。该结果说明细胞伸展需要环境提供一定的牵引力,如果牵引力过小,细胞可能不能正常伸展;而水凝胶强度太大,细胞会需要更长的时间才能伸展,因为细胞需要释放一些基质降解酶来创造适宜自身的环境,故构成水凝胶的纤维的易降解程度也会是细胞伸展速度的影响因素。水凝胶除了通过影响细胞的伸展对细胞造成影响,构成水凝胶纤维的浓度、交联程度及接种细胞的密度等也会决定水凝胶网络的空隙大小,从而影响细胞与外界的物质交换和细胞间的信号传递[30]。在二维培养时,培养皿中的细胞可以通过流动的培养基快速地进行物质交换和信号传递,但是在三维培养中,水凝胶复杂的网络结构使营养物质和代谢产物的运输路径增加,细胞的物质交换受到抑制。因此,三维培养时需要一些类似于血管的结构辅助内部的细胞进行物质交换,如Kolesky等[31]通过3D打印技术在明胶和纤维蛋白交联形成的水凝胶中打印了类血管组织,实现了为厚组织灌输培养基和生长因子。
3.3 三维培养有利于MyHC相关基因的表达
肌球蛋白(Myosin)是肌原纤维的重要组成成分,其高表达是肌管或肌纤维成熟的重要标志。肌球蛋白由肌球蛋白重链和肌球蛋白轻链组成,其中根据肌纤维的代谢类型不同,可将MyHC分为几种不同的亚型[32],其中MyHC-slow和MyHC-2a分别对应慢速氧化型肌纤维和快速氧化型肌纤维[33]。在本研究中,三维分化条件相比于二维分化更有利于和的表达。这种三维培养促进相关基因表达的现象与Fujie等[34]的研究结果类似,其通过聚乳酸-羟基乙酸共聚物制作的纳米带片和纤维连接蛋白制作出具有两层肌细胞的肌肉组织薄片来模拟细胞的三维培养状态,结果表明双层培养时肌细胞的、、和表达水平均高于单层培养,表明双层培养有利于肌管的分化成熟。但是本研究中虽然三维培养促进了的相关基因表达,但是三维培养肌细胞的MyHC蛋白表达水平与二维培养有较大的差距。在Liu等[35]的研究中,二维培养和三维水凝胶培养7 d的C2C12细胞MyHC蛋白表达水平无显著差异,与本研究的结果不同。本研究认为MyHC的低表达可能和肌细胞的融合程度较低有关,免疫荧光染色的结果显示MyHC蛋白的染色和F-actin染色的肌管是共定位的,说明肌细胞融合成肌管的程度与MyHC蛋白的表达呈一定的正向关系,现有研究证明MyHC的产生与肌细胞的融合程度有关[36]。本研究中构建的水凝胶体系延缓了细胞的伸展,这可能也是肌细胞融合受阻的原因,将来的研究可以通过优化水凝胶体系的配方,如改变胶原浓度及交联程度等,构建更有利于肌细胞融合形成肌管的水凝胶体系。
3.4 培养肌肉组织的氨基酸组成
本研究培养肌肉中的氨基酸含量与猪肉还有很大的差异,这可能与培养肌肉组织中的高水分含量有关,就氨基酸的组成来看,培养肌肉中的必需氨基酸在总氨基酸中的占比低于猪肉,但是呈味氨基酸的占比高于猪肉,可能会拥有更好的风味。培养肌肉中含量较高的氨基酸为谷氨酸、甘氨酸、精氨酸、脯氨酸等,这些也是构成鼠尾胶原蛋白的主要氨基酸,鼠尾胶原中必需氨基酸占比约16%[37],而培养肌肉中为23.39%,说明接入细胞后其必需氨基酸的占比明显提升,未来可以通过优化水凝胶的体系,提高细胞密度等方法,培养出营养成分与猪肉更加接近的肌肉组织。
4 结论
本研究构建了一种用于猪肌肉干细胞体外三维培养的水凝胶体系,实现了猪肌肉干细胞的体外三维分化。三维条件有利于猪肌肉干细胞的终末分化基因和的表达,由此方法体外培养的肌肉组织具有较高的呈味氨基酸含量。
[1] 周光宏, 丁世杰, 徐幸莲. 培养肉的研究进展与挑战. 中国食品学报, 2020, 20(5): 1-11.
ZHOU G H, DING S J, XU X L. Progress and challenges in cultured meat. Journal of Chinese Institute of Food Science and Technology, 2020, 20(5): 1-11. (in Chinese)
[2] STOKER M, O'NEILL C, BERRYMAN S, WAXMAN V. Anchorage and growth regulation in normal and virus-transformed cells. International Journal of Cancer, 1968, 3(5): 683-693. doi: 10.1002/ijc. 2910030517.
[3] DATAR I, BETTI M. Possibilities for anmeat production system. Innovative Food Science & Emerging Technologies, 2010, 11(1): 13-22.
[4] POWELL C A, SMILEY B L, MILLS J, VANDENBURGH H H. Mechanical stimulation improves tissue-engineered human skeletal muscle. American Journal of Physiology Cell Physiology, 2002, 283(5): C1557-C1565. doi: 10.1152/ajpcell. 00595.2001.
[5] VANDENBURGH H H, KARLISCH P, FARR L. Maintenance of highly contractile tissue-cultured avian skeletal myotubes in collagen gel.Cellular & Developmental Biology, 1988, 24(3): 166-174. doi: 10.1007/BF02623542.
[6] OKANO T, MATSUDA T. Tissue engineered skeletal muscle: Preparation of highly dense, highly oriented hybrid muscular tissues. Cell Transplant, 1998, 7(1): 71-82. doi: 10.1177/ 096368979800700110.
[7] FURUHASHI M, MORIMOTO Y, SHIMA A, NAKAMURA F, ISHIKAWA H, TAKEUCHI S. Formation of contractile 3D bovine muscle tissue for construction of millimetre-thick cultured steak. NPJ Science of Food, 2021, 5(1): 6. doi: 10.1038/s41538-021- 00090-7.
[8] MACQUEEN L A, ALVER C G, CHANTRE C O, AHN S, CERA L, GONZALEZ G M, O'CONNOR B B, DRENNAN D J, PETERS M M, MOTTA S E, ZIMMERMAN J F, PARKER K K. Muscle tissue engineering in fibrous gelatin: implications for meat analogs. NPJ Science of Food, 2019, 3: 20. doi: 10.1038/s41538- 019-0054-8.
[9] BEN-ARYE T, SHANDALOV Y, BEN-SHAUL S, LANDAU S, ZAGURY Y, IANOCIVI I, LAVON N, LEVENBERG S. Textured soy protein scaffolds enable the generation of three-dimensional bovine skeletal muscle tissue for cell-based meat. Nature Food, 2020, 1(4): 210-220.
[10] GERSHLAK J R, HERNANDEZ S, FONTANA G, PERREAULT L R, HANSEN K J, LARSON S A, BINDER B Y, DOLIVO D M, YANG T, DOMINKO T, ROLLE M W, WEATHERS P J, MEDINA-BOLIVAR F, CRAMER C L, MURPHY W L, GAUDETTE G R. Crossing kingdoms: Using decellularized plants as perfusable tissue engineering scaffolds. Biomaterials, 2017, 125: 13-22. doi: 10.1016/j.biomaterials. 2017.02.011.
[11] MODULEVSKY D J, LEFEBVRE C, HAASE K, AI-REKABI Z, PELLING A E. Apple derived cellulose scaffolds for 3D mammalian cell culture. PLoS ONE, 2014, 9(5): e97835.
[12] JONES J D, REBELLO A S, GAUDETTE G R. Decellularized spinach:
An edible scaffold for laboratory-grown meat. Food Bioscience, 2021, 41: 100986.
[13] FONG A P, YAO Z, ZHONG J W, JOHNSON N M, FARR G H, MAVES L, TAPSCOTT S J. Conversion of MyoD to a neurogenic factor: Binding site specificity determines lineage. Cell Reports, 2015, 10(12): 1937-1946. doi: 10.1016/j.celrep.2015.02.055.
[14] 苏艳红, 袁乾坤. Caveolin-3对骨骼肌,心肌伤病的调控机制. 中国学校体育: 高等教育, 2014(8): 6.
SU Y H, YUAN Q K. Regulation mechanism of Caveolin-3 on skeletal muscle and myocardial Injury. China School Physical Education (Higher Education), 2014(8): 6. (in Chinese)
[15] MAURO A. Satellite cell of skeletal muscle fibers. The Journal of Biophysical and Biochemical Cytology, 1961, 9: 493-495. doi: 10. 1083/jcb.9.2.493.
[16] LEPPER C, PARTRIDGE T A, FAN C M. An absolute requirement for Pax7-positive satellite cells in acute injury-induced skeletal muscle regeneration. Development, 2011, 138(17): 3639-3646. doi: 10.1242/ dev.067595.
[17] SOLEIMANI V D, PUNCH V G, KAWABE Y, JONES A E, PALIDWOR G A, PORTER C J, CROSS J W, CARVAJAL J J, KOCKX C E, VAN IJCKEN W F, PERKINS T J, RIGBY P W, GROSVELD F, RUDNICKI M A. Transcriptional dominance of Pax7 in adult myogenesis is due to high-affinity recognition of homeodomain motifs. Developmental Cell, 2012, 22(6): 1208-1220. doi: 10.1016/j.devcel.2012.03.014.
[18] DING S, WANG F, LIU Y, LI S, ZHOU G, HU P. Characterization and isolation of highly purified porcine satellite cells. Cell Death Discovery, 2017, 3: 17003. doi: 10.1038/cddiscovery. 2017.3.
[19] ZAMMIT P S, GOLDING J P, NAGATA Y, HUDON V, PARTRIDGE T A, BEAUCHAMP J R. Muscle satellite cells adopt divergent fates: A mechanism for self-renewal? The Journal of Cell Biology, 2004, 166(3): 347-357.
[20] ZAMMIT P S. Function of the myogenic regulatory factors Myf5, MyoD, Myogenin and MRF4in skeletal muscle, satellite cells and regenerative myogenesis. Seminars in Cell & Developmental Biology, 2017, 72: 19-32. doi: 10.1016/j.semcdb.2017.11.011.
[21] LE GRAND F, RUDNICKI M A. Skeletal muscle satellite cells and adult myogenesis. Current Opinion in Cell Biology, 2007, 19(6): 628-633.
[22] BENTZINGER C F, WANG Y X, RUDNICKI M A. Building muscle: molecular regulation of myogenesis. Cold Spring Harbor Perspectives in Biology, 2012, 4(2): a008342. doi: 10.1101/cshperspect. a008342.
[23] PARTON R G, WAY M, ZORZI N, STANG E. Caveolin-3 associates with developing T-tubules during muscle differentiation. The Journal of Cell Biology, 1997, 136(1): 137-154. doi: 10.1083/jcb. 136.1.137.
[24] SCHMIDT M, SCHÜLER S C, HÜTTNER S S, EYSS B, MALTZAHN J. Adult stem cells at work: regenerating skeletal muscle. Cellular and Molecular Life Sciences, 2019, 76(13): 2559-2570. doi: 10.1007/s00018-019-03093-6.
[25] VERNEREY F J, LALITHA SRIDHAR S, MURALIDHARAN A, BRYANT S J. Mechanics of 3D cell-hydrogel interactions: experiments, models, and mechanisms. Chemical Reviews, 2021, 121(18): 11085-11148. doi: 10.1021/acs.chemrev.1c00046.
[26] SCOTT R A, ROBINSON K G, KIICK K L, AKINS R E. Human adventitial fibroblast phenotype depends on the progression of changes in substrate stiffness. Advanced Healthcare Materials, 2020, 9(8): e1901593. doi: 10.1002/adhm.201901593.
[27] TAN J L, TIEN J, PIRONE D M, GRAY D S, BHADRIRAJU K, CHEN C S. Cells lying on a bed of microneedles: An approach to isolate mechanical force. Proceedings of the National Academy of Sciences, 2003, 100(4): 1484-1489.
[28] KOBAYASHI T, KIM H, LIU X, SUGIURA H, KOHYAMA T, FANG Q, WEN F Q, ABE S, WANG X, ATKINSON J J, SHIPLEY J M, SENIOR R M, RENNARD S I. Matrix metalloproteinase-9 activates TGF-β and stimulates fibroblast contraction of collagen gels. American Journal of Physiology Lung Cellular and Molecular Physiology, 2014, 306(11): L1006-L1015. doi: 10.1152/ajplung.00015. 2014.
[29] HOGREBE N J, GOOCH K J. Direct influence of culture dimensionality on human mesenchymal stem cell differentiation at various matrix stiffnesses using a fibrous self-assembling peptide hydrogel. Journal of Biomedical Materials Research Part A, 2016, 104(9): 2356-2368. doi: 10.1002/jbm.a.35755.
[30] MAHADIK B P, BHARADWAJ N A, EWOLDT R H, HARLEY B A. Regulating dynamic signaling between hematopoietic stem cells and niche cells via a hydrogel matrix. Biomaterials, 2017, 125: 54-64. doi: 10.1016/j.biomaterials.2017.02.013.
[31] KOLESKY D B, HOMAN K A, SKYLAR-SCOTT M A, LEWIS J A. Three-dimensional bioprinting of thick vascularized tissues. Proceedings of the National Academy of Sciences, 2016, 113(12): 3179-3184. doi: 10.1073/pnas.1521342113.
[32] SCHIAFFINO S, REGGIANI C. Fiber types in mammalian skeletal muscles. Physiological Reviews, 2011, 91(4): 1447-1531. doi: 10.1152/ physrev.00031.2010.
[33] EGGERT J M, DEPREUX F F, SCHINCKEL A P, GRANT A L, GERRARD D E. Myosin heavy chain isoforms account for variation in pork quality. Meat Science, 2002, 61(2): 117-126. doi: 10.1016/ s0309-1740(01)00154-1.
[34] FUJIE T, SHI X, OSTROVIDOV S, LIANG X B, NAKAJIMA K, CHEN Y, WU H K, KHADEMHOSSEINI A. Spatial coordination of cell orientation directed by nanoribbon sheets. Biomaterials, 2015, 53: 86-94. doi: 10.1016/j.biomaterials.2015.02.028.
[35] LIU G Y, AGARWAL R, KO K R, RUTHVEN M, SARHAN H T, FRAMPTON J P. Templated assembly of collagen fibers directs cell growth in 2D and 3D. Scientific Reports, 2017, 7(1): 9628. doi: 10.1038/s41598-017-10182-8.
[36] GROSSI A, YADAV K, LAWSON M A. Mechanical stimulation increases proliferation, differentiation and protein expression in culture: stimulation effects are substrate dependent. Journal of Biomechanics, 2007, 40(15): 3354-3362. doi: 10.1016/j.jbiomech. 2007.05.007.
[37] 任海涛, 钟志勇, 郑佳琳, 饶子亮, 邝少松, 王刚, 唐小江. 鼠尾胶原蛋白提取、分离、纯化方法的建立及鉴定. 中国比较医学杂志, 2012, 22(11): 50-53.
REN H T, ZHONG Z Y, ZHENG J L, RAO Z L, KUANG S S, WANG G, TANG X J. The establishment and appraisal of the methods for the extraction, separation and purification of rat tail collagen. Chinese Journal of Comparative Medicine, 2012, 22(11): 50-53. (in Chinese)
Differentiation of Porcine Muscle Stem Cells in Three-Dimensional Hydrogels
CHEN Yu, ZHU HaoZhe, CHEN YiChun, LIU Zheng, DING Xi, GUO Yun, DING ShiJie, ZHOU GuangHong
College of Food Science and Technology, Nanjing Agricultural University/National Meat Quality and Safety Control Engineering Technology Research Center/Key Laboratory of Meat Processing and Quality Control, Ministry of Education, Nanjing 210095
【Objective】 The objective of this study was to explore the differentiation effect of porcine muscle stem cells in three-dimensional hydrogels, and to provide a guidance for inducing muscle stem cells to differentiate into muscle tissue in vitro.【Method】 Some porcine muscle stem cells were respectively induced to differentiate under the conditions of 2D and 3D (2D condition means culturing cells in culture dishes; 3D condition means culturing cells in hydrogels). The RNA and protein samples of porcine muscle stem cells cultured in 2D were collected at proliferation, pre-differentiation, early differentiation, mature differentiation, and late differentiation, respectively, and those in 3D were also collected at day 7 and day 14 of differentiation, respectively. Then, RT-qPCR was used to compare the expression levels of the myogenic-related genes, including the genes ofand,under 2D and 3D differentiation conditions. Correspondingly, the Western Blot was used to detect the expression levels of MyHC protein and MYOG protein in the two conditions. Moreover, the immunofluorescence staining was used to observe the myotubes formed in cell culture dishes and hydrogels. Further, the amino acid content and composition of the cultured muscle tissue were analyzed by an amino acid automatic analyzer at day 14 of differentiation. 【Result】 The porcine muscle stem cells started to fuse to form myotubes at day 3 of differentiation in 2D. The myotubes formed in 2D matured at day 7 and divorced from culture dish afterwards. The porcine muscle stem cells were still globe and had low expression ofandat day 7 of differentiation in 3D. Multinucleated myotubes formed at day 14 and the expression ofandreached levels of 2D differentiation. The cells in hydrogels had higher expression of terminal differentiation genesandthan the cells in culture dishes. The expression ofwas 12 times that at day 7 in 2D and the expression ofwas 4 times that at day7 in 2D, but the expression of MyHC protein was only 1/6 that at day 7 in 2D. Amino acid analysis results showed that the contents of 17 hydrolyzed amino acids in cultured muscle tissue were all lower than those in pork, and the ratio of essential amino acids was also lower in cultured muscle tissue, but the ratio of flavor amino acids was higher. 【Conclusion】 The porcine muscle stem cells could differentiate into myotubes in 3D collagen hydrogels, and the 3D condition was positive to the expression of myogenic differentiation related genes, but further research was needed to achieve high expression of MyHC protein. The flavor amino acid content of the muscle tissue cultured in this way was high, which might mean good flavor.
porcine muscle stem cells; differentiation; hydrogels; myotubes; cultured meat

10.3864/j.issn.0578-1752.2022.22.014
2022-03-03;
2022-06-16
江苏省青年科学家自然科学基金(BK20200537)、江苏省重点研发计划(现代农业)(BE2020302)、国家重点研发计划(2021YFC2101400)、国家自然科学基金青年基金(32101991)、江苏省肉类生产与加工质量安全控制协同创新中心
陈彧,E-mail:2020808131@stu.njau.edu.cn。通信作者丁世杰,E-mail:shijieding@njau.edu.cn。通信作者周光宏,E-mail:guanghong. zhou@hotmail.com
(责任编辑 赵伶俐)

