发酵豆渣工艺的优化及对营养成分的影响
范阳,齐伟彪,朱崇淼,毛胜勇*
(1.南京农业大学动物科技学院,江苏 南京 210095;2.南京致润生物科技有限公司,江苏 南京 211124)
我国是一个畜牧生产大国,但同时也是一个饲料资源十分短缺的国家。据国家统计局报告显示,2020年,我国从国外进口玉米和大豆总量近11 163万t,而国内一些非常规饲料资源如豆渣等并未得到充分应用。因此,提高非常规饲料资源的利用率,对于缓解我国饲料资源短缺的意义重大[1]。豆渣是豆腐、豆浆等豆制品加工过程中的主要副产物,产量巨大。据报道,我国每年约产280万t湿豆渣[2]。豆渣营养丰富,但由于其含水量大(70%~80%),处理不当极易酸败变质,难以运输和贮存,这不仅限制了豆渣在饲料中的使用,而且造成了环境污染[3]。近年来的一些研究发现,使用微生物发酵技术有助于解决鲜豆渣使用过程中出现的问题[4]。Gupta等[5]研究发现,利用植物乳杆菌和少孢根霉混合发酵豆渣,可提高豆渣中单糖、短链脂肪酸等的小分子化合物的含量。Mok等[6]研究发现,利用枯草芽孢杆菌WX-17发酵豆渣,总氨基酸含量由发酵前的3.04 mg/g增加到了5.41 mg/g,且抗氧化物含量提高了6.4倍。Vong等[7]利用解脂耶氏酵母发酵新鲜豆渣,发现游离氨基酸的含量较发酵前增加了254%,且可溶性膳食纤维增加了176%,有效改善了豆渣适口性,同时还产生了发酵香气。因此,为提高豆渣的饲用价值,解决其存在的难长期贮存等问题。本试验拟利用基于植物乳杆菌(Lactobacillusplantarum)、枯草芽孢杆菌(Bacillussubtilis)和酿酒酵母(Saccharomycescerevisiae)的混合菌发酵主要含豆渣的混合饲料,研究豆渣发酵饲料制作过程中的相关参数,同时比较豆渣饲料发酵前后的营养价值,从而为发酵豆渣饲料的生产提供科学依据。
1 材料与方法
1.1 试验材料与菌种
发酵底物为豆渣和麸皮的混合物,二者的干物质比例为8∶2。为保证不同发酵批次之间所用的豆渣的营养价值稳定,本试验采用的豆渣为干豆渣,但在发酵过程中,根据发酵要求将其水分按实验设计做出相应调整,以模仿生产中的湿豆渣。植物乳杆菌、枯草芽孢杆菌和酿酒酵母皆来自南京农业大学动物科技学院消化道微生物实验室。试验用培养基购自奥博星公司(北京)。
1.2 试验方法
1.2.1 发酵种子液的制备
将冻存的植物乳杆菌、枯草芽孢杆菌和酿酒酵母分别接种于各菌种对应的液体种子培养基中,其中植物乳杆菌活化采用MRS培养基,枯草芽孢杆菌活化采用LB培养基,酿酒酵母活化采用YPD培养基,将植物乳杆菌置于37 ℃ 静置培养24 h,枯草芽孢杆菌置于37 ℃、160 r/min 摇床振荡培养48 h,酿酒酵母置于30 ℃、160 r/min 摇床振荡培养24 h。按1%的接种量将上述培养好的菌液接种到灭菌后的各菌种液体种子培养基中,扩大培养24 h,制成发酵种子液(植物乳杆菌的活菌数为8.96 lg CFU/mL;枯草芽孢杆菌的活菌数为8.21 lg CFU/mL;酿酒酵母的活菌数为7.70 lg CFU/mL)。
1.2.2 固态发酵方法
将上述混合好后的豆渣和麸皮分装至带有单向透气阀的聚乙烯袋(规格为 300 mm×200 mm),将培养好的发酵种子液按一定的接种量接种到固态发酵培养基中,搅拌均匀后封口,每袋500 g,37 ℃静置培养。
1.3 混菌发酵豆渣菌种比例优化
采用L9(34)正交试验设计,将各菌种按3个接种量进行三因素三水平正交试验,每个水平4个重复。按10%的接种量,在37 ℃、含水量为55%的固体发酵培养基(自然pH值)上发酵48 h,以发酵产物的pH值、活菌数(乳酸菌、芽孢杆菌和酵母菌)、乳酸(lactic acid, LA)、挥发性脂肪酸(volatile fatty acid, VFA)、还原糖(reducing sugar, RC)和总氮中氨态氮(NH3-N)的占比含量为指标,确定发酵豆渣饲料时各菌种的最佳接种比例(表1)。
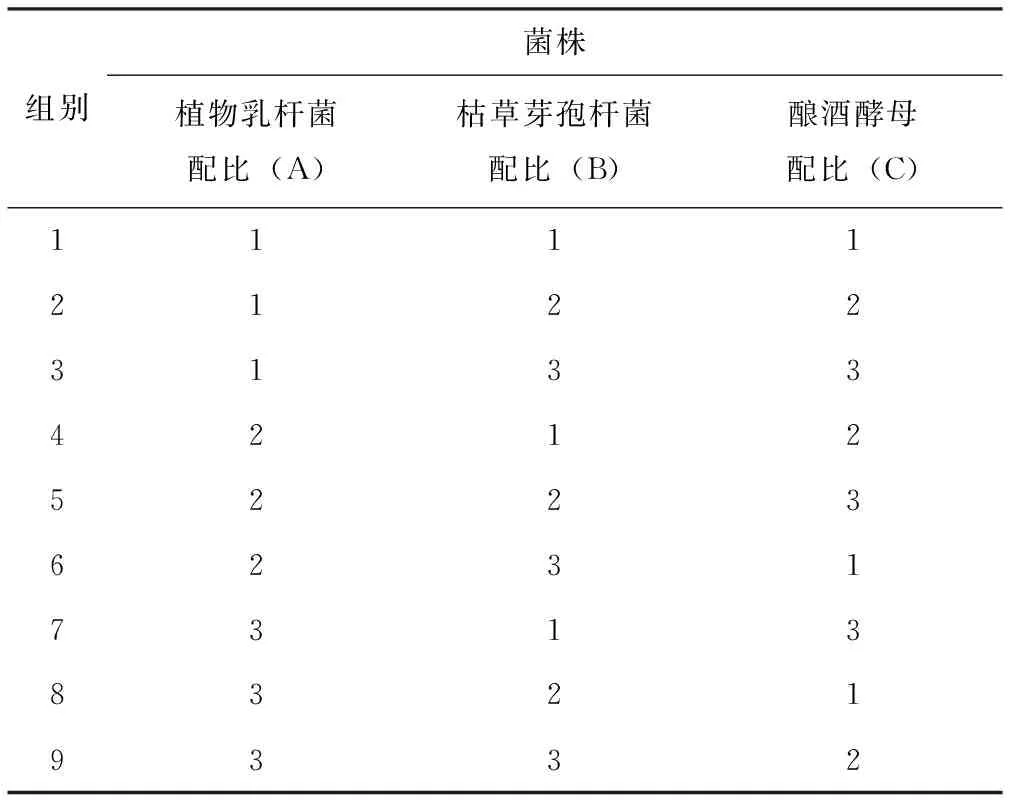
表1 接种菌种的最适比例的正交试验设计
1.4 发酵豆渣饲料的工艺条件优化
在确定3个菌种最佳接种配比之后,采用L9(34)正交试验设计,将接种量(A)、发酵时间(B)、固体发酵培养基的含水量(C)、发酵温度(D)4个因素进行优化,每个因素设3个水平,进行四因素三水平的正交试验(表2)。
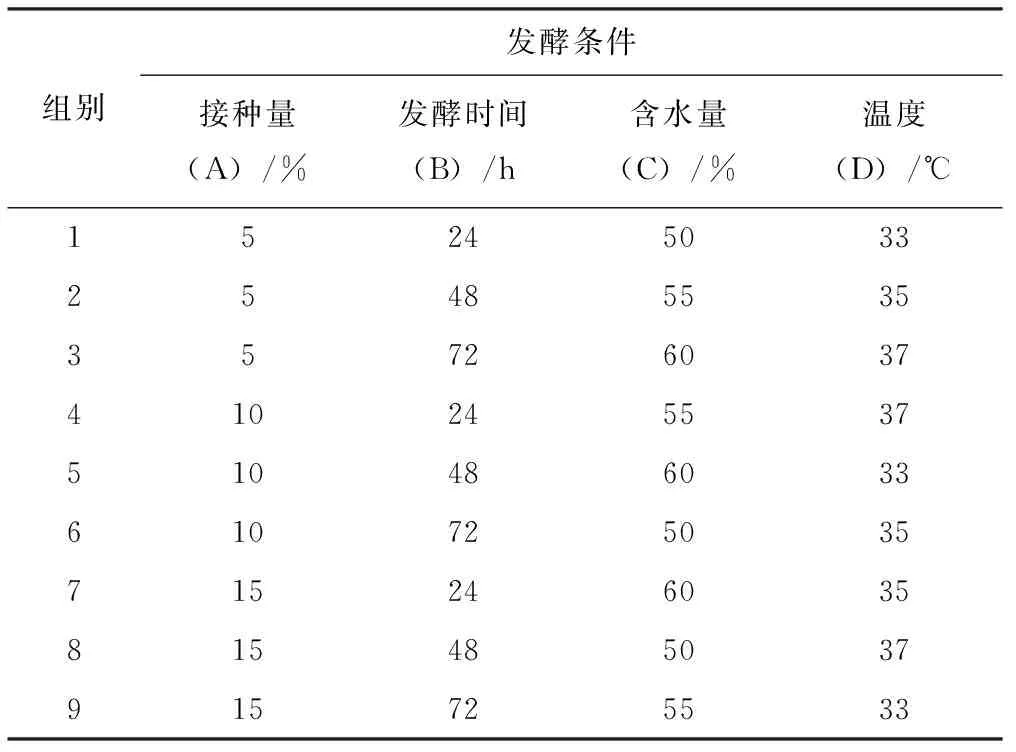
表2 发酵工艺条件优化的正交试验设计
1.5 测定指标与方法
1.5.1 发酵指标的测定
开袋后混匀各处理组的发酵产物,取发酵产物10 g,加入90 mL蒸馏水,搅拌混匀,置于4 ℃冰箱保存,样品浸泡24 h后过滤,得到的滤液即为样品的浸提液。浸提液一部分用来测定pH值,一部分置于-20 ℃下保存,用于测定LA、VFA、RC和NH3-N含量。采用HI-9024C便携式pH计(HANNA Instruments,美国)测定pH值,采用乳酸试剂盒(南京建成生物科技有限公司,南京)测定LA含量,采用气相色谱(GC-14B,岛津,日本)测定VFA的含量[8],采用苯酚—次氯酸钠法测定NH3-N含量[9],采用DNS法测定RC含量[10]。
1.5.2 活菌数的测定
在无菌条件下,取各处理组的发酵产物0.5 g,置于灭菌后的离心管中,加入4.5 mL生理盐水,混匀后进行梯度稀释,涂布法测定乳酸菌、芽孢杆菌和酵母菌的数量。使用MRS 培养基测定乳酸菌数量、LB 培养基测定芽孢杆菌数量、YPD 培养基测定酵母菌数量。具体操作参照张永根等[11]的方法。
1.5.3 营养成分含量的测定
取发酵样品200 g,105 ℃烘箱中烘至恒重,用于饲料常规养分的测定,具体方法参照李龙的报道[12]。酸溶蛋白含量的测定参照国家标准《大豆肽粉》(GB/T 22492—2008)中的方法进行测定。
1.6 数据统计与分析
试验数据采用Excel (2019) 进行初步整理,使用SPSS 26.0软件进行统计分析。其中,正交试验数据采用一般线性模型单变量进行方差分析,其他采用单因素方差分析(One-way ANOVA),并采用Duncan氏法进行多重比较检验,显著性水平为P<0.05。采用DPS 9.01软件中的TOPSIS法,根据各指标对发酵品质影响大小,给予不同的权重系数,即对发酵后的pH值、乳酸、活菌数(乳酸菌、芽孢杆菌和酵母菌之和)、还原糖、氨态氮与总氮的比值、乙酸、丙酸、丁酸分别赋予-2、2、1、1、-1、1、1、-1,再进行加权求和。
2 结果与分析
2.1 发酵豆渣最佳菌种组合研究
2.1.1 接种不同比例菌种组合对发酵指标的影响及其TOPSIS评分结果
由表3可知,9个试验组的pH值均小于4.50,其中第8组pH值最低为4.30。第3组的活菌数和还原糖含量均为最高。第8组的乳酸含量最高为68.75 μmol/g。第6组的乙酸和丙酸含量最高。第5组的丁酸含量最低为0.28 μmol/g。第9组的氨态氮/总氮最低为8.57%。用TOPSIS对上述试验结果进行多指标分析,结果表明第8组得分最高为0.646 3。

表3 接种不同比例菌种组合对发酵指标的影响及TOPSIS评分结果
2.1.2 接种不同比例菌种组合的正交试验结果
由表4中正交试验结果的R值分析可以看出,3个因素对TOPSIS评分的影响程度为B>A>C,即枯草芽孢杆菌对TOPSIS评分的影响最大,其次是植物乳杆菌,酿酒酵母对TOPSIS评分的影响最小。结合K值大小分析可得,此次试验中植物乳杆菌、枯草芽孢杆菌和酿酒酵母混合发酵豆渣的最佳接种组合为A3B2C1,即植物乳杆菌∶枯草芽孢杆菌∶酿酒酵母=3∶2∶1。
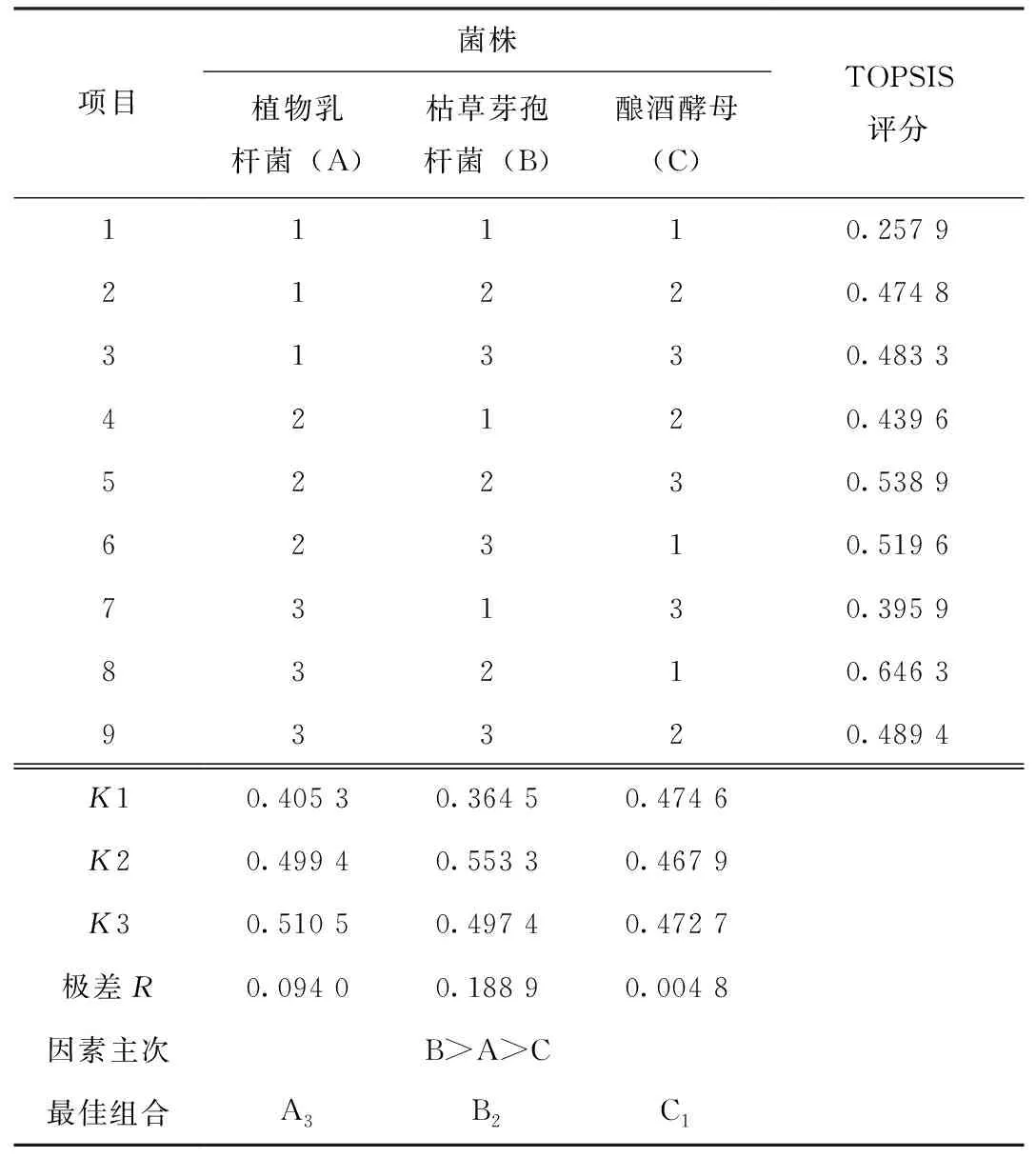
表4 不同菌种比例组合正交试验结果
2.2 发酵豆渣工艺条件优化
2.2.1 不同发酵工艺条件对发酵指标的影响及其TOPSIS评分结果
由5可知,第3组pH值最低为3.92。第2组活菌数最高为24.39 lg CFU/g。第8组的乳酸含量最高为90.53 μmol/g。第2组和第7组的乙酸含量最高。第9组的丙酸和还原糖含量最高。第6组的丁酸含量最低为0.28 μmol/g。第7组的氨态氮/总氮最低为1.95%。用TOPSIS对上述结果进行多指标分析,结果表明第6组得分最高为0.878 8。
2.2.2 不同发酵工艺条件组合的正交试验结果
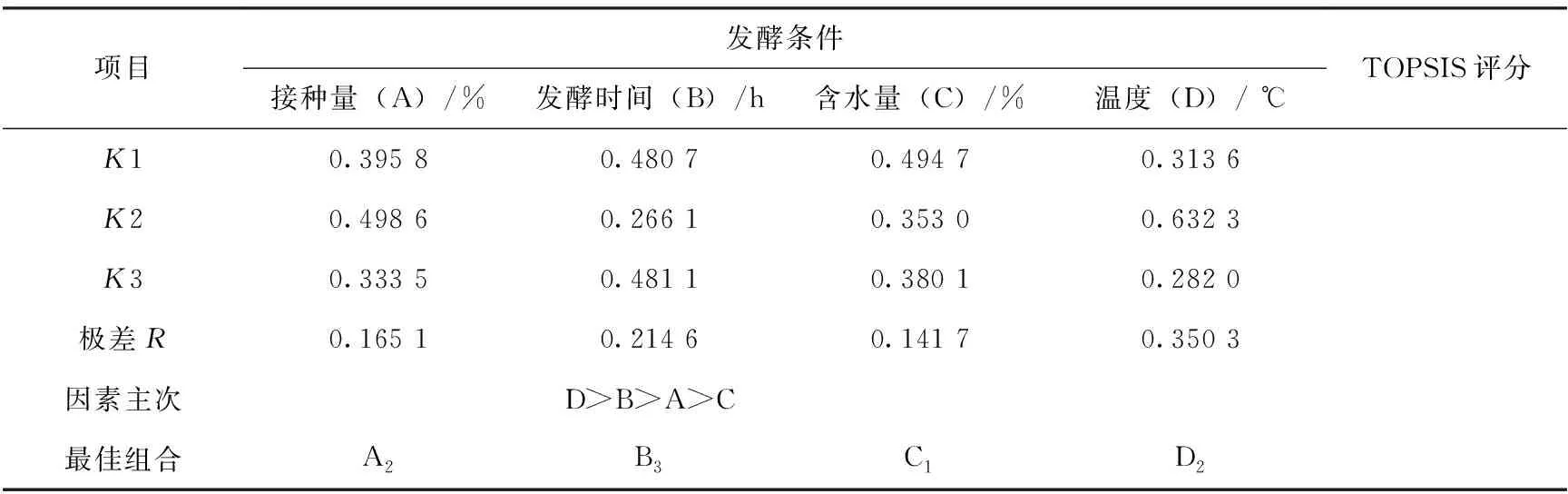
由表6中正交试验结果的R值分析可以看出,4个因素对TOPSIS评分的影响程度为D>B>A>C,即温度对TOPSIS评分的影响最大,其次是发酵时间和接种量,含水量对TOPSIS评分的影响最小。结合K值大小分析可得,3个菌种混合发酵豆渣工艺条件的最佳组合为A2B3C1D2,即在接种量为10%、发酵时间为72 h、含水量为50%、发酵温度为35 ℃的条件下,可以获得最优的发酵效果。
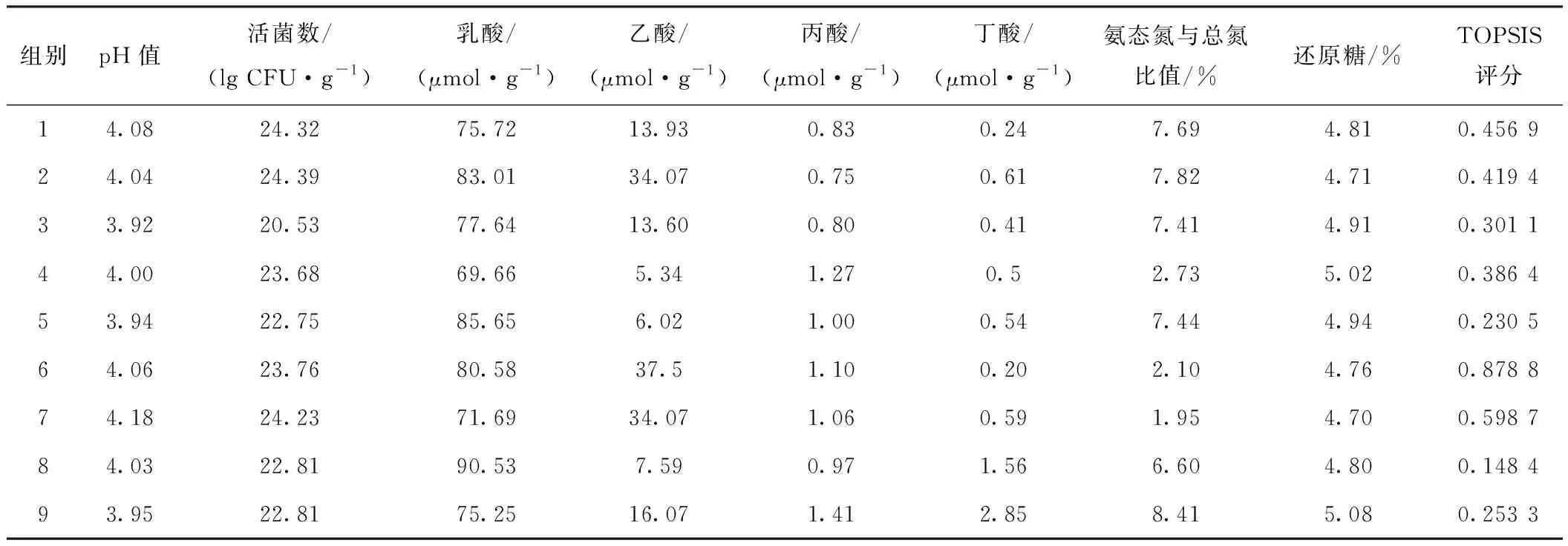
表5 不同发酵工艺条件对发酵指标的影响及其TOPSIS评分结果

表6 不同发酵工艺组合正交试验结果
续表6
2.3 豆渣饲料发酵前后营养成分及pH值的变化
如表7所示,豆渣饲料经优化后的最佳发酵工艺发酵后,显著提高了豆渣饲料的粗蛋白质、酸溶蛋白、粗灰分含量(P<0.05),显著降低了pH值(P<0.05)。发酵前后豆渣饲料的粗脂肪、粗纤维和酸性洗涤纤维含量无显著差异(P>0.05)。
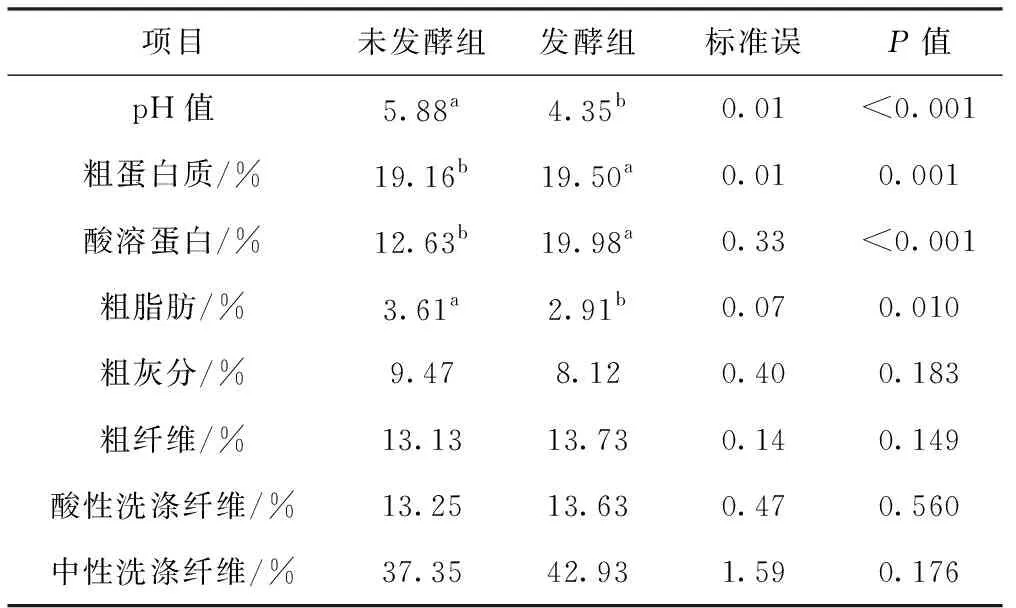
表7 豆渣饲料发酵前后营养物质含量(DM)及pH值的变化
3 讨论
乳酸菌、芽孢杆菌和酵母菌是常见的微生物添加剂,生产中发现,添加这些微生物制剂可促进动物生长,从而有利于维持动物肠道微生态平衡[13]。因此本试验采用植物乳杆菌、枯草芽孢杆菌和酿酒酵母发酵豆渣。发酵后饲料的pH值是评定发酵是否成功的重要指标[14],一般来说,优质的发酵饲料的pH值3.8~4.2[15]。本试验中,各发酵组的pH值均有不同程度的下降,其中最佳发酵组的pH值为4.06,达到了优质发酵饲料标准。本研究中所用的植物乳杆菌在发酵的过程中可利用大量发酵碳水化合物产生乳酸[16],而相关研究表明,高浓度的乳酸含量可以有效抑制饲料中病原菌的增殖,有助于肠道微生态的平衡[17]。本试验中,试验各组的乳酸浓度高于70 μmol/g,说明发酵豆渣饲料中含在大量的乳酸,不仅有利用于发酵豆渣饲料的保质,并有助于采食此类饲料的动物的消化道健康。丁酸是一种具有刺激性气味的挥发性脂肪酸,发酵饲料如果含有大量的丁酸,会导致其感官品质和动物的适口性下降[19]。本试验中,不同发酵组的丁酸浓度存在差异,说明丁酸的生成受到接种微生物数量和其他接种条件的影响。本试验以还原糖的含量来衡量复杂碳水化合物降解程度,发现不同组合和不同发酵条件下,各组中的还原糖的浓度存在显著差异,原因可能与各条件下芽孢孢杆菌的数量有关,一些报道显示,芽孢杆菌具有产纤维素酶和淀粉酶的功能[20]。因此,接种不同剂量的芽孢杆菌对底物中碳水化合物降解程度不一样,由此导致还原糖的数量不一样。NH3-N主要由微生物发酵蛋白质产生,其含量高低可反映原料在发酵过程中蛋白质被分解的程度。本试验中,各组发酵饲料中的NH3-N/TN均小于10%,表明各组发酵效果较好[21]。
TOPSIS法是一种常用的综合评价指标的方法,能够在系统工程中有限方案中进行多目标决策分析,其特点是对指标进行赋权,对参评对象做出评价[22]。本试验测定了pH值、活菌数、乳酸、乙酸、丙酸、丁酸、NH3/TN和还原糖的含量,在筛选最优组方过程中,不是某一组方的8个指标均为最优,但是通过TOPSIS综合评价法,分析得出9个组方中8个指标的最优方案,然后计算9个组方的各指标分别与最优方案的距离,以计算后的距离作为TOPSIS评分。结果表明,混菌发酵豆渣饲料的最佳工艺条件为:3株试验菌的接种比例为:植物乳杆菌∶枯草芽孢杆菌∶酿酒酵母=3∶2∶1、接种量为10%、固态培养基含水量为50%、温度为35 ℃、发酵时间为48 h。
乳酸菌、芽孢杆菌和酵母菌在发酵的过程中,可充分利用固态发酵培养基中的氮源和碳源进行繁殖,进而产生大量代谢产物,这些代谢产物有助于提高了发酵饲料的营养价值。豆渣经混菌发酵后,粗蛋白质含量由发酵前的19.16%提高到了19.50%。这部分增加的蛋白质一方面可能是微生物在发酵的过程中大量繁殖消耗了部分的有机物,使得产物总量减少,出现了蛋白质的“浓缩效应”[23]。酸溶蛋白是指由2~20个氨基酸残基所组成的小肽。豆渣饲料经混菌发酵后,酸溶蛋白含量为19.98%,较未发酵组提高了7.35%。本试验中酸溶蛋白含量的升高可能是由于接种的枯草芽孢杆菌产生的蛋白酶将豆渣饲料中的蛋白质水解为游离氨基酸。发酵后粗灰分和中性洗涤纤维的含量较发酵前显著提高,可能原因在于发酵的过程中,豆渣饲料中部分有机物被微生物利用,导致其干物质损失,使得它们的比例有所提高。Rashad等[24]研究发现,利用白假丝酵母NRRLY-12发酵新鲜豆渣,发酵产物较发酵前相比粗纤维含量下降了45.5%,粗脂肪含量下降了8.6%,而本试验中豆渣饲料经过固态发酵后,粗纤维含量没有显著变化,但粗脂肪含量显著降低,这可能是由于菌种不同导致对粗纤维的降解能力不同的结果。
4 结论
综上所述,植物乳杆菌、枯草芽孢杆菌和酿酒酵母混合发酵豆渣饲料的最优工艺条件为植物乳杆菌∶枯草芽孢杆菌∶酿酒酵母的配比=3∶2∶1、接种量为10%、固态培养基含水量为50%、温度为35 ℃、发酵时间为48 h。且豆渣经过微生物发酵后,pH值显著下降,酸溶蛋白含量显著上升,营养价值得到改善。

