热应激对大鼠脾脏组织形态学及TLR2/4表达的影响
陈 玲,董 川,张志雷
(1.甘肃农业大学 体育教学部,甘肃 兰州 730070;2.菏泽学院 体育与健康学院,山东 菏泽 274015)
随着全球气候的逐渐变暖,高温已成为影响人类和动物健康的重要环境应激源之一.在外界的高温环境刺激下,动物的体表温度超出了自身体温调节能力的范畴,进而对机体组织器官造成不同程度的损伤(热应激).研究表明,热应激不仅会影响机体的生长发育[1-2]、生产性能和繁殖性能[3-5],也会导致其免疫机能紊乱[6],进而增加许多疾病风险,对人体健康和畜牧养殖业经济构成很大的威胁.Toll样受体(TLRs)作为一类位于哺乳动物细胞表面的跨膜信号受体,在机体的先天性和获得性免疫应答中均发挥着关键性的调控作用.这种免疫应答反应不仅表现在宿主应对外源性病原微生物感染方面,也体现在识别内源性细胞损伤后释放的危险信号方面[7].TLRs与其配体特异性结合后,可通过合成并分泌一系列细胞因子以及促进黏附分子的表达,从而激活宿主的免疫防御系统[8].TLRs基因家族内含有很多成员,目前在哺乳动物中至少鉴定到13个成员[9],最具代表性且在免疫防御系统中发挥核心作用的成员是Toll样受体2(TLR2)和Toll样受体4(TLR4).TLR2在不同组织细胞中广泛存在,但主要在巨噬细胞等免疫细胞中表达,在机体抵御外源微生物侵袭的先天性免疫中起重要调控作用[10-11].TLR4作为膜型Toll样受体之一,也在机体的免疫应答和炎症反应中发挥重要作用[11].
截至目前,关于热应激对哺乳动物免疫相关组织器官中TLR2和TLR4基因表达影响的研究报道较少,且TLR2和TLR4在不同热应激状态下的生物学功能尚不明确.鉴于此,本研究通过建立不同高温条件及不同持续时间的大鼠热应激模型,比较观察不同热应激条件下脾脏的组织形态学差异,分析不同热应激条件对脾脏中免疫相关基因TLR2和TLR4的表达及其编码蛋白阳性信号分布位置的影响,旨在探究热应激对大鼠脾脏组织结构以及TLR2和TLR4的表达调控作用,为更深入探究由TLR2/4介导的免疫相关通路在动物热应激免疫防御中的分子调控机制提供科学依据.
1 材料与方法
1.1 材料
8周龄成年雄性Wistar大鼠,由中国农业科学院兰州兽医研究所动物实验中心提供;焦碳酸二乙酯(DEPC)、RNA提取试剂、反转录试剂盒(StarScript II Green Fast Two-Step qRT-PCR Synthesis Kit)、荧光定量PCR试剂盒(2×RealStar Green Fast Mixture)等均购自北京GenStar康润生物公司;苏木精染液、伊红染液、中性树胶购自碧云天生物公司;一抗(Rabbit Anti-TLR2,Rabbit Anti-TLR4,Rabbit Anti-beta-Actin)、二抗(Goat Anti-rabbit IgG/HRP)购自北京博奥森生物技术有限公司;EDTA抗原修复缓冲液、自发荧光淬灭剂、牛血清白蛋白(BSA)、4′,6-二脒基-2-苯基吲哚(DAPI)染液、抗荧光淬灭封片剂染液购自武汉赛维尔公司.
1.2 方法
1.2.1 动物分组及组织收集 选用健康状况良好、体重相似(270~290 g)的8周龄成年雄性Wistar大鼠30只.适应性饲养1 d后,将其随机分为5组(n=6),即对照组(CG)、38 ℃单次热应激组(38 ℃-单激组,38 ℃-SHSG)、38 ℃多次热应激组(38 ℃多激组,38 ℃-MHSG)、43 ℃单次热应激组(43 ℃单激组,43 ℃-SHSG)、43 ℃多次热应激组(43 ℃多激组,43 ℃-MHSG).对照组大鼠在温度18~22 ℃、相对湿度30%左右条件下饲养,38 ℃单激组和43 ℃单激组分别在38 ℃和43 ℃智能人工气候培养箱中(提供充足饮水)持续热处理6 h,而38 ℃多激组和43 ℃多激组分别于每天中午12:00~14:00在38 ℃和43 ℃智能人工气候培养箱中进行热处理2 h,连续处理3 d,共计6 h.所有热处理组其余时间的饲养条件与对照组一致.热处理结束后,立即颈部脱臼处死所有大鼠,迅速采集各处理组脾脏组织,一部分组织样品放入DEPC水处理过的1.5 mL冻存管后迅速投于液氮中,之后转入-80 ℃冰箱保存,用于提取总RNA;另一部分放入4%的多聚甲醛溶液中固定后,用于包埋组织蜡块.
1.2.2 总RNA提取及cDNA合成 各脾脏组织分别经液氮迅速研成粉末后,用总RNA提取试剂提取组织总RNA,并经DEPC处理水溶解.用超微量分光光度计(Nanodrop ND-2000, 美国Thermo公司)检测总RNA浓度和纯度,选取A260/A280=1.8~2.0的RNA样品经1%的琼脂糖凝胶电泳检测其完整性,选择完整性好的RNA将其浓度调整为200 ng·μL-1,按照反转录试剂盒操作说明,合成第一链cDNA,并将其保存于-20 ℃冰箱用于实时荧光定量PCR(qRT-PCR).
1.2.3 引物设计与合成 根据NCBI/GenBank数据库中提供的大鼠TLR2、TLR4和β-actin基因的mRNA序列,使用软件Oligo 6.0设计引物,并用BLAST对引物特异性进行检测,引物由西安擎科泽西生物公司进行合成,相关信息列于表1.

表1 引物序列信息
1.2.4 qRT-PCR 按照荧光定量PCR试剂盒建议的方法,以优化后的条件进行qRT-PCR扩增(以β-actin作为内参基因).反应体系为20 μL:上下游引物(10 μmol·L-1)各0.4 μL, 2×RealStar Green Fast Mixture 10 μL, cDNA 0.4 μL, ddH2O 8.8 μL.采用优化后的两步法反应程序,即94 ℃ 2 min,94 ℃ 15 s,60 ℃ 30 s,40个循环进行基因扩增.实验结束后采集Ct值,采用2-ΔΔCt方法[12]进行目的基因表达量的计算.每个样本设计4个重复.
1.2.5 HE染色 不同处理组脾脏组织石蜡切片经二甲苯脱蜡,递减浓度梯度酒精脱水后,用苏木精染液染色5 min,1%的盐酸-酒精分化液分化5 s,0.5%的伊红染液染色2 min.然后在系列递增浓度梯度酒精中脱水,并于二甲苯中透明,中性树胶封片后,于光学显微镜(宁波舜宇显微镜)下观察并拍照.
1.2.6 免疫荧光染色 石蜡切片经二甲苯透明,递减梯度酒精脱水后,置于盛满EDTA抗原修复缓冲液(pH=9.0)中于微波炉内进行抗原修复.加入自发荧光淬灭剂5 min,流水冲洗后,滴加BSA室温封闭30 min.甩掉封闭液,滴加稀释后的一抗TLR2(1∶3000)和TLR4(1∶3500)后,放于湿盒内4 ℃孵育过夜.滴加与一抗相应种属的二抗,室温孵育50 min(避光).滴加DAPI染液,室温复染10 min(避光).抗荧光淬灭封片剂封片后,切片于荧光显微镜下观察并采集图像.
1.2.7 数据统计与结果分析 采用SPSS 19.0软件进行单因素方差分析和显著性检验,结果用平均值±标准差表示,P<0.05表示差异显著.
2 结果
2.1 不同热应激条件下大鼠脾脏组织形态学比较
由HE染色结果(图1)可知,在对照组的大鼠脾脏组织中,红髓与白髓界限比较明显,白髓较多,而在各处理组的大鼠脾脏组织中,红髓与白髓界限不明显,白髓所占比例减少,而红髓比例增加.与38 ℃处理组相比,在43 ℃处理组中,白、红髓界限更加模糊,脾窦严重萎缩,位于红髓内的红细胞数量明显减少.与单激组相比,多激组中位于白髓和红髓之间的边缘区明显变宽.
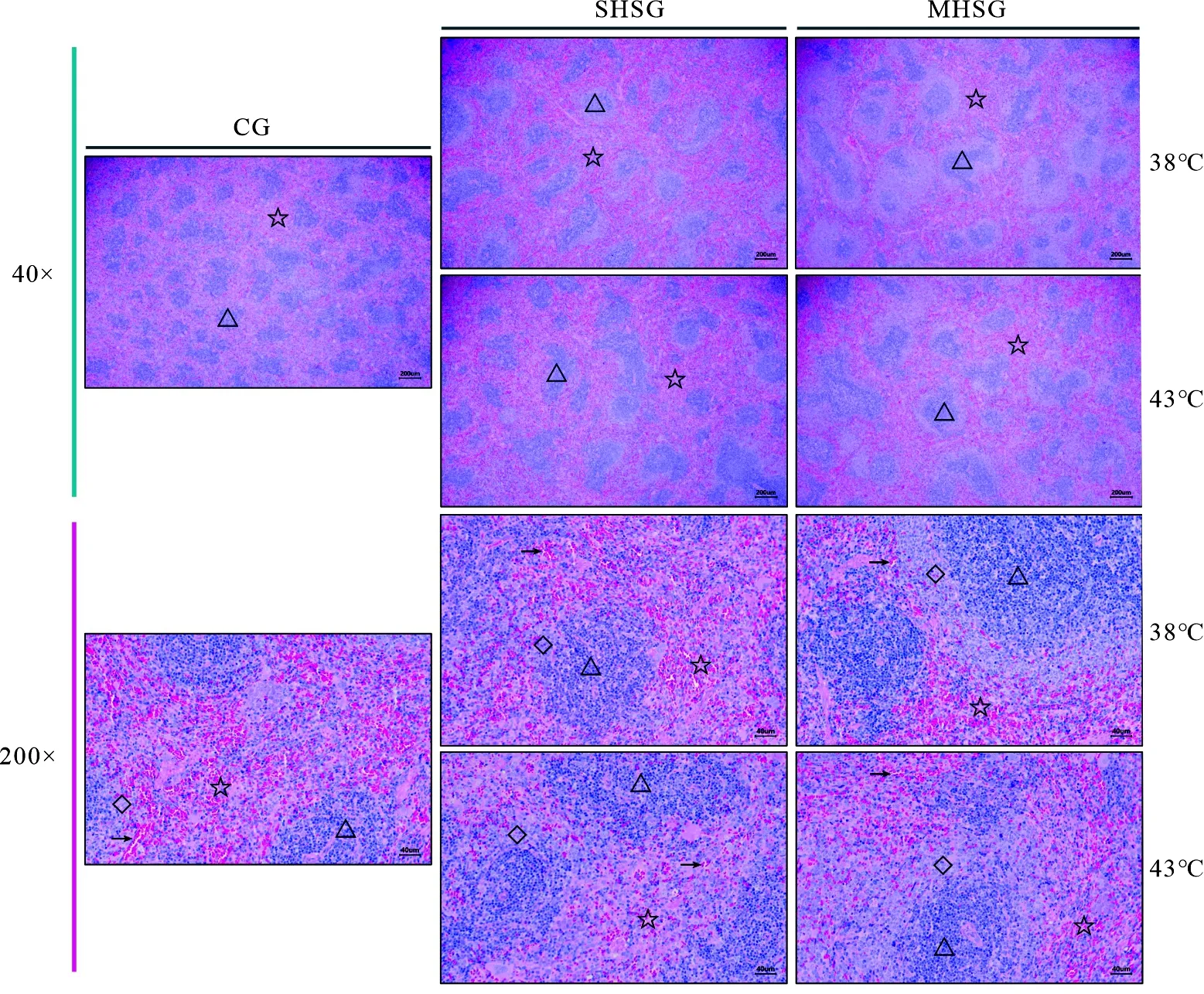
△ 白髓;☆ 红髓;→ 脾窦;◇ 边缘区
2.2 不同热应激条件下大鼠脾脏中TLR2和TLR4基因表达水平
由qRT-PCR结果(图2)可知,不同处理组大鼠脾脏中TLR2和TLR4 mRNA的表达趋势相似.与对照组相比,TLR2和TLR4 mRNA表达量在38 ℃热应激条件下上调,而在43 ℃热应激条件下调.在38 ℃热应激条件下,多激组中TLR2和TLR4 mRNA表达量低于单激组,而在43 ℃热应激条件下,多激组中TLR2和TLR4 mRNA表达量高于单激组.这可能是由于43 ℃(相比38 ℃)超出了大鼠机体本身可调节的高温阈值,对大鼠脾脏组织的免疫功能造成严重的损伤所导致,并且温度越高、持续时间越长,这种损伤作用就越明显.
2.3 不同热应激条件下大鼠脾脏中TLR2和TLR4蛋白的阳性信号分布特征
由TLR2和TLR4蛋白的免疫荧光染色结果(图3)可知,不同处理组脾脏组织中TLR2和TLR4蛋白的免疫阳性信号表达强度与mRNA表达趋势类似:在相同处理组中,TLR4蛋白阳性信号(绿色)强于TLR2蛋白(红色);与对照组(图3A2-A3)相比,38 ℃热激组中TLR2和TLR4蛋白阳性信号明显增强(图3B2-B3,C2-C3),而43 ℃热激组中TLR2和TLR4蛋白阳性信号明显减弱(图3D2-D3,E2-E3).在不同处理组大鼠脾脏组织中,TLR2和TLR4蛋白阳性信号均定位于红髓巨噬细胞的细胞膜上(图3A2-E2,A3-E3).此外,对于TLR2蛋白而言,其强烈定位于对照组和38 ℃热激组脾索中(图3A2-C2),并且与对照组相比,其在各热激组中也定位于边缘区巨噬细胞的细胞膜上(图3B2-E2);对于TLR4蛋白而言,其在各处理组中也定位于边缘区巨噬细胞的细胞膜上(图3A3-E3),并且在对照组和38 ℃热激组中也定位于白髓巨噬细胞的细胞膜上(图3A3-C3).
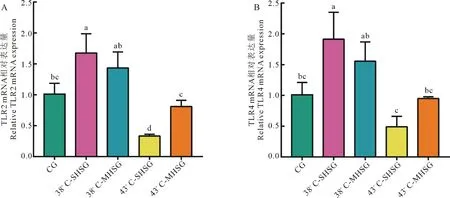
A TLR2 mRNA相对表达量;B TLR4 mRNA相对表达量.内参基因:β-actin,n=4,不同小写字母表示组间差异显著(P<0.05)
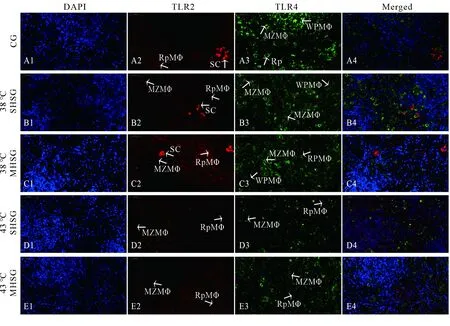
A1~E1. DAPI核染(蓝色);A2~E2. TLR2阳性细胞(红色);A3~E3. TLR4阳性细胞(绿色);A4~E4. TLR2和TLR4阳性细胞的共定位;WpMΦ.白髓巨噬细胞;RpMΦ.红髓巨噬细胞;MZMΦ.边缘区巨噬细胞;SC.脾索
3 讨论
热应激可影响动物机体的免疫器官发育及免疫应答过程[13-15],其对机体免疫功能的影响主要表现在淋巴细胞数量发生变化、巨噬细胞活性降低、免疫细胞群改变等方面[16],但这种影响程度因热应激条件的不同而存在很大差异.脾脏作为动物体最大的免疫器官,在免疫防御应答中扮演着十分重要的角色.Park等[14]通过比较转录组学研究发现,在热应激条件下,鸡(Gallusgallus)脾脏中许多与免疫应答和炎症反应相关的信号通路被激活.Ma等[17]运用基于iTRAQ技术的蛋白质组学比较分析正常和热应激肉鸡脾脏中的差异表达蛋白质发现,与正常组相比,热处理组中与先天性免疫应答相关的差异蛋白表达下调.说明热应激具有免疫敏感性,但不同热应激条件下免疫相关基因的表达调控作用及免疫应答机理并不相同.动物器官、组织、细胞结构是其生理活动和功能运行的物质基础,而组织形态学作为研究组织器官形态结构的常用方法和技术手段,是直观、快速检测外界刺激物对组织形态影响的最有效方法之一.为了明确热应激对大鼠脾脏组织发育的影响,本研究基于HE染色对不同热激组(38 ℃和43 ℃单激组、38 ℃和43 ℃多激组)脾脏组织形态学进行比较观察发现,与对照组相比,各热处理组大鼠脾脏组织中的白髓所占面积减小,而红髓区域增多,位于红髓中的脾窦萎缩,并且相比38 ℃热激组,在43 ℃热激组中脾窦的萎缩程度更加严重.这与何玉林等[18]在热应激小鼠及Ren等[19]在冷应激鹌鹑脾脏中的组织形态学观察结果相似,表明热应激可导致大鼠脾脏组织形态结构发生改变,并且温度越高,变化越显著.此外,本研究发现,38 ℃和43 ℃多激组脾脏中的边缘区明显增加(与单激组相比).边缘区处于白髓与红髓的交界处,细胞排列疏松程度介于红髓和白髓之间,由巨噬细胞、B细胞、T细胞等构成[20],是脾内免疫应答的主要场所.说明与长时间持续性热应激相比,短时间间隔性的热应激可能对机体的免疫功能起到促进或改善作用.以上结果表明,由热应激造成的大鼠脾脏组织形态学结构的改变可能是其免疫机能发生改变的主要原因,并且由于不同热应激条件对大鼠脾脏组织形态学的影响不完全相同,因而对其免疫机能的影响也可能存在差异.
TLRs基因家族成员(如TLR2和TLR4)在免疫应答,尤其是获得性免疫应答中扮演十分重要的角色,但是关于其在热应激中的研究仍然很少,并且在热应激过程中所发挥的分子生物学功能尚不明确.为了探究热应激对大鼠脾脏中TLR2和TLR4表达模式及其生物学功能的影响,本研究首先通过qRT-PCR分析发现,与对照组相比,TLR2和TLR4在38 ℃热激组脾脏中的表达量上调.与此研究结果相一致,Quinteiro-Filho等[16]在肉仔鸡上研究发现,与常温组相比,TLR2和TLR4在热激组(31 ℃)脾脏中的表达量上调.然而,本研究发现,在43 ℃热激组大鼠脾脏中TLR2和TLR4的表达又出现显著下调.这可能是由于不同强度的热应激对动物机体免疫机能的影响不同所造成.强烈的热应激可对机体的生长发育、免疫功能和抗疾病能力产生负面影响,而适度或轻微的热应激可增强机体的免疫机能,进而提高对外界刺激的耐受性[21].黄长文[22]也研究发现,轻度的热应激可促进大鼠脾脏源巨噬细胞的吞噬、杀伤和趋化作用,进而增强其免疫机能.由此推测,38 ℃的热环境可能在大鼠可以承受的温度范围内,在此条件下,脾脏组织可通过上调TLR2和TLR4,进而激活由其介导的免疫相关信号通路,以应对热应激对脾脏的损伤作用,但当温度达到一定界限后,脾脏组织结构严重受损,尚不能通过免疫应答作用应对这种损伤,使得免疫相关通路被抑制甚至被破坏,从而导致脾脏中TLR2和TLR4表达量降低.此外,与对应的单激组相比,38 ℃多激组大鼠脾脏中TLR2和TLR4表达上调,而43 ℃多激组大鼠脾脏中TLR2和TLR4表达下调,这可能是由于在适度的热应激刺激下,机体的免疫机能增强,并且免疫功能与刺激持续时间正相关,因而TLR2和TLR4的表达量随着热应激持续时间的延长而增加.然而,与其恰好相反的是,在剧烈的热应激刺激下,由于脾脏组织严重受损,其所执行的免疫功能也被严重破坏或抑制,因而TLR2和TLR4基因的表达下调,但与长时间持续性的热应激相比,短时间的热应激可以在一定程度上缓解其对脾脏免疫功能的损伤和破坏.
通过免疫荧光染色发现,TLR2和TLR4蛋白阳性信号的表达模式均与其mRNA基本一致,表明热应激造成TLR2和TLR4基因在转录和蛋白水平发生了相似的表达变化特征.TLR2蛋白阳性反应分布于各处理组红髓巨噬细胞膜上,并且在对照组和38 ℃热激组的脾索及各热激组边缘区巨噬细胞膜上也有分布,而TLR4蛋白阳性反应分布于各处理组红髓及边缘区巨噬细胞膜上,并且也存在于对照组和38 ℃热激组中的白髓巨噬细胞膜上.脾脏组织主要由3部分构成,即白髓、红髓和边缘区,每一部分都含有自己独特的巨噬细胞群,在宿主免疫防御过程中发挥着不同的功能[23],并且由于巨噬细胞具有“双刃剑”作用,在不同的环境条件下被赋予不同的角色和使命.一方面,其可保护组织完整性,并且可吞没、破坏受损伤的组织,修复组织损伤;另一方面,在某些条件下,也是组织的主要破坏者[24].由此可知,TLR2和TLR4基因可能作为膜型受体,主要参与调控大鼠脾脏巨噬细胞的免疫应答,并且在不同热应激状态下,不同的TLR2和TLR4基因表达模式使其介导的免疫应答过程及其机制不同,因而所发挥的免疫防御功能存在差异.在38 ℃热激组中,热环境可激活由TLR2和TLR4介导的相应的脾脏巨噬细胞免疫调控通路,进而增强机体的免疫防御机能;而在43 ℃处理组中,由于剧烈的热环境使得脾脏原有的正常组织结构及生理功能明显发生改变,因而免疫防御机能被抑制或破坏.但是,由TLR2和TLR4所介导的脾脏不同部位巨噬细胞应对热应激的具体免疫应答分子机制尚需进行更深入的探究.

