结直肠癌中DPD与LC3、P62表达的相关性及其临床意义
贾真真,何 双,李扬扬,温菲菲,许晓阳,郭宁杰,吴淑华
滨州医学院附属医院病理科,山东 滨州 256600
结直肠癌(colorectal cancer,CRC)是一种常见的消化系统恶性肿瘤,在中国恶性肿瘤的发病率中居第3位[1]。以5-氟尿嘧啶(5-fluorouracil,5-FU)为基础的化疗方案仍然是治疗结直肠癌的一线方案[2]。但应用5-FU作为一线抗癌药物治疗结直肠癌时,常因耐药或不良反应导致疗效不佳。
DPYD基因编码的二氢嘧啶脱氢酶(dihydropyrimidine dehydrogenase,DPD)是5-FU代谢的关键酶[3],可将进入体内约85%的5-FU分解为无活性的二氢氟尿嘧啶。DPD蛋白与5-FU的疗效密切相关,其异常表达可使结肠癌细胞获得耐药性[4]。因此,降低DPD的表达量或提高DPD的降解率均有可能成为解决5-FU耐药问题的重要思路。本文通过应用免疫组织化学法、蛋白质印迹法(Western blot)及实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR),检测细胞内蛋白质降解重要途径之一的自噬-溶酶体途径中关键因子微管相关蛋白轻链3(light chain 3,LC3)和P62的表达,分析DPD的表达与LC3、P62的相关性,探讨其临床意义,为逆转结直肠癌对5-FU的耐药性提供新思路。
1 材料和方法
1.1 材料
收集2013—2014年滨州医学院附属医院病理科存档的具有完整随访资料的结直肠癌标本157例。纳入标准:根据2019版世界卫生组织(World Health Organization,WHO)消化系统肿瘤分类标准,由两名资深病理科医师采用双盲法重新阅片诊断为原发性结直肠癌。所有病例均为首次手术治疗,术前均未行任何放化疗,术后均应用以5-FU为基础的FOLFOX方案为一线化疗方案。157例结直肠癌患者中,男性81例,女性76例。年龄36~88岁,平均60.3岁。肿瘤直径<5 cm者67例,≥5 cm者90例。分化程度:高分化27例,中分化102例,低分化28例。组织学类型:管状腺癌104例,管状黏液腺癌21例,黏液腺癌32例。浸润深度:黏膜及黏膜下层10例,侵犯肌层24例,侵及或侵透外膜者123例。有淋巴结转移者36例,无淋巴结转移者121例。每年进行电话或门诊随访,随访截至2020年12月或患者死亡,失访者不予入组。
1.1.2 新鲜标本
收集2020年滨州医学院附属医院病理科接收的新鲜结直肠癌标本44例,以癌旁正常肠黏膜组织作为对照,所有组织一部分即时液氮冻存,一部分置入4%甲醛溶液中固定。
1.1.3 试剂
LC3、P62及DPD抗体均购自美国Abcam公司,羊抗兔/鼠二抗及免疫组织化学试剂盒购自北京中杉金桥生物技术有限公司。Western blot所需试剂购自上海碧云天生物技术有限公司。RTFQ-PCR实验所需的RNAiso Plus、RT试剂盒及PCR试剂盒均购自日本Takara公司,所需特异性引物序列由日本Takara公司合成。
1.2 方法
1.2.1 免疫组织化学EnVision法
2.2 伤口评估 此次手术为乳腺癌改良根治术,位于右侧胸部可见一约2.5 cm×9.8 cm的伤口,为中度皮瓣坏死。25%的黄色腐肉;75%的黑色坏死组织,可见黑色缝线外露。患者主诉局部疼痛伴压痛,有中等量黄色、淡红色渗液,无异味。伤口周围皮肤不整齐、红肿,皮肤温度稍高于正常。
将4 μm切片脱蜡至水,用乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)(pH=8.0)修复液进行抗原修复,3%H2O2去除内源性过氧化物酶,加入一抗4 ℃过夜,二抗37 ℃温育30 min,二氨基联苯胺(diaminobenzidine,DAB)显色,苏木精复染,脱水透明,中性树胶封片。用已知LC3+的胃癌组织、P62+的宫颈癌组织、DPD+的肝癌组织作为阳性对照,用磷酸缓冲盐溶液(phosphate-buffered saline,PBS)代替一抗作为阴性对照。
1.2.2 Western blot
将冷冻于-80 ℃冰箱的新鲜组织经液氮冷冻研磨破碎后经RIPA裂解,应用二辛可宁酸(bicinchoninic acid,BCA)蛋白定量试剂盒检测蛋白浓度。样品煮沸后进行电泳。含有吐温-20三乙醇胺缓冲盐溶液(tris-buffered saline Tween,TBST)洗涤10 min×3次,5%的牛奶室温摇床封闭2 h;一抗4 ℃温育过夜;TBST洗涤10 min×3次;二抗室温温育2 h;TBST洗涤10 min×3次,电化学发光(electrochemical luminescence,ECL)曝光,用Quantity One软件分析目的蛋白和GAPDH的吸光度(D)值,以目的蛋白与GAPDHD值的比值作为目的蛋白的相对表达量。
1.2.3 RTFQ-PCR检测
按照TRIzol试剂盒说明书提取组织RNA并检测其浓度,在37 ℃ 15 min、85 ℃ 5 s条件下将RNA反转录成cDNA。PCR采用SYBR Green相对定量PCR法,按照试剂盒说明书配制25 μL体系反应液,在CFX96T RTFQ-PCR Detection System C1000上进行扩增(表1)。反应条件:95 ℃30 s(合计40个循环),95 ℃ 5 s,60 ℃ 30 s。采用ΔΔCt法检测,样品相对表达量用2-ΔΔCt表示,ΔΔCt=结直肠癌ΔCt-正常结直肠黏膜组织ΔCt,ΔCt=目的基因Ct值-GAPDHCt值。实验重复3次,结果取平均值。

表1 RTFQ-PCR引物序列Tab.1 RTFQ-PCR primer sequence
1.3 免疫组织化学结果判读标准
LC3主要表达于细胞膜或细胞质中,P62主要表达于细胞核或细胞质中,以出现棕黄色为阳性标志。在低倍镜下观察10个独立视野,选取5个阳性细胞数最多的视野,根据细胞染色强度和阳性细胞比例判定实验结果:细胞无染色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分;阳性细胞数≤5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分。将两项评分结果相乘,≥4分判为阳性。所有染色结果均由两名高年资病理科医师双盲阅片得出结论。
DPD主要表达于细胞膜或细胞质中,在低倍镜下观察10个独立视野,选取5个阳性细胞数最多的视野,采用Image Pro 6.0软件进行半定量分析,检测视野阳性区域的积分光密度(integral optical density,IOD)值,取其平均值。
1.4 统计学处理
所有数据均采用SPSS 20.0软件进行统计分析。运用Graph Pad 7.0、ImageJ软件进行图像和数据处理,组间比较采用配对t检验,计数资料采用χ2检验及矫正χ2检验进行统计分析;生存分析采用Kaplan-Meier法,并以log-rank法检验;采用COX比例风险回归模型进行多因素生存分析。P<0.05为差异有统计学意义。
2 结 果
2.1 结直肠癌与正常黏膜组织中LC3、P62及DPD的表达
免疫组织化学结果显示,LC3及DPD主要表达于细胞质中,P62表达于细胞核和细胞质中。157例结直肠癌患者中,LC3、P62及DPD的阳性率分别为50.3%、68.8%及56.7%,其表达均高于正常黏膜组(P<0.05,图1,表2)。
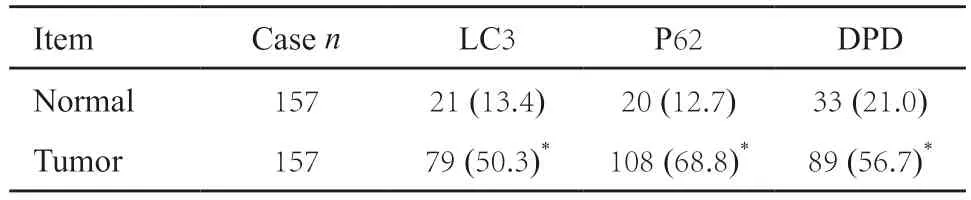
表2 结直肠癌和正常黏膜中DPD、LC3及P62的表达Tab.2 The expression of LC3,P62 and DPD in colorectal cancer and normal tissues[n (%)]

图1 结直肠癌及正常组织中LC3、P62及DPD的表达Fig.1 The expression of LC3,P62 and DPD in colorectal cancer and normal tissues
Western blot结果显示,结直肠癌组织中LC3、P62及DPD的表达量均高于正常黏膜组织,差异有统计学意义(P<0.05,图2)。
RTFQ-PCR结果显示,结直肠癌组织中LC3、P62及DPD mRNA的相对表达量均高于正常黏膜组织,差异有统计学意义(P<0.05,图2)。
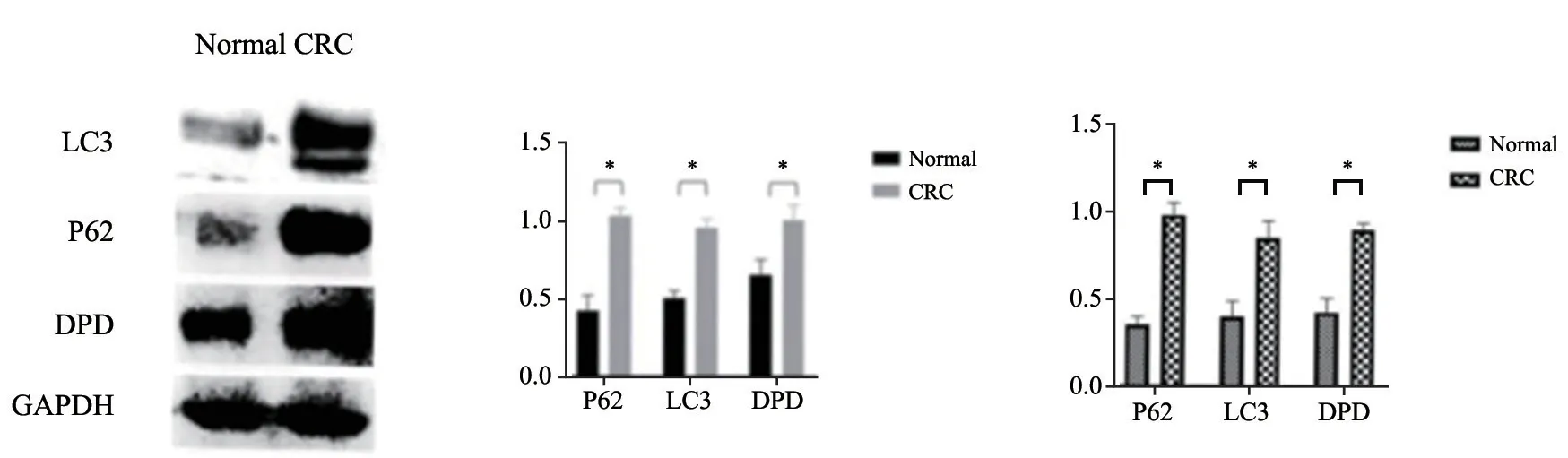
图2 Western blot及RTFQ-PCR检测LC3、P62及DPD在正常黏膜及结直癌组织中的表达Fig.2 The expression of LC3,P62 and DPD in colorectal cancer and normal tissues by Western blot and RTFQ-PCR
2.2 结直肠癌中LC3、P62及DPD表达的相关性
根据DPD的免疫组织化学染色结果,将157例结直肠癌患者分为DPD+组和DPD-组,分析LC3、P62及DPD蛋白表达之间的相关性。结果显示,DPD+组中,P62的表达高于DPD-组,而LC3的表达则低于DPD-组,差异均有统计学意义(P均<0.05,表3)。Spearman相关分析显示,P62与DPD的表达呈正相关(r=0.160),而LC3与DPD的表达则呈负相关(r=-0.200),差异均有统计学意义(P均<0.05)。
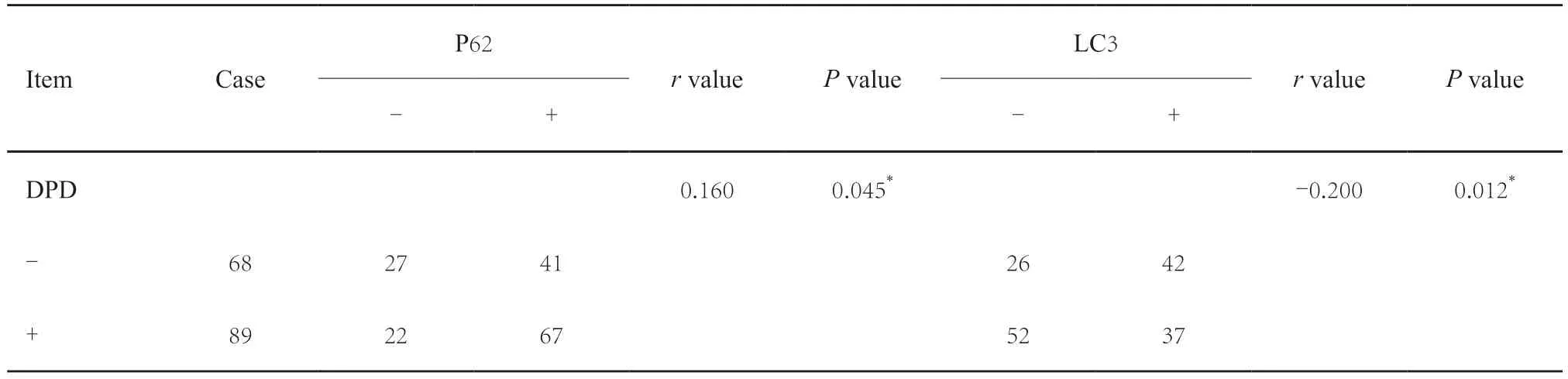
表3 结直肠癌中不同表达的DPD与LC3、P62的相关性Tab.3 Correlation of different expressions of DPD with LC3 with P62 and in colorectal cancer(n)
根据LC3的免疫组织化学染色结果,将其分为LC3+组和LC3-组,分析三者之间的关系。结果显示,LC3+组中,P62、DPD蛋白的阳性率均低于LC3-组。Spearman相关分析显示,LC3与P62、DPD的表达均呈负相关(r=-0.202、r=-0.200),差异有统计学意义(P<0.05,表4)。

表4 结直肠癌中不同表达的LC3与P62、DPD的相关性Tab.4 Correlation of different expressions of LC3 with P62 and DPD in colorectal cancer(n)
2.3 结直肠癌中P62与LC3不同表达分组中DPD的表达情况
根据P 6 2 与L C 3 的免疫组织化学表达,将157例病例分为4组,即P62+/LC3+、P62+/LC3-、P62-/LC3+和P62-/LC3-组。结果显示,P62-/LC3-组的DPD蛋白表达量明显高于其他3组,而P62-/LC3+组的DPD蛋白表达则低于其他3组,差异有统计学意义(P<0.05)。P62+/LC3-组与P62+/LC3+组的DPD蛋白表达量虽有不同,但其差异无统计学意义(P>0.05),但两组DPD的蛋白表达量均低于P62-/LC3-组,且高于P62-/LC3+组(P<0.05,表5,图3)。
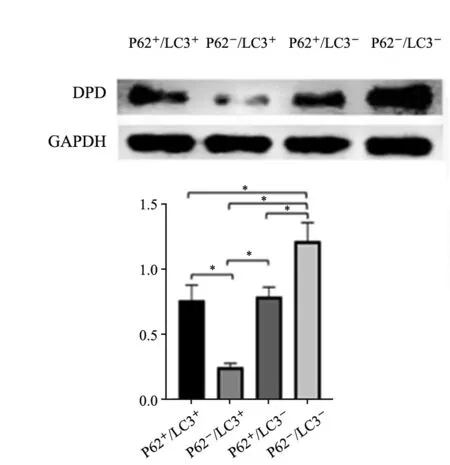
图3 Western blot检测LC3、P62不同分组中DPD的表达Fig.3 Expression of DPD in different groups of p62 and LC3 by Western blot

表5 结直肠癌中P62与LC3不同分组中DPD的表达情况Tab.5 Expression of DPD in different groups of P62 and LC3 in colorectal cancer[n (%)]
2.4 结直肠癌中LC3、P62、DPD的表达与临床病理学特征的相关性
结直肠癌中P62蛋白表达与T分期及淋巴结转移呈正相关,LC3蛋白表达与肿瘤直径及T分期呈正相关,DPD在黏液腺癌及伴有黏液腺癌成分的管状腺癌中的表达明显高于管状腺癌,差异均有统计学意义(P均<0.05,表6)。
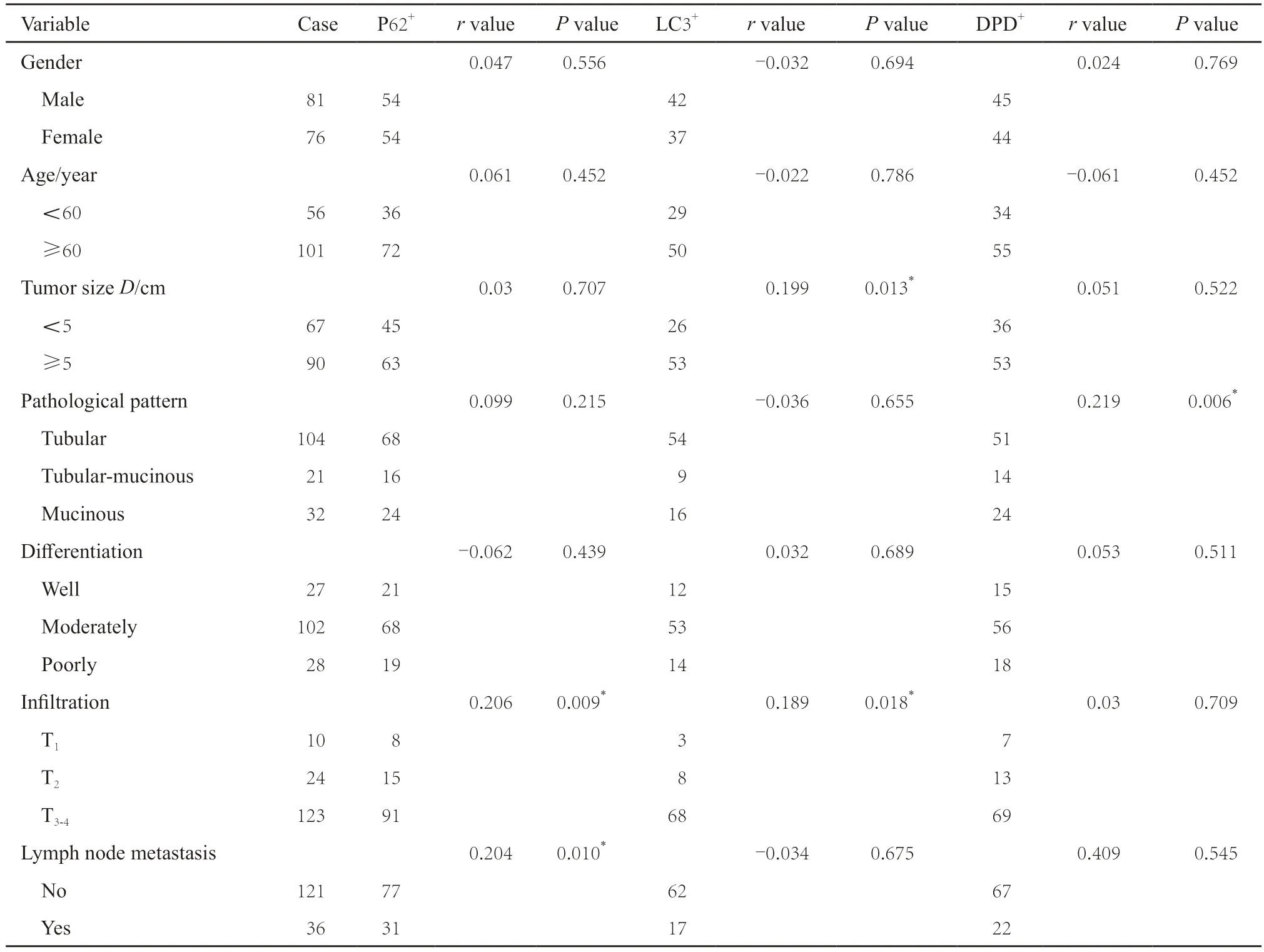
表6 LC3、P62及DPD的表达与结直肠癌临床病理学特征的相关性Tab.6 Correlation between the expression of LC3,P62 and DPD and clinicopathological features in colorectal cancer(n)
2.5 生存分析
157例结直肠癌患者的中位生存期为62.4个月,平均5年生存率为59.3%。Kaplan-Meier法分析显示,P62、DPD、LC3及淋巴结转移与结直肠癌患者的预后密切相关(P<0.05,图4)。COX回归模型显示,DPD、LC3、P62及淋巴结转移是结直肠癌的独立危险因素(P<0.05,表7)。
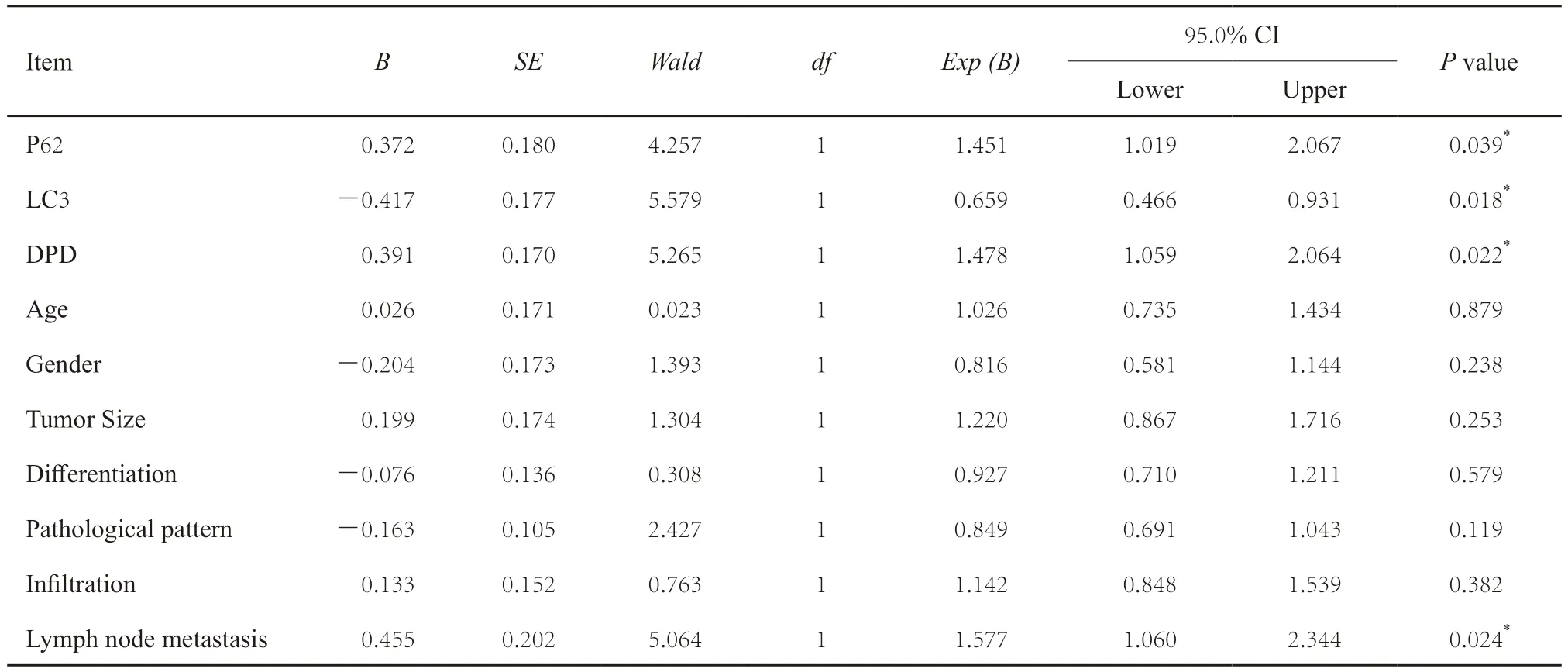
表7 影响结直肠癌患者预后多因素生存分析Tab.7 Multivariate analysis of prognosis in patients with colorectal cancer
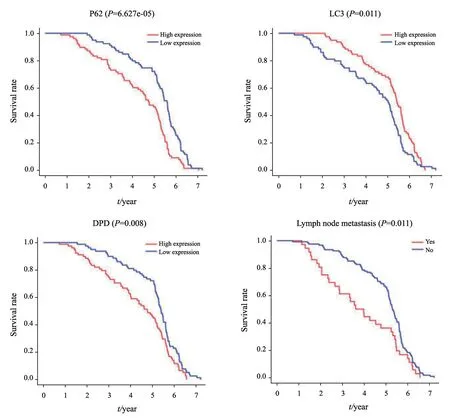
图4 结直肠癌预后生存曲线Fig.4 Survival curve of colorectal cancer
3 讨 论
结直肠癌的治疗以手术切除为主,对于中晚期患者,以5-FU为基础的化疗方案仍是术后及失去手术机会的结直肠癌患者最常用的治疗方案,而肿瘤对化疗药物的耐受性常导致疗效欠佳。有研究[5]表明,5-FU代谢酶DPD异常与患者对5-FU的化疗耐受有关。
DPD是5-FU代谢的关键限速酶,其可将近85%的5-FU分解为二氢氟尿嘧啶,进而生成无药物活性的F-β-丙氨酸由尿液排出。只有少量的5-FU进入合成代谢,参与DNA及RNA合成,发挥药理作用[6-7]。研究[8-9]表明,DPD作为5-FU代谢的关键酶,其高表达可加速5-FU的分解代谢,降低药物浓度,从而影响药物疗效。在有关结直肠癌、头颈部鳞癌的体外研究[10-12]中发现,DPD的表达异常增高可降低5-FU的化疗敏感性。本研究结果表明,结直肠癌临床样本中DPD蛋白及mRNA的表达均高于正常黏膜组,且与组织学类型及患者生存密切相关。为进一步研究DPD表达与5-FU疗效的关系,本研究选取了术后应用以5-FU为基础的FOLFOX治疗方案的病例,结果显示,患者的预后与DPD的表达存在相关性。结直肠癌中DPD的异常表达在一程度上影响患者术后应用5-FU的疗效。结合本课题组前期研究[13]结果,我们认为,结直肠癌中存在DPD调控异常,致使蛋白水平异常升高,导致肿瘤对5-FU不敏感,从而影响患者的生存预期。因此,降低DPD表达,进而提高5-FU疗效,有可能成为逆转耐药的新思路。
蛋白质代谢降解是蛋白表达水平调控的一个重要环节。细胞内蛋白质代谢主要通过3个途径,即自噬-溶酶体途径、泛素-蛋白酶体途径和细胞凋亡途径,其中自噬-溶酶体途径是细胞降解内源性底物的重要途径,可降解自身受损的细胞器和大分子蛋白质[14]。有研究[15]证实,自噬-溶酶体降解蛋白质途径的异常与多种疾病密切相关。Moors等[16]研究表明,抑制自噬可使α-突触核蛋白异常堆积,进而引起帕金森病的发生。Li等[17]研究发现,在阿尔兹海默病中磷酸化和异常的Tau蛋白可通过自噬-溶酶体途径降解。近年来,自噬与肿瘤耐药的相关性受到关注。Li等[18]对人原髓细胞白血病细胞HL-60进行研究发现,抑制自噬可以促使肿瘤细胞获得对阿糖胞苷的耐药性,而诱导自噬则可激活耐药细胞中的凋亡信号通路,从而逆转耐药。有研究[19-20]表明,5-FU耐药细胞中存在自噬水平的异常降低,激活自噬可以提高5-FU对HCT-116细胞的杀伤作用。LC3是自噬体膜上的标志蛋白,是自噬体形成的标志物。本研究结果显示,LC3在结直肠癌中表达升高,并且LC3+组中DPD的阳性率明显低于LC3-组,两者表达呈负相关。我们推测自噬-溶酶体途径可能参与DPD蛋白的降解过程,从而影响其蛋白表达水平,进而影响肿瘤耐药性。自噬水平的降低可能导致DPD降解的减少,使其蛋白水平升高,导致耐药的发生。
自噬-溶酶体途径的关键环节是自噬体与溶酶体结合,形成自噬-溶酶体,进而降解蛋白质,完成自噬-溶酶体降解蛋白质的全过程[21]。近年来研究[22]发现,P62/SQSTM1与自噬-溶酶体途径密切相关,是自噬体与溶酶体结合过程中的关键分子。P62是一种应激诱导的多功能蛋白质,具有N端Phox-BEM1结构域、ZZ型锌指结构域、核定位信号、输出基序、LC3相互作用区、Keap1相互作用区和C端泛素相关结构域等多个结构域[23]。其中P62通过LC3相互作用区结构域参与自噬-溶酶体形成,将多泛素化的底物传递给自噬体,完成自噬-溶酶体途径降解蛋白质的全过程。因此,P62被认为是自噬降解途径中的一个重要因子。当选择性自噬的底物堆积时,自噬水平增高,自噬-溶酶体途径激活,P62作为载体蛋白则会与底物一同被自噬-溶酶体降解而导致其蛋白水平降低[21]。
最近研究[24]表明,P62与肿瘤耐药密切相关,抑制P62可以使对顺铂耐药的头颈部鳞癌细胞重新获得对药物的敏感性。在结直肠癌细胞的研究[25]中发现,P62升高可以减弱5-FU药物诱导的肿瘤细胞凋亡。本研究结果显示,P62+组中DPD表达的阳性率明显高于P62-组,并且与患者预后有关,提示P62可能影响结直肠癌中DPD的表达,进而影响化疗效果及预后。同时,本研究发现,尽管LC3与P62呈负相关,但两者与DPD的关系却具有特殊性。当P62-/LC3-时,DPD表达显著高于其他3组,而当P62-/LC3+时,DPD表达则显著低于其他3组。由此可见,尽管LC3与P62共同参与影响DPD的表达水平,但只有肿瘤中LC3激活且同时伴有P62降低时,才可导致DPD的表达显著降低。我们推测LC3升高伴P62降低时,提示肿瘤中有自噬-溶酶体途径的激活,参与DPD蛋白降解,使DPD表达水平降低。若仅有LC3升高,只在一定程度上表明细胞内自噬体的增加,并不表示自噬-溶酶体途径的激活,因而不能完成对DPD的降解。只有当作为自噬转运底物蛋白的P62被消耗时,才可表明自噬-溶酶体降解蛋白质的途径被激活,进而降解目的蛋白。然而,本研究中另两组P62+/LC3-组与P62+/LC3+组中DPD蛋白表达量均低于P62-/LC3-组,而高于P62-/LC3+组,但两组间差异无统计学意义,提示P62是影响DPD表达的重要分子,其不仅可通过参与自噬影响DPD表达,同时可能通过非自噬途径影响DPD表达,但前者的调控优势要明显强于后者。因此,自噬-溶酶体途径的激活有可能成为影响DPD表达的重要途径,但其作用机制还有待进一步探讨。
综上所述,自噬是细胞降解内源性底物的重要途径,P62作为应激诱导的多功能蛋白,因其具有复杂的多功能结构域,可参与细胞内蛋白质代谢的多个途径。本研究仅对LC3与P62组成的自噬-溶酶体途径与DPD表达进行了初步探讨。鉴于P62复杂的多功能结构域,其是否能通过其他结构域(如C端泛素相关结构域)参与影响5-FU耐药相关因子DPD表达尚需进一步探究。总之,自噬-溶酶体途径可能作为DPD的有效降解途径,参与DPD代谢,纠正DPD的异常表达有可能成为逆转结直肠癌耐药的新途径。
利益冲突声明:所有作者均声明不存在利益冲突。

