DNA损伤应答缺陷作为乳腺癌治疗靶点的研究进展
金奕滋,林明曦,张 剑
复旦大学附属肿瘤医院Ⅰ期临床研究中心,复旦大学附属肿瘤医院肿瘤内科,复旦大学上海医学院肿瘤学系,上海 200032
乳腺癌现已成为全球范围内发病率最高的恶性肿瘤[1],得益于乳腺癌的分类治疗模式,其总体预后在近年来有所改善。目前临床上对乳腺癌的分类治疗主要基于其病理学分子分型,即根据雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)及人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)的表达情况将乳腺癌分为激素受体阳性型、HER2过表达型和三阴性乳腺癌(triple negative breast cancer,TNBC)。与此同时,随着测序技术的发展和多组学研究的兴起,基于传统分子分型的分类治疗显现出一定的局限性。尤其对于TNBC而言,尽管具有侵袭性较强、复发及远处转移率高的共同特征,但其基因突变谱和分子生物学特征存在着高度异质性,仍需要确立更精准的分型或寻找针对性靶点来指导临床治疗[2-5]。
DNA损伤应答(DNA damage response,DDR)缺陷是近年来乳腺癌治疗研究的热门靶点之一。中乳腺癌易感基因(breast cancer susceptibility gene,BRCA)为DNA同源重组(homologous recombination,HR)修复通路上的关键基因,其作为乳腺癌的治疗靶点已得到许多研究[6-7]的证据支持。基于多项大型Ⅲ期多中心临床试验的数据,最新的国际指南已推荐对所有复发或转移性的乳腺癌患者行胚系BRCA1/2突变检测以评估是否存在多聚腺苷二磷酸核糖聚合酶[poly (ADP-ribose) polymerase,PARP]抑制剂的应用指证,且有研究[6-7]表明,伴胚系BRCA1/2突变的肿瘤表型(即“BRCAness”表型)亦存在于BRCA1/2野生型的伴HR缺陷的肿瘤中,伴HR功能异常的乳腺癌分别占乳腺癌总人群的20%和TNBC的50%~80%。以上证据提示DDR缺陷作为乳腺癌的潜在治疗靶标具有一定的研究价值和应用前景。本文就DDR缺陷作为乳腺癌治疗靶点的研究进展进行综述,并探讨其在临床应用中所面临的问题。
1 DDR缺陷
DDR通路负责DNA损伤后的识别、信号转导和修复,并通过协调细胞周期进程减少DNA损伤被传递至下一代子细胞的可能。DDR功能的失活可导致细胞突变的累积和基因组不稳定性的增加,在癌症发生的早期发挥着关键作用[8-9]。DNA损伤修复的核心机制包括修复DNA单链损伤的碱基切除修复(base excision repair,BER)、核苷酸切除修复(nucleotide excision repair,NER)、错配修复(mismatch repair,MMR),以及修复DNA双链损伤的HR、非同源末端连接(non-homologous end joining,NHEJ)、微同源介导的末端连接(microhomologymediated end joining,MMEJ)[10-12]。随着对DNA损伤修复机制的深入研究,现已明确DNA损伤修复是由细胞内的信号转导网络进行感知和调控的复杂过程,不同机制所涉及的通路间存在着相互作用。
在DDR的主要通路中,介导高保真DNA修复的HR通路与乳腺癌发生、发展的关系尤为密切。HR通路上的关键基因BRCA1/2为乳腺癌最常见的易感基因,伴BRCA1/2突变的乳腺癌患者更易呈现早发性(发病年龄≤35岁)、双侧乳腺癌、合并乳腺癌家族史的特点。此外HR缺陷还包括HR通路其他基因(如CHEK1/2、ATM、ATR、BRIP1、PALB2、PTEN、RAD50、RAD51和MSH6等)的体系或胚系突变、BRCA1启动子甲基化以及与HR缺陷表型相关的DNA拷贝数变异、杂合性缺失(loss of heterozygosity,LOH)、端粒等位基因失衡(telomeric allelic imbalance,TAI)、大片段迁移(large scale transition,LST)等基因表达特征[13]。
2 DDR与“协同致死”机制
“协同致死”的概念最初用于描述两个功能性基因同时失活导致细胞死亡的现象[14-15],这一概念在癌症治疗领域被进一步拓展。在伴有DDR某条通路缺陷的肿瘤细胞中,DNA修复将高度依赖于其他旁路途径,而若此时这些通路被药物再次抑制则会产生“协同致死”效应。利用这一效应,DDR成为抗肿瘤药物的研发靶点。
PARP抑制剂为首个成功利用“协同致死”原理进入临床应用的抗肿瘤药物,其开发最初主要基于对PARP催化活性的抑制。研究者最初认为PARP抑制剂可通过抑制PARP酶活性阻断DNA单链损伤后的BER,当单链损伤转变为双链损伤时,正常细胞可通过HR通路对双链损伤进行修复,而HR功能异常的细胞则出现损伤的积累,最终致死。然而,由于后续研究发现抑制BER通路上PARP的下游分子未能杀死HR缺陷细胞[16],这种对PARP作用机制的阐释又受到了挑战。PARP同时负责调控NHEJ通路,有研究[16-18]发现,在HR缺陷细胞中抑制PARP活性可引起NHEJ通路异常激活,且PARP抑制剂通过NHEJ通路发挥细胞毒作用。由于NHEJ修复不具有保真性,该通路的失调可能是协同致死的机制之一。此外部分PARP抑制剂可通过“PARP捕获”机制形成DNA-PARP复合物使DNA复制叉停滞,进而干扰修复过程中的DNA复制[19-20]。由于PARP捕获机制还可激活固有免疫反应[21],故捕获能力更强的PARP抑制剂往往具有更强的抗肿瘤作用。
除PARP抑制剂外,多个基于“协同致死”机制靶向DDR的药物正处于临床前及临床研究阶段。这些靶点可大致分为两类:一类为主要负责DNA损伤识别与信号转导、参与调控细胞周期的蛋白激酶,如ATM、ATR、DNA-PKcs、CHEK1/2和WEE1等;另一类为直接参与DNA双链断裂修复的分子,如RAD51和POLQ。ATM主要通过HR通路参与DNA双链断裂修复,其负责H2AX的磷酸化,进而招募下游分子参与DDR过程[22]。ATR在DNA单链和双链修复中均发挥重要作用,其与下游的CHEK1分子共同参与细胞周期捕获,维持复制叉的稳定性,帮助复制叉修复和重启[23]。WEE1负责调控细胞周期激酶,负向调控细胞进入有丝分裂[24]。DNA-PKcs和POLQ则分别是NHEJ通路和MMEJ通路的关键分子[25-26]。
3 以DDR为靶点的乳腺癌治疗药物
3.1 PARP抑制剂
PARP 抑制剂为目前乳腺癌治疗领域研究进展最快的DDR靶向药物。OlympiAD、EMBRACA研究[27-28]的数据已奠定了PARP抑制剂在伴胚系BRCA突变转移性乳腺癌中的治疗地位。OlympiAD Ⅲ期临床试验[28]表明,奥拉帕尼单药对比标准化疗显著改善携带胚系BRCA突变、HER2阴性转移性乳腺癌患者的无进展生存期(progression free survival,PFS)(中位PFS:7.0个月vs4.2个月,P<0.001),且患者对奥拉帕尼耐受性良好,3级及以上不良反应的发生率低于标准化疗组(36.6%vs50.5%),尽管两者对总生存期(overall survival,OS)的影响无显著差异,但在既往未接受化疗患者的亚组分析中,奥拉帕尼组相比化疗组可显著延长OS(22.6个月vs14.7个月,P=0.02)。在随后的EMBRACA Ⅲ期临床试验[29]中,新一代PARP抑制剂他拉唑帕尼亦显示出优于标准化疗的抗肿瘤活性[客观缓解率(objective response rate,ORR):62.6%vs27.2%],且较标准化疗组可显著延长PFS(中位PFS:8.6个月vs5.6个月,P<0.001)。基于以上数据,奥拉帕尼和他拉唑帕尼已获美国食品药品管理局批准用于治疗HER2阴性、伴胚系BRCA突变的转移性乳腺癌患者。
此外,多项临床试验亦证明了PARP抑制剂在合并DDR缺陷乳腺癌患者中的治疗价值,其中包括用于辅助治疗和新辅助治疗阶段。TBCRC 048单臂研究[30]的初步结果显示,携带体系DDR突变和非BRCA胚系DDR突变的转移性乳腺癌患者经奥拉帕尼单药治疗后分别取得了38.5%和29.6%的ORR,提示可能有更多非胚系BRCA突变的患者可从PARP抑制剂治疗中获益。而GeparOLA Ⅱ期临床试验[31]结果则提示,奥拉帕尼联合紫杉醇较卡铂联合紫杉醇在合并HR缺陷、HER2阴性早期乳腺癌的新辅助治疗中有着更高的病理学完全缓解(pathologic complete response,pCR)率,且耐受性更好。以上数据均表明,PARP抑制剂可使胚系BRCA突变以外的乳腺癌患者获益,而伴HR缺陷的乳腺癌能否成为PARP抑制剂的又一适应证仍有赖于更多更高级别的证据。
3.2 其他靶向DDR通路的药物
由于PARP抑制剂面临耐药等问题,研究者进一步探索了DDR通路上的其他靶点。除PARP抑制剂外,多个以DDR通路分子为靶点治疗乳腺癌的药物已进入临床研究阶段,如ATM抑制剂、ATR抑制剂、CHEK1抑制剂及WEE1抑制剂等,表1总结了这些药物的临床试验开展情况。随着对DDR调控分子网络的深入研究,相信未来将有更多的靶点投入临床转化研究,有望作为单药或联合PARP抑制剂、免疫治疗、靶向治疗等用于难治性乳腺癌的治疗。
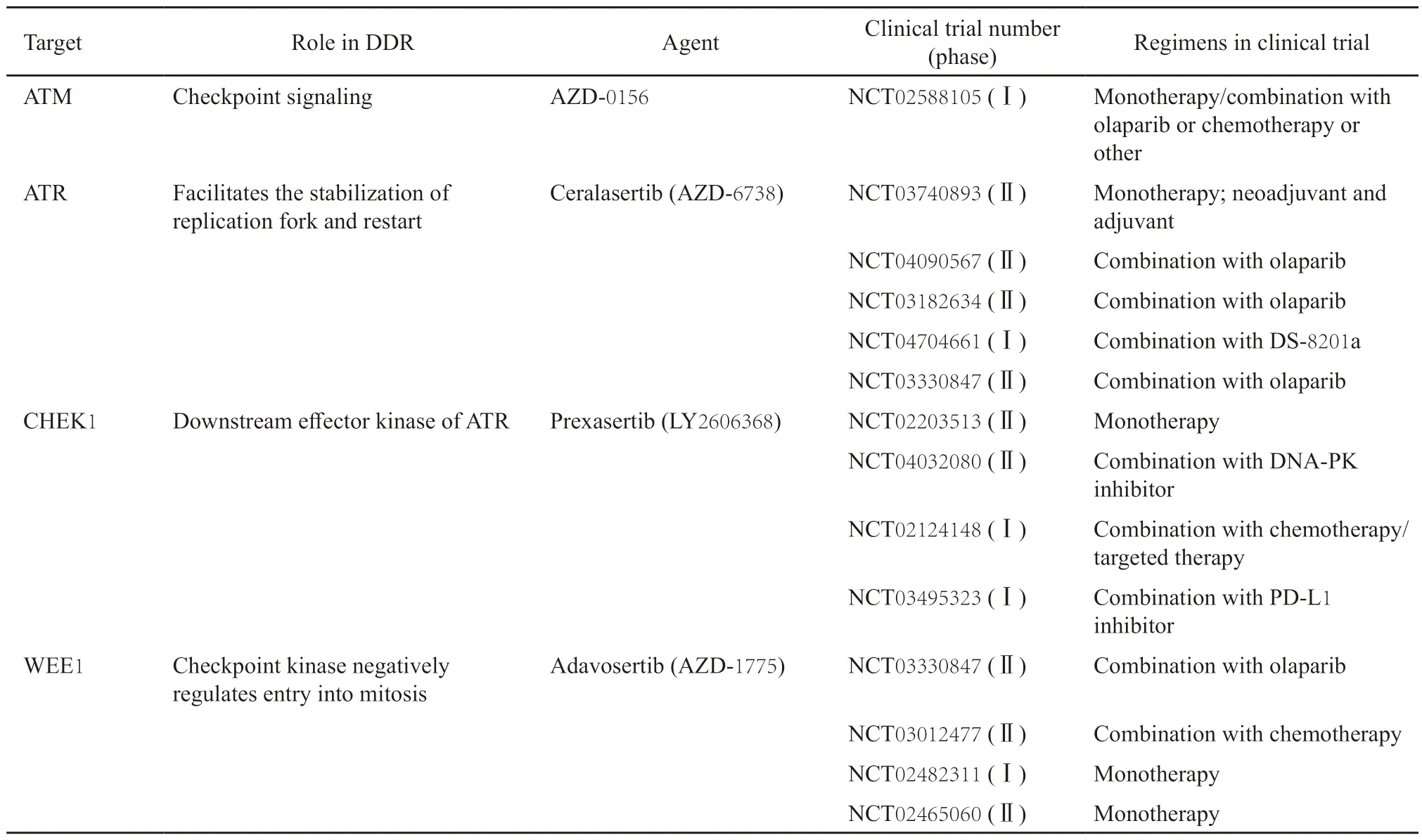
表1 除PARP抑制剂外进入临床研究阶段的主要DDR靶向药物Tab.1 The main agents targeting DDR in the clinical development beyond PARP inhibitors
4 以DDR为靶点的药物在TNBC中的临床进展
由于先前的研究[30-31]证据提示,无胚系BRCA突变患者也可能从PARP抑制剂治疗中获益,而TNBC又是目前临床治疗效果欠佳的一种乳腺癌亚型,一些临床研究以TNBC为目标人群探索DDR靶向药物的治疗价值(表2)。
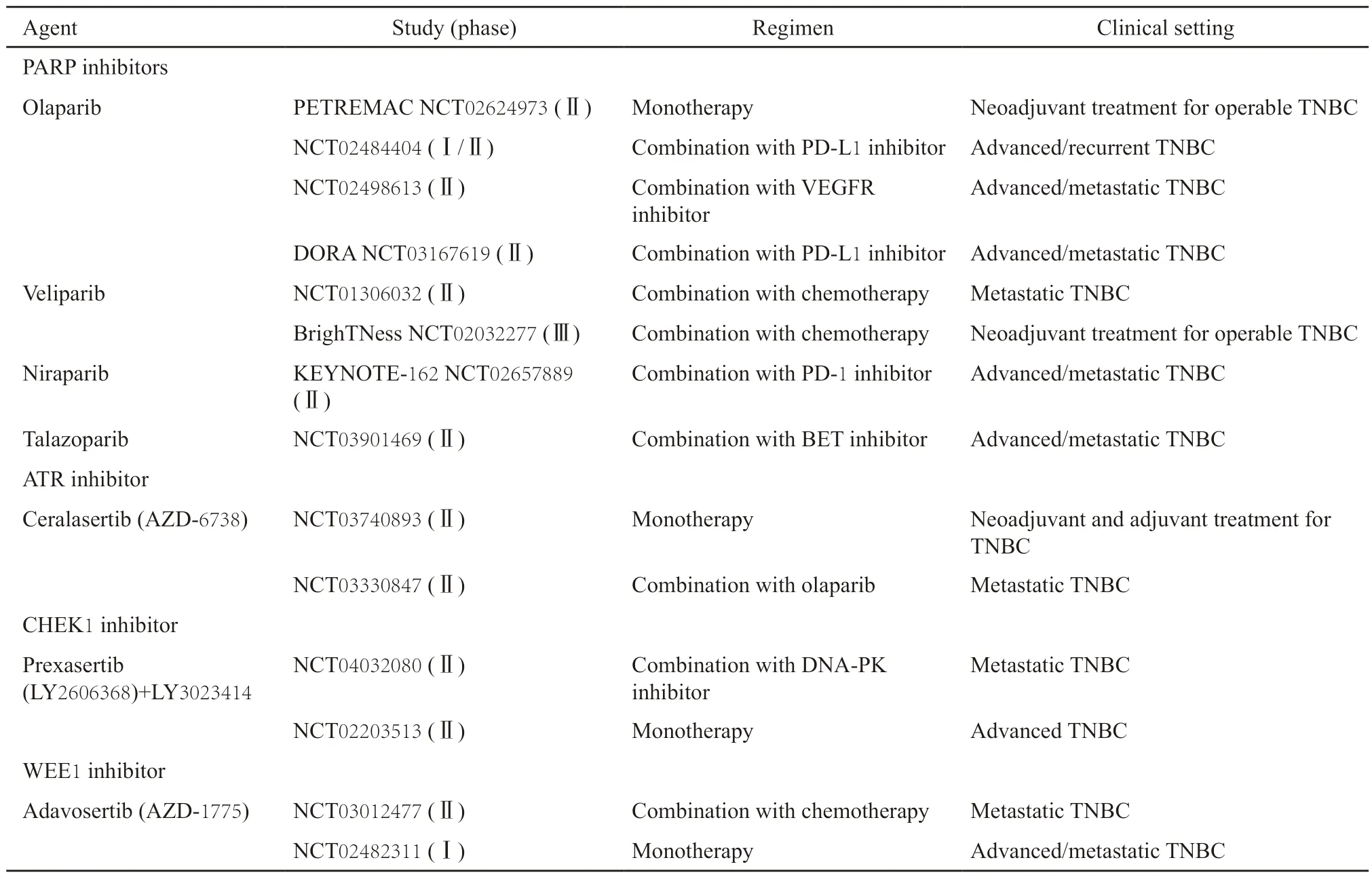
表2 探索DDR靶向药物治疗TNBC的主要临床研究Tab.2 The main clinical trials investigating DDR-targeted agents for the treatment of TNBC
在TNBC新辅助治疗领域,尽管BrighTNessⅢ期研究[32]表明,维利帕尼+紫杉醇+卡铂组较紫杉醇+卡铂组未能显著提高pCR率(P=0.36),但PETREMAC Ⅱ期研究[33]显示出奥拉帕尼单药序贯化疗的良好疗效,其ORR在非选择性的TNBC中达56.3%,且胚系或体系HR基因突变与BRCA1甲基化状态可能是理想的疗效预测指标。另有一项旨在评估ATR抑制剂ceralasertib单药治疗是否对新辅助化疗后残存病灶较多的TNBC患者具有抗肿瘤作用的Ⅱ期研究正在进行中。对于进展期或转移性乳腺癌,已有OlympiAD Ⅲ期临床试验[28]数据提示TNBC亚组获益更明显,目前多项PARP抑制剂联合免疫或靶向治疗转移性TNBC的临床试验也正在进行中。CHEK1抑制剂prexasertib在一项Ⅱ期临床试验[34]中对无BRCA突变的进展期TNBC显示出中等强度的临床疗效。考虑到prexasertib联合化疗在卵巢癌中的应用取得了一定的成功,有必要进一步评估其联合化疗治疗乳腺癌的临床效果。此外,有多项正在进行中的临床研究旨在评估两种DDR靶向药物的联合应用,例如一项Ⅱ期多中心临床研究VIOLETTE旨在探究奥拉帕尼单药对比奥拉帕尼联合ATR抑制剂ceralasertib或WEE1抑制剂adavosertib作为二线或三线治疗转移性TNBC的疗效和安全性。总的来说,DDR靶向药物的联合治疗(包括免疫治疗、靶向治疗及联合两种DDR靶向药物等)已成为临床研究的趋势,期待以上这些研究结果能为TNBC带来新的治疗机会。
5 临床应用中的难点与挑战
DDR缺陷作为乳腺癌潜在的治疗靶点,在临床应用中仍存在以下尚待解决的问题。
5.1 疗效预测标志物的确立
DDR靶向药物的作用主要基于“协同致死”原理,故需更精准地对目标人群进行定位。尽管目前PARP抑制剂仅获批用于胚系BRCA突变的乳腺癌患者,多项临床研究[30-31]表明,其对无BRCA突变的患者亦具有疗效。而HR缺陷和“BRCAness”表型是否为PARP抑制剂最准确的预测指标,仍需要大型随机对照研究进行验证。此外,HR功能异常作为潜在的预测指标仍缺乏统一的检测手段、标准和明确的定义。目前的预测指标包括HR缺陷评分(将HR缺陷表型相关的LOH评分、TAI、LST等基因表达特征纳入综合考虑)、基于多重连接探针扩增技术(multiplex ligation-dependent probe amplification,MLPA)分析的BRCA1样特征、RAD51评分等[13]。这些预测指标能否精确定位治疗人群,仍有待临床试验的进一步评估。
5.2 继发性耐药
PARP抑制剂继发性耐药的机制尚未被完全阐明,目前已知的机制主要包括以下几点:①由于HR基因的回复突变、BRCA1亚等位基因的表达、BRCA1脱甲基化及p53结合蛋白1的失活等原因,HR修复功能得以恢复;② PARP1的完全失活或“PARP捕获”能力的下降;③通过多种机制保护停滞的复制叉不被破坏;④ P-糖蛋白表达上调,使药物外排增加[12,35]。此外,PARP抑制剂与铂类药物存在着交叉耐药现象,前线铂类治疗进展的患者往往对PARP抑制剂响应不佳。PARP抑制剂的耐药问题限制了其进一步的临床应用,故需积极探索克服耐药的策略,例如,针对以上耐药机制开发新型的DDR靶向药物,进一步探究PARP抑制剂与其他DDR靶向药、免疫治疗、化疗等手段联合应用的临床效果等。
5.3 意义不明变异(variants of uncertain significance,VUS)
DDR 通路缺陷的判定依赖于对测序结果的解读。国际癌症研究机构(International Agency for Research on Cancer,IARC)根据基因变异的致病性将其分为5 类:致病突变(可能性>9 9.0%)、可能致病突变(可能性为9 5.0%~9 9.0%)、VUS(可能性为5.0%~94.9%)、可能良性变异(可能性为0.1%~4.9%)和良性变异(可能性<0.1%)[36]。目前,治疗及临床试验的对象仅局限于致病或可能致病突变的患者。而实际在DDR基因测序中发现的大量单核苷酸变异仍被归类为VUS。既往WECARE研究[37]表明,约有75%的胚系BRCA1/2突变为VUS;而在ClinVar数据库中,VUS为5类变异中占比最大者。由于VUS的功能影响与实际致病风险尚不明确,给测序结果的临床解读和相应的治疗决策带来了较大困难,亟待进一步的评估与分类。
目前对VUS评估的方法主要有以下几种:①通过功能实验评估VUS对细胞功能的影响(如对HR修复、转录激活功能、分子间相互作用等的影响)[38-39];②通过生物信息学数据库(如SIFT、Polyphen 2等)对VUS功能进行预测[40-41];③基于大样本量的基因测序数据,通过对比某种变异在癌症患者与健康人群中的出现频率、携带某种变异的患者是否存在家族聚集性发病等评估变异的致病性;④利用基于CRISPR/Cas9技术的饱和基因编辑(saturation genome editing,SGE)对大批量的VUS进行功能检测和评分[42]。其中,传统的功能实验多基于导入外源性序列的模型进行分析,其灵敏度和特异度受剪接效应、转录稳定性等因素影响,且难以实现高通量的评估,因而具有一定的局限性;而生物信息学算法工具尽管易实现高通量分析,但其准确度相对较低。对于大部分的VUS而言,目前的临床及测序数据尚不足以为其定性提供充分证据。Findlay等[42]创新性地利用SGE对BRCA1基因RING和BRCT功能域上所有位点进行点突变,利用携带失功能BRCA突变的单倍体细胞无法存活的特性,高通量地对单核苷酸变异进行功能意义上的鉴别与分类。其对错义突变和剪切位点的功能评估均有较高的灵敏度和特异度,是目前评估VUS最为准确高效的方法,对完善DDR基因VUS的分类具有重要的借鉴意义。
6 总结与展望
以DDR为靶点的药物在乳腺癌治疗领域应用前景广阔。一系列的临床试验证据表明,PARP抑制剂对治疗乳腺癌有良好的疗效和安全性,同时,多项研究也正在积极探索PARP抑制剂能否在更早期的治疗阶段应用、能否使更多患者从中获益。除PARP抑制剂外,多种靶向DDR通路分子的乳腺癌治疗药物正处于临床前和临床研究中。在进一步的临床应用之前,人们仍需探索更准确的疗效预测指标以精准刻画获益人群;同时需要积极探索克服耐药的策略,联合靶向药物或免疫治疗将有希望成为新的发展方向;最后,仍需要大量的研究数据完善VUS的精准分类,以更好地利用测序数据指导临床治疗。
利益冲突声明:所有作者均声明不存在利益冲突。

