间断寒邪暴露对ApoE-/-动脉粥样硬化模型小鼠血脂代谢及单核巨噬细胞表达的影响
耿运玲,吴圣贤,何小娟,李 立,樊丹采,石英杰,舒海洋,苏文全,王子卓,杜雅薇
流行病学表明,冬季心脑血管疾病频发,当户外温度低于18 ℃,温度每下降1 ℃,心脑血管疾病的死亡率会随之增加[1]。众所周知,心脑血管疾病主要病理基础是动脉粥样硬化。动脉粥样硬化是一种慢性炎症性代谢疾病,许多学者已经展开对动脉粥样硬化危险因素的研究,其研究的焦点包括脂质代谢紊乱及炎症相关病理变化过程。
近年来,已有很多关于冬季对动脉粥样硬化造成心血管事件的研究,有研究发现,持续寒邪暴露可以促进解偶联蛋白 1(uncoupling protein 1,UCP1)依赖性皮下脂肪组织的脂解,继而出现血脂异常,加快动脉粥样硬化斑块增生和不稳定,从而导致心血管事件增加[2]。而其后有研究结论与之相反[3],但后者与本课题组前期研究发现的持续寒邪暴露不能加重动脉粥样硬化斑块的结论[4]一致。自然界的冬季及户外温度更倾向于间断寒邪暴露模型。Wang等[5-6]研究表明,间断寒邪暴露更有利于新陈代谢,且随着社会文明的进步,现代社会的人类很少长期直接暴露于室外极端环境中[7],间断寒邪暴露模式更贴合于人类生活真实环境。临床研究数据显示,在间断寒邪暴露的环境下,人体在不影响体质量的情况下,棕色脂肪组织富集,进而减脂[8]。而相反,有研究表明,间断寒邪暴露可以在不影响体质量的情况下,促进皮下脂肪堆积[9],并促进动脉粥样硬化的增生和不稳定性[10]。间断寒邪暴露对于动脉粥样硬化病人属于有益条件或有害条件,目前尚不明确。
因而研究间断寒邪暴露对动脉粥样硬化小鼠的血脂代谢及炎症的影响,可以进一步评估自然环境中心脑血管疾病风险。本研究采用间断寒邪暴露处理高脂饮食诱导的载脂蛋白E敲除(ApoE-/-)动脉粥样硬化模型小鼠,观察小鼠进食量、体质量、血脂水平及脂肪组织中单核巨噬细胞M1、M2表型占比及M1/M2比值,为预防临床上冬季心脑血管频发事件提供思路。
1 材料与方法
1.1 实验动物 10~12周龄的ApoE-/-小鼠36只,SPF级,雄性,体质量(29±2)g,由北京维通利华实验动物技术有限公司提供,动物生产许可证号:SCXK(京)2016-0006;动物使用许可证号:SYXK(京)2017-0033。
1.2 主要试剂与仪器 磷酸缓冲盐溶液(PBS)粉末(pH 7.3),货号:ZLI-9062,购自中杉金桥公司;PE anti-mouse CD206(货号141706)、FITC anti-mouse F4/80(货号123107)、APC anti-mouse CD11c(货号117310)及PE Ctrl(货号400508)、FITC Ctrl(货号400506)、APC Ctrl(货号400912)均购于Biolegend公司;戊巴比妥钠(货号:TOP0263,Biotoppd公司);D-Hank′s平衡盐溶液(HBSS,编号:Gibco14175);胶原酶Ⅰ型(Gibco17100);牛血清白蛋白(BSA)购自北京索莱宝科技有限公司。
动物饲养恒温箱(北京福意联公司);精准天平(上海仪器仪表厂);流式细胞仪(型号:Accuri C6,美国BD公司);离心机(德国Eppendorf公司);显微镜(型号DP72,日本Olympus公司)。
1.3 分组与造模方法 将36只ApoE-/-小鼠按照随机数字表法分为常温对照组和间断寒邪暴露组,每组18只,均饲养于北京中医药大学东直门医院屏障动物实验室,室温保持在22~24 ℃,相对湿度50%,12 h交替光照。两组小鼠均采用基础饲料于常温适应性饲养3 d,自由饮食水。3 d后各组小鼠均接受高脂饮食喂养(配方为78.85%基础饲料+0.15%胆固醇+21%脂肪,经60Coγ照射灭菌处理,购自北京华阜康生物科技股份有限公司),共 16 周,其中后 8 周间断寒邪暴露组小鼠进行每天6 h间断冷刺激。
间断寒邪暴露组小鼠造模方法参照文献[6],小鼠于每日 08:30~09:00进行间断冷刺激,将小鼠置于 4 ℃动物饲养恒温箱,每天连续 6 h进行冷暴露,剩余 18 h置于20~22 ℃环境,共8周。本研究通过北京中医药大学东直门医院动物伦理委员会批准,并在严格规范的操作下进行。
1.4 检测指标及方法
1.4.1 进食量及体质量 每周一、周四15:00左右记录每只小鼠的体质量、进食量,并观察小鼠体型的变化。
1.4.2 脂肪组织重量 用戊巴比妥钠以60 mg/kg注射麻醉小鼠(称重0.15 g戊巴比妥钠晶体加入50 mL蒸馏水配成0.3%的戊巴比妥钠),每只小鼠0.8~1.0 mL。摘眼球取血后脱脊处死小鼠,取出小鼠肩胛、腹股沟、附睾部位脂肪组织,并分别称重记录。
1.4.3 血脂 间断寒邪暴露处理8周后,采用生化法检测小鼠血浆中总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)水平。
1.4.4 单核巨噬细胞M1、M2 采用流式细胞术检测单核巨噬细胞M1、M2的占比,并计算M1/M2比值。用F4/80+标记单核巨噬细胞,在此基础上,CD11c+CD206-标记单核巨噬细胞M1表型,CD11c-CD206+标记单核巨噬细胞M2表型。
流式细胞术方案参照文献[11]。①配制消解液(7.5% BSA 3 mL+HBSS溶液7 mL+0.02 g胶原酶),称取0.1 g胶原酶放入干净烧杯中,加入7.5% BSA溶液15 mL、HBSS溶液35 mL,放入磁力搅拌子,将温度调整为36.5 ℃、转速调整为150 r/min,搅拌1 h后用保鲜膜封口,锡箔纸避光,过夜后用0.22 μm滤膜过滤除菌。②消解脂肪组织:取脂肪组织后放在PBS中洗去血液,剪碎后放入15 mL锥形离心管中,加入脂肪组织体积1∶1的消解液于37 ℃恒温水浴箱中消解60 min,直到没有可见的块状物。③分离巨噬细胞:消解后,将离心管置于冰上,让脂肪细胞和脂质(浮在顶部)与基质血管成分(SVF)分离,在SVF中可以找到巨噬细胞。用移液管清除脂肪细胞和脂质。其余的水相将进一步使用。使用100 μm过滤器过滤的水相SVF细胞,除去团块。在4 ℃下,以1 500 r/min转速离心10 min。清洗两遍,取出上清液,将SVF颗粒重悬于1%BSA的PBS缓冲液1 mL中进行流式细胞分析。④流式细胞分析:调整细胞至100 μL中含5×105个细胞。细胞浓度可通过血细胞计数器测定。在室温下1 500 r/min离心5 min,去除上清液,用FITC anti-mouse F4/80抗体(Fc阻断剂,1∶200)1 h,防止非特异性抗体结合。在室温下1 500 r/min离心5 min;分别用PE anti-mouse CD206抗体、APC anti-mouse CD11c抗体和相应的同型对照对细胞进行缓冲和染色。避光孵育细胞20 min,离心后移除抗体,PBS清洗2次,用200 μL含1%BSA的PBS溶液重悬后将细胞转移至流式管后上机检测。
1.5 统计学处理 采用SPSS 20.0软件进行数据分析。定量资料先进行正态性检验和方差齐性检验,若符合正态分布且方差齐,则采用独立样本t检验,否则使用非参数秩和检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 两组小鼠进食量及体质量比较 间断寒邪暴露组小鼠进食量较常温对照组多,但差异无统计学意义(P>0.05),详见图1;两组小鼠体质量均随着饲养周期不断增加,详见图2;间断寒邪暴露处理3周内,间断寒邪暴露组体质量较常温对照组增加,但差异无统计学意义(P>0.05),间断寒邪暴露组小鼠冷处理第16周体质量较常温对照组降低(P<0.05),详见表1。
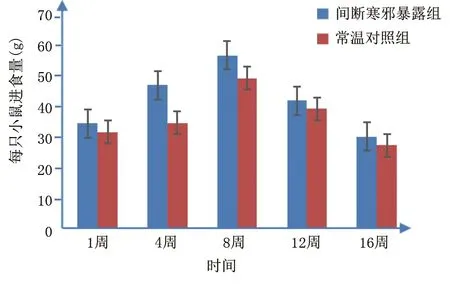
图1 两组小鼠第1周~第16周平均进食量变化
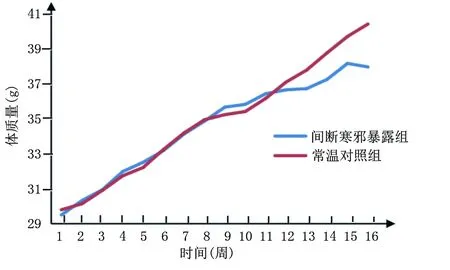
图2 两组小鼠第1周~第16周平均体质量变化
表1 两组小鼠第1周~第16周体质量比较(±s) 单位:g
2.2 两组小鼠脂肪组织重量比较 两组小鼠肩胛间区棕色脂肪组织、腹股沟白色脂肪组织、附睾白色脂肪组织重量比较差异均无统计学意义(P>0.05)。详见表2。
表2 两组小鼠脂肪组织重量比较(±s) 单位:g
2.3 两组小鼠血脂比较 与常温对照组相比,间断寒邪暴露组小鼠血液中TG降低(P<0.05),两组TC、HDL-C、LDL-C比较差异均无统计学意义(P>0.05)。详见表3。
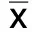
表3 两组小鼠血脂比较(±s) 单位:mmol/L
2.4 两组小鼠脂肪细胞中单核巨噬细胞M1、M2表达比较 与常温对照组相比,间断寒邪暴露组肩胛间区棕色脂肪组织中单核巨噬细胞M1型占比降低,M2型占比升高,但差异均无统计学意义(P>0.05),M1/M2明显降低(P<0.01);腹股沟白色脂肪组织及附睾白色脂肪组织中单核巨噬细胞M1表型占比降低,M2型占比升高,M1/M2降低,但差异均无统计学意义(P>0.05)。详见图3~图5及表4~表6。
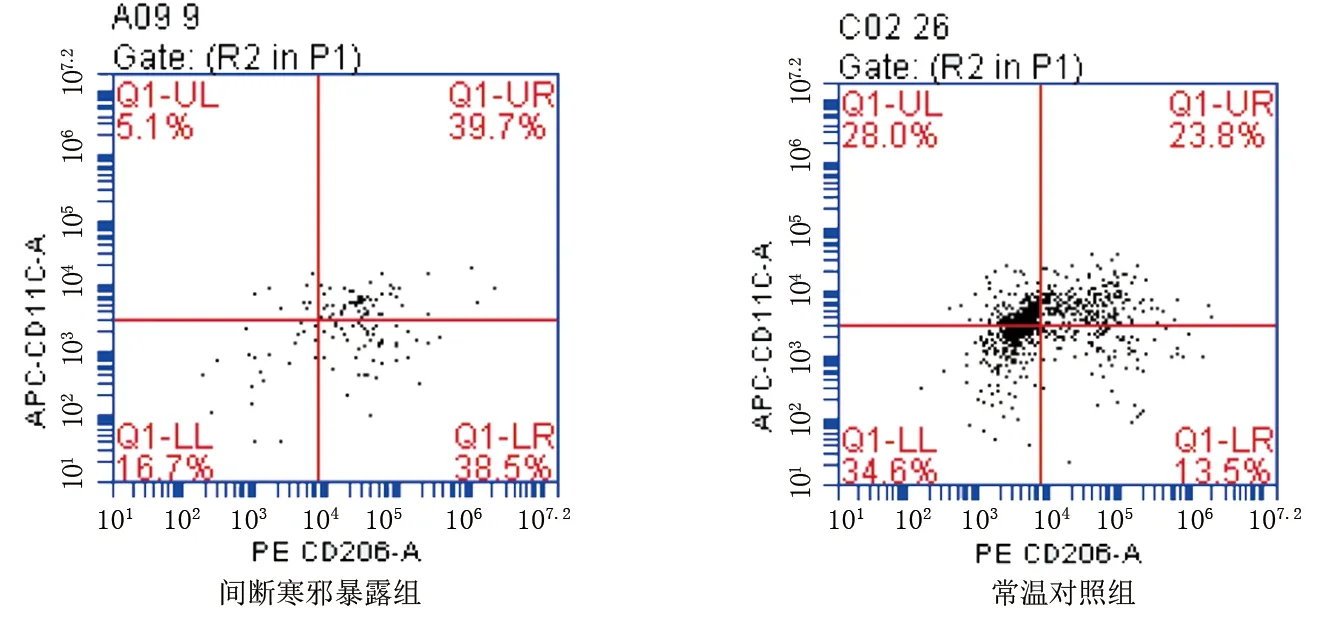
图3 流式细胞仪检测肩胛间区棕色脂肪组织中单核巨噬细胞M1、M2表达
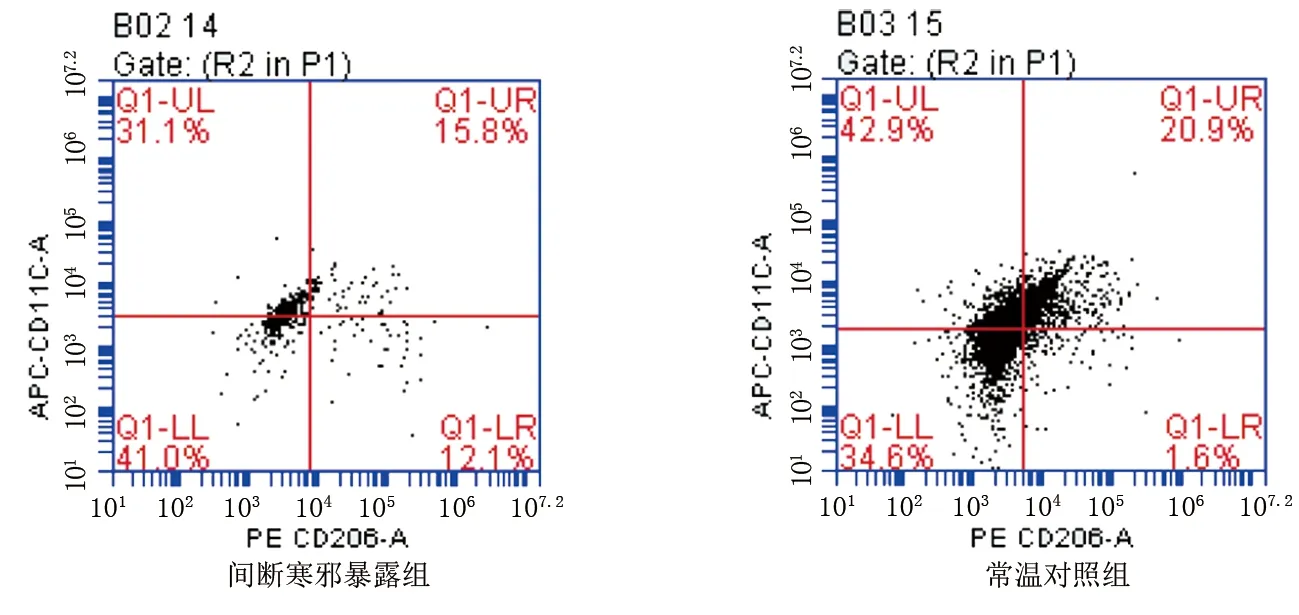
图4 流式细胞仪检测腹股沟白色脂肪组织中单核巨噬细胞M1、M2表达

图5 流式细胞仪检测附睾白色脂肪组织中单核巨噬细胞M1、M2表达
表4 两组肩胛间区棕色脂肪组织中巨噬细胞M1、M2占比及M1/M2比较(±s)
表5 两组腹股沟白色脂肪组织中巨噬细胞M1、M2占比及M1/M2比较(±s)
表6 两组附睾白色脂肪组织中巨噬细胞M1、M2占比及M1/M2比较(±s)
3 讨 论
中医关于寒与寒邪有很多论述,作为“风寒暑湿燥火”六气之一的寒,是为了完成万物的“闭藏”,正如《伤寒杂病论》中云:“冬时严寒,万类深藏,君子固密,则不伤于寒”。又如徐春甫《古今医统大全》中云:“夫春温夏热秋凉冬寒者,四时之正气也,以成生长收藏之用”。人类可“动作以避寒”,寒冷太过,则生“寒邪”,归于“六淫”[12]。寒邪致病,不唯冬季,《徐大椿医学全集》:“寒为肃杀之气……认为中寒不拘冬夏,或外中天地之寒,或内受饮食之冷,缘元气内虚,肤腠空豁,寒邪直中三阴之经”。本课题组曾提出,寒邪作用于人体生理状态下可以出现“寒极生热、热气生清”,病理状态下,出现“寒气生浊”[13]。课题组进一步提出“寒生浊气”[14]的概念,认为寒邪影响人体气机,可表现为实验室检查指标异常,包括血脂代谢紊乱。
临床研究发现,越来越多的肥胖病人、代谢综合征及糖尿病病人,常伴有以TG浓度升高为特征的血脂异常。富含TG的脂蛋白颗粒可能导致动脉粥样硬化事件的残留风险[15]。对动脉粥样硬化心血管疾病合并高TG血症病人,控制TG水平可以降低不良心血管事件发生率[16-17],在LDL-C控制达标时,心血管疾病的风险仍然较高,而TG作为心血管疾病的独立危险因素,降低TG水平将可能降低部分心血管疾病残余风险[18-19]。前期研究发现,C57BL/6J小鼠在持续寒邪暴露状态下,小鼠血浆中TC、TG、LDL-C明显下降;ApoE-/-小鼠在持续寒邪暴露状态下,小鼠TG仍明显下降,而LDL-C和TC明显升高[4,20],并且长期持续寒邪暴露并不能加重动脉粥样硬化,这并不能解释冬季心脑血管事件频发这一现象。本课题组认为自然环境下的冷暴露为间断寒邪暴露,这和持续寒邪暴露有很大的不同。本研究发现,间断寒邪暴露处理后,在TC、LDL-C、HDL-C差异不明显时,小鼠血浆中TG仍然降低了15.68%。表明间断寒邪暴露对于动脉粥样硬化TG可能有较好的影响,其与心血管疾病的关系有待进一步探讨。
多项临床研究证实炎症机制在动脉粥样硬化的形成中至关重要[21-22],其病理生理过程大体包括[23]:内皮细胞发生炎症;单核细胞及白细胞进入粥样硬化区;趋化因子和趋化蛋白参与炎症,细胞进一步进入内膜;单核细胞变成组织巨噬细胞,内化脂蛋白颗粒,产生泡沫细胞;泡沫细胞分泌炎性细胞因子、活性氧等介质;巨噬细胞凋亡,形成成熟斑块的脂质或坏死核心;吞噬细胞放大局部炎症反应;斑块纤维帽受损破裂,血栓形成进入血液。基于此过程,炎症将作为降低心血管疾病的部分残余风险的另一靶点[24]。抗炎治疗可以降低动脉粥样硬化血栓形成的风险。
肥胖与脂肪组织中慢性炎症密切相关,而单核巨噬细胞在脂肪炎症中尤为重要[20]。小鼠脂肪组织中巨噬细胞表型至少有两种,一种是促炎的M1表型,一种是抗炎的M2表型。M1型巨噬细胞产生促炎细胞因子,如肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)和单核细胞趋化蛋白-1(MCP-1);M2型巨噬细胞是抗炎巨噬细胞,其主要表达参与组织修复或重塑的CD206、精氨酸酶-1、白细胞介素-10(IL-10)。F4/80是脂肪组织中单核巨噬细胞的标记物,CD11c[25]是公认的脂肪细胞中巨噬细胞M1型的标记物,CD206为M2型标记物,即F4/80+CD11c+CD206-标记巨噬细胞M1型,用F4/80+CD11c-CD206+标记巨噬细胞M2型[26]。在高脂饮食诱导的肥胖状态下,小鼠脂肪中巨噬细胞表型由抗炎巨噬细胞M2型向促炎巨噬细胞M1型转化[27-28]。研究小鼠体质量及脂肪组织中巨噬细胞表型的变化可以了解小鼠脂肪组织的代谢性炎症状态。本研究结果显示,间断寒邪暴露后小鼠体质量降低,肩胛棕色脂肪组织中M1/M2明显降低,表明间断寒邪暴露可以减轻肩胛部位脂肪组织的炎症状态,间断寒邪暴露有减轻高脂饮食诱导的动脉粥样硬化小鼠皮下脂肪组织炎症状态趋势。这一结果与先前实验结果[29]并不一致,可能与造模的模型及造模方式不同有关。
本研究还发现,间断寒邪暴露后小鼠皮下脂肪组织并未堆积,这一结果与先前间断寒邪暴露促使小鼠皮下脂肪堆积的研究[9]并不一致,究其原因,可能与间断寒邪暴露干预时间及干预对象不同,本研究是从动脉粥样硬化模型造模成功后开始干预,而动脉粥样硬化模型更适宜研究冬季对动脉粥样硬化的影响。
综上所述,高脂饮食诱导的动脉粥样硬化小鼠,在间断寒邪暴露状态下,小鼠体质量较常温对照组降低,TG降低,肩胛间区棕色脂肪组织中单核巨噬细胞M1/M2明显降低。说明间断寒邪暴露可以降低动脉粥样硬化小鼠TG,减轻小鼠肩胛部位脂肪组织炎症状态。这一结论与冬季心脑血管事件频发的流行病学调查结果[30]不一致,说明间断寒邪暴露并不能很好地解释冬季心脑血管事件频发这一问题,仍需进一步展开研究。

