茉莉酸信号转录抑制关键组分JAZ与NINJA互作体系建立及复合体结晶条件筛选
曹晓蔓,张亚光,张峰
(南京农业大学植物保护学院,江苏 南京 210095)
茉莉酸(jasmonate,JA)是一种在高等植物中发现的内源性生长调节物质,在调节植物生长和胁迫相关反应中发挥重要的作用[1]。茉莉酸甲酯(jasmonate methyl ester,MeJA)和茉莉酸-异亮氨酸共轭物(jasmonoyl-isoleucine,JA-Ile)是一类脂肪酸的衍生物,统称为茉莉酸酯(JAs)[2]。在正常条件下,植物JA信号通路处于关闭状态,有2种由JASMONATE-ZIM DOMAIN蛋白(JAZ)介导的机制阻止信号转录。第1种是JAZ蛋白募集JAZ新型相互作用因子(novel interactor of JAZ,NINJA)和Groucho/Tupl-type共同受体TOPLESS(TPL)/TPL相关蛋白(TRP)通过直接的蛋白相互作用抑制下游转录因子;第2种是JAZ与MYC蛋白结合,导致MYC蛋白不能与转录调节复合体(MEDIATOR25,MED25)结合,从而不能起始转录。当植物受到胁迫或者侵害后,植物会积累具有生物活性的JA-Ile,促使F-box蛋白COI1和JAZ蛋白共受体的形成,导致JAZ蛋白泛素化以及降解,从而释放MYC蛋白,激活下游基因的表达[3-10]。
JAZ蛋白有2个保守的结构域,分别是位于羧基端的Jas结构域和位于中间的ZIM结构域。通过对Jas结构域的解析得知,在植物没有外界压力的情况下,Jas结构域是一段连续的螺旋并与MYC蛋白的JID和TAD区域有着广泛的互作。JA-Ile调控JAZ与COI1的互作,并诱导Jas结构域构象的改变[11]。ZIM结构域由包含TIFY基序在内的28个氨基酸组成,对ZIM结构域的研究主要集中在TIFY基序。TIFY基序功能是介导JAZ同源异源二聚体形成以及与NINJA互作,从而抑制JA信号通路[12-13]。NINJA过表达突变体减弱了JA对根系的抑制作用,表明NINJA蛋白在JA信号传导途径中起着负调控的作用[13]。然而,对于JAZ蛋白是如何通过与NINJA 蛋白的互作来介导茉莉酸信号抑制作用机制尚不明确。本文拟建立JAZ与NINJA蛋白的离体和活体互作体系,以及2个蛋白复合体晶体筛选的体系,为2个蛋白的复合体晶体结构解析奠定重要的理论基础,也为植物体内基于分子互作的转录抑制水平的精准调控以及植物免疫调节剂的创制奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株、基因、质粒DH5α菌株、BL21(DE3)菌株、酵母AH109菌株、农杆菌GV3101菌株、JAZ、NINJA、pGADT7质粒、pGBKT7质粒、pETDuet1质粒、pCV-nYFP质粒、pCV-cYFP质粒,均保存于南京农业大学植物保护学院农药靶标生物学实验室。
1.1.2 主要试剂与仪器ToloPrep柱式DNA胶回收试剂盒(36201-01)、2×Tolo Fast Pfu Premix、T4DNA连接酶均购于吐露港生物科技有限公司;限制性内切酶购于TaKaRa;聚乙二醇3350(PEG3350)、鲑鱼精DNA(SSDNA)、二硫苏糖醇(DTT)、醋酸锂(LiAC)均购于北京索莱宝科技有限公司;腺嘌呤、脱脂奶粉、甲醇、甘氨酸(Glycine)均购于上海生工生物工程有限公司;氨基酸缺失培养基购于北京酷来博科技有限公司;PVDF膜购于百赛利德;HA抗体购于赛默飞世尔科技有限公司;吗啉乙磺酸(MES)、乙酰丁香酮(AS)购于麦克林试剂公司;烟草蚀纹病毒(tobacco etch virus,TEV)半胱氨酸蛋白酶来源于本实验室;蛋白结晶试剂盒(美国Hampton Research公司)。
Eppendorf centrifuge 5424高速离心机、BECKMAN COULTER Avanti J-26S XP高速离心机、SPXAPV1000高压均质机、Cytiva AKTA pure 25蛋白纯化仪、莱卡激光共聚焦显微镜。
1.2 方法
1.2.1 酵母双杂交试验活化酵母菌AH109,使用One-Step Buffer(1 mol·L-1醋酸锂、60%PEG3350、1 mol·L-1DTT、10 mg·mL-1SSDNA)制备酵母菌感受态,通过42 ℃金属浴恒温器将质粒导入酵母菌感受态,涂布于二缺(-Leu/-Trp)固体培养基,置于28 ℃培养箱生长;取酵母单菌落进行扩大培养后,使用ddH2O调节酵母菌液A600值至1.0,取适量酵母菌接种于二缺固体培养基和四缺(-Leu/-Trp/-His/-Ade)固体培养基,置于28 ℃培养箱,观察其生长情况。
1.2.2 蛋白质印迹法收集酵母菌体,并用0.1 mol·L-1NaOH提取蛋白,样品在120 V电压下进行SDS-PAGE,在200 mA电流下转移至PVDF膜上,将PVDF膜进行封闭和抗体孵育后置于化学发光液中,于多功能成像仪上观察。
1.2.3 双分子荧光互补试验活化农杆菌GV3101,将质粒通过电转化仪转入农杆菌后涂布含卡那霉素和利福平抗性LB平板培养基,置于28 ℃培养箱中培养;取农杆菌单菌落进行扩大培养后,使用农杆菌悬浮液(100 mmol·L-1氯化镁、10 mmol·L-12-吗啉乙磺酸、150 μmol·L-1乙酰丁香酮,pH 5.6)调节A600值至0.5后,注射本氏烟草叶片,25 ℃温室继续培养36~60 h,使用激光共聚焦显微镜观察荧光。
1.2.4 Alpha Screen检测在避光条件下,完成反应体系(5 mg·mL-1镍螯合物受体株、5 mg·mL-1链霉亲和素供体株、His6标记蛋白、生物素多肽、10×Alpha Screen缓冲液)的配制并孵育;绿光条件下将样品转移至384孔板,每个试验组重复3次;避光条件下转移至多标记检测系统,在520~620 nm检测荧光信号并读数;使用GrapHpad prim软件处理数据。
1.2.5 氢氘交换质谱将纯化后的蛋白加入用D2O制成的50 mmol·L-1Tris缓冲液中,于4 ℃分别孵育0、10、30、60、300、900和3 600 s后,加入提前预冷的酸淬灭液(3 mol·L-1尿素,1%三氟乙酸)终止氢氘交换反应;使用固定化胃蛋白酶酶解氘代蛋白,将酶解混合物送至赛默飞生物科技有限公司进行质谱检测。
1.2.6 蛋白诱导表达将测序正确的质粒导入大肠杆菌BL21(DE3)感受态后制备种子液,按1∶100(体积比)将种子液加入LB液体培养基中,振荡培养至A600值为1.0,加入终浓度为100 μmol·L-1IPTG,16 ℃振荡诱导表达20 h后,离心,弃上清液,收集菌体。
1.2.7 亲和层析纯化使用高压均质机进行菌体破碎,离心收集蛋白上清液,将蛋白上清液上样于经过蛋白缓冲液(20 mmol·L-1Tris、200 mmol·L-1NaCl、10%甘油,pH7.5)处理的MBP(Maltose-binding protein)亲和层析柱,用蛋白洗脱缓冲液(20 mmol·L-1Tris、200 mmol·L-1NaCl、10%甘油、10 mmol·L-1麦芽糖,pH7.5)洗脱,收集洗脱液。
1.2.8 蛋白酶酶切按照500∶1(体积比)的比例向蛋白液中加入TEV半胱氨酸蛋白酶,混匀,将混合液置于4 ℃过夜酶切。
1.2.9 凝胶过滤层析纯化将HILoadTM16/600 SuperdexTM200 pg与AKTA pure 25蛋白纯化仪连接,使用峰收集方式,根据UV280吸收峰收集蛋白样品,通过SDS-PAGE检测目的蛋白。
1.2.10 晶体生长条件筛选将目的蛋白NINJA与JAZ多肽按照1∶1.5(物质的量比)进行混合后置于冰上孵育,将晶体生长缓冲液与蛋白混合液按照1∶1(体积比)进行混合,加入晶体板中,将晶体板置于 25 ℃培养,每天观察晶体生长情况并拍照。
2 结果与分析
2.1 酵母双杂交验证JAZ蛋白同源、异源及与NINJA互作区域
从图1可见:通过酵母双杂交发现JAZ3可与JAZ3、JAZ4和NINJA发生互作,而JAZ3 TIFY基序敲除体(JAZ3ΔTIFY)和JAZ3羧基端(CT)敲除体(JAZ3ΔCT)与JAZ3、JAZ4和NINJA不能发生互作;蛋白质免疫印迹试验结果排除了JAZ3ΔTIFY和JAZ3ΔCT不表达从而导致蛋白不能互作的可能性。综上所述,ZIM结构域是JAZ3与JAZ3、JAZ4和NINJA互作所必需的。
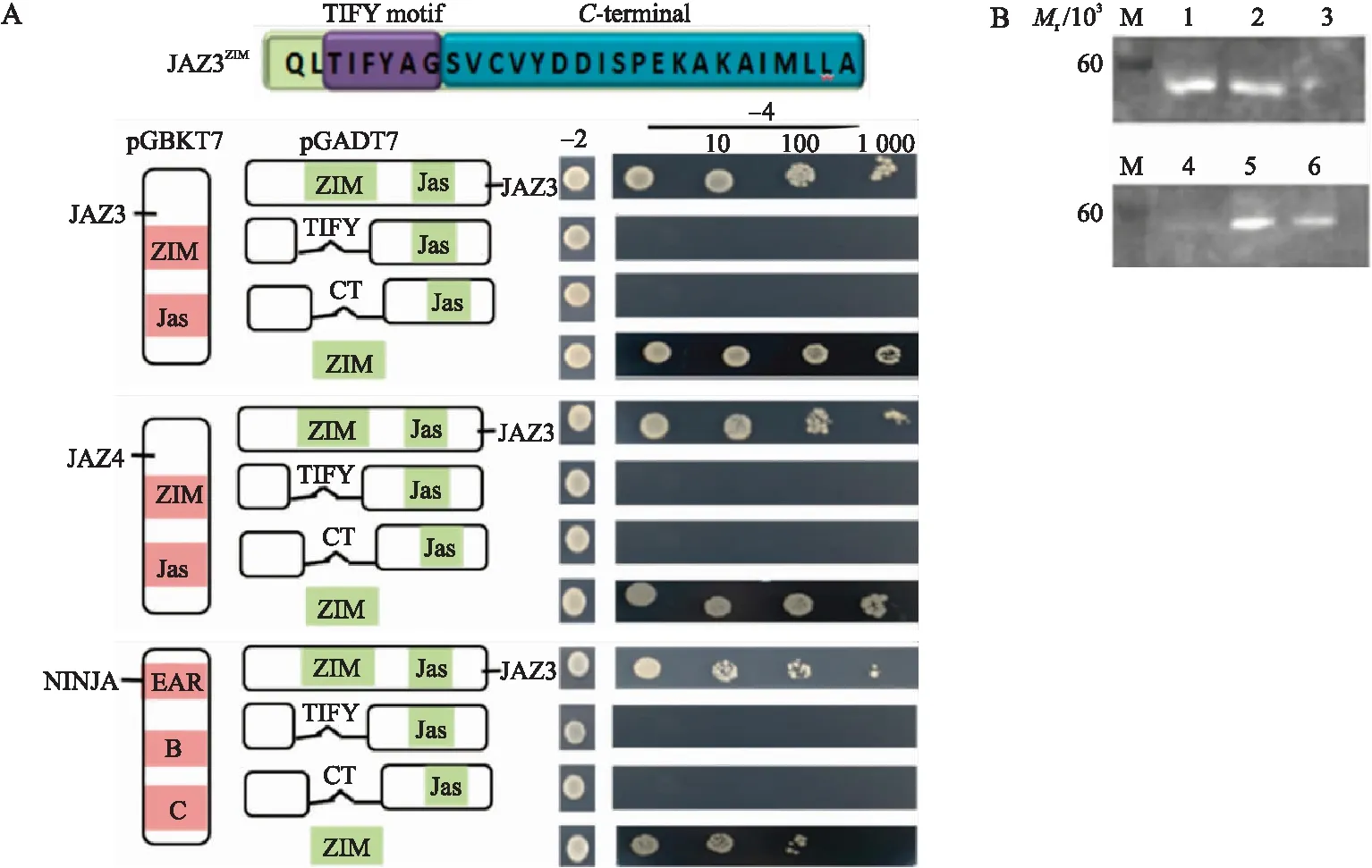
图1 JAZ蛋白ZIM结构域的酵母双杂交结果Fig.1 Yeast two-hybrid results of the ZIM domain of JAZ A. JAZ3与JAZ3、JAZ3与JAZ4、JAZ3与NINJA的酵母双杂交。Interaction JAZ3-JAZ3,JZA3-JZA4 and JAZ3-NINJA detected by yeast two-hybrid. -2、-4代表二缺和四缺培养基。-2,-4 indicate -Leu/-Trp and -Leu/-Trp/-His/-Ade medium. B. 敲除体JAZ3酵母双杂交的免疫印迹检测。Western blot for knockout protein mutants(M:Protein marker;1-3:JAZ3ΔCT;4-6:JAZ3ΔTIFY).
2.2 双分子荧光互补验证JAZ蛋白同源、异源及与NINJA互作区域
通过双分子荧光互补发现JAZ3CT与JAZ3ZIM、JAZ4ZIM和NINJA(322~425)互作,进一步证明ZIM结构域CT是JAZ3与JAZ3、JAZ4和NINJA互作所必需的(图2)。

图2 双分子荧光检测JAZ3CT与JAZ3ZIM、JAZ4ZIM和NINJA(322~425)的互作Fig.2 Detect interactions between JAZ3CT and JAZ3ZIM,JAZ4ZIM,NINJA(322-425) by bimolecular fluorescent complimentary
2.3 氢氘交换质谱检测NINJA(233~425)蛋白在溶液中稳定性
氢氘交换质谱结果表明,从蓝色到红色表示肽段上氢原子与重水中氘原子交换速率依次增高,交换速率高代表肽段稳定性低,交换速率低代表肽段稳定性高。上述结果表明,NINJA(233~425)蛋白在溶液中以不稳定状态存在(图3)。
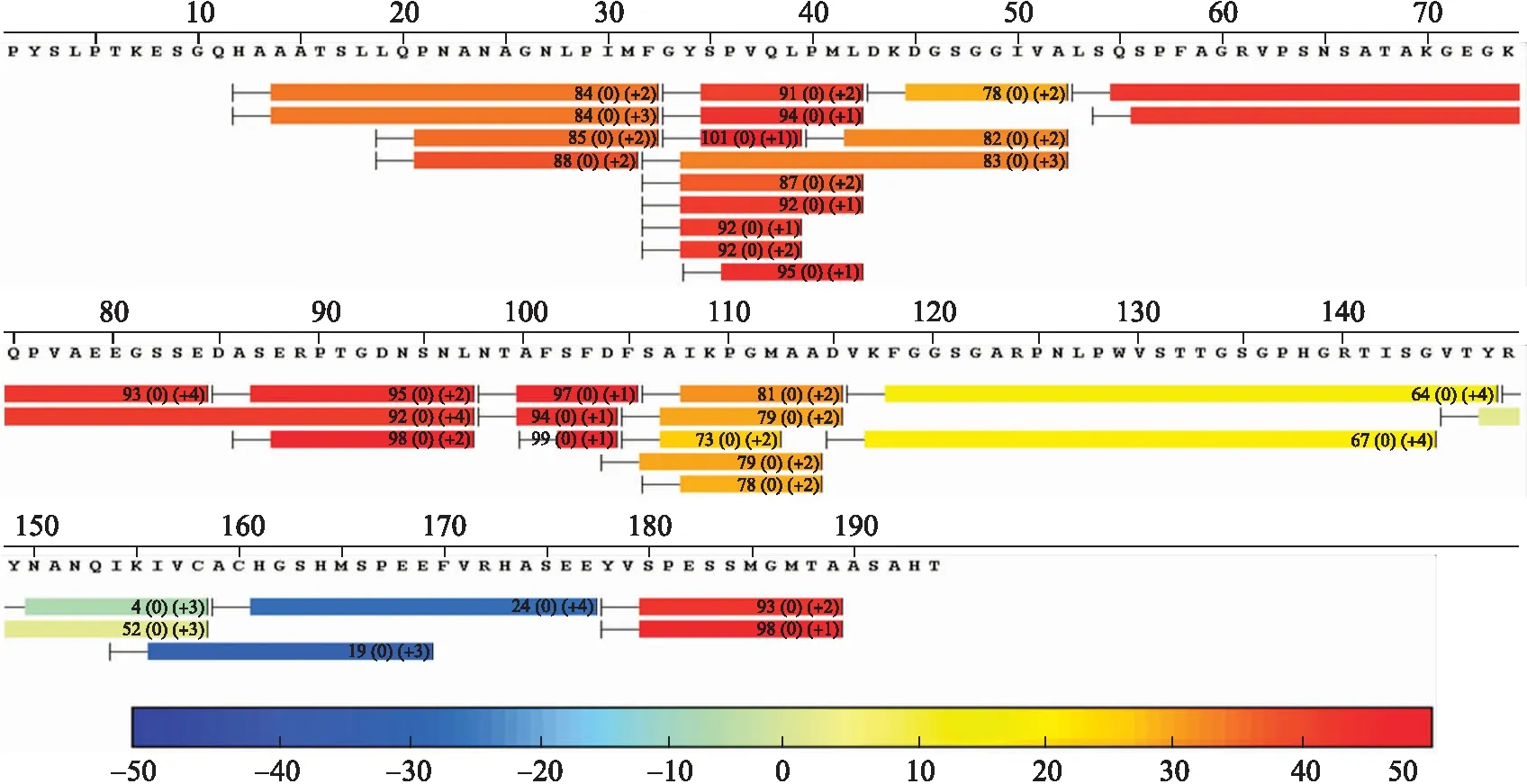
图3 NINJA(233~425)氢氘交换质谱结果Fig.3 The result of NINJA(233-425)hydrogen-deuterium exchange mass spectrometry
2.4 NINJA+JAZ复合体结合区域
向NINJA(233~425)蛋白加入JAZ蛋白,分别对2个蛋白进行氢氘交换质谱检测,发现NINJA(330~350)与JAZ蛋白ZIM结构域变为蓝色,表明这2个区域氨基酸处于更稳定状态,是JAZ与NINJA互作所必需的(图4)。
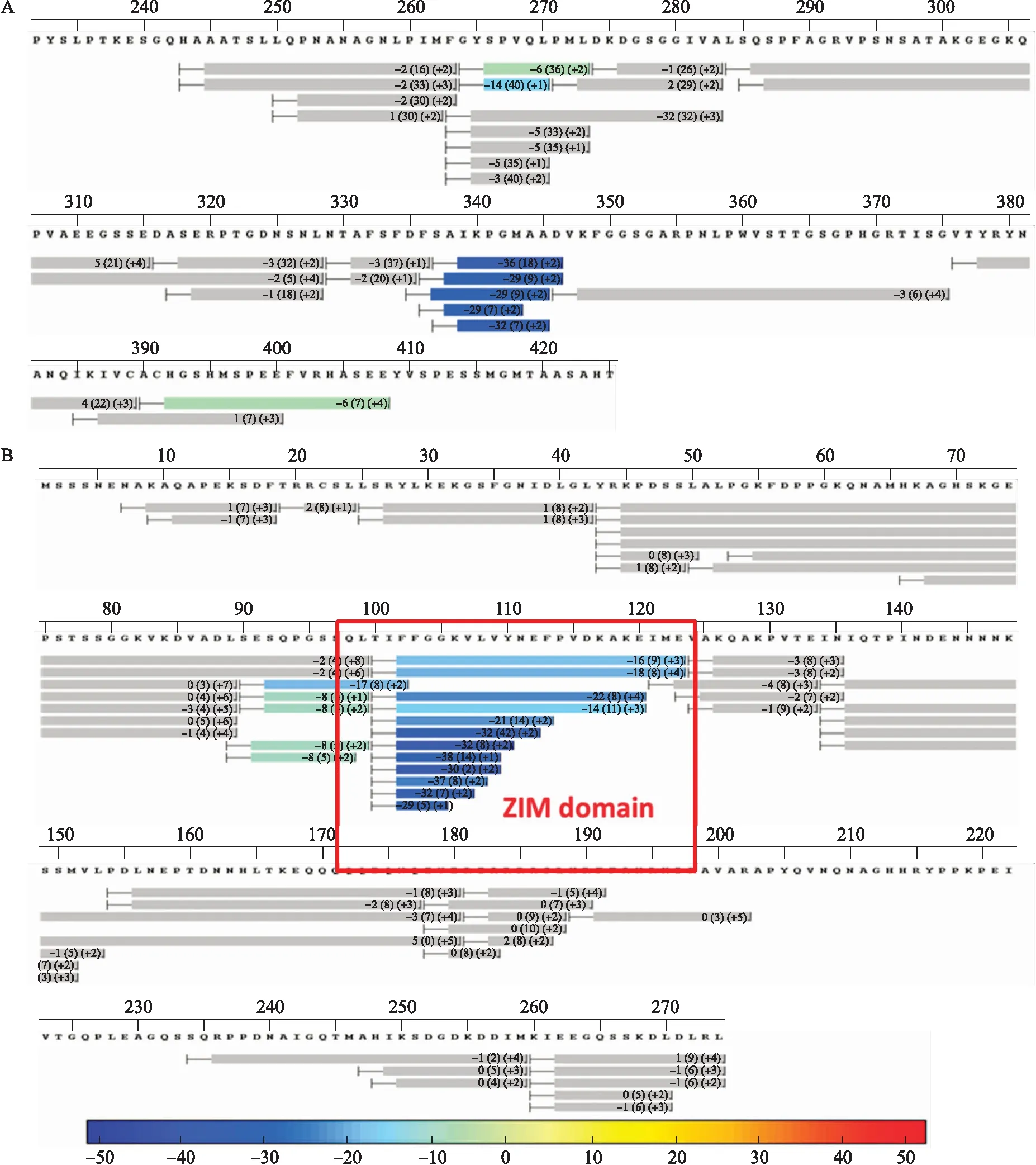
图4 NINJA(233~425)与JAZ的氢氘交换质谱Fig.4 Hydrogen-deuterium exchange mass spectrometry for NINJA(233-425)and JAZ A. NINJA(233~425)与JAZ混合液中NINJA(233~425)氢氘交换结果Hydrogen-deuterium exchange mass spectrometry for NINJA(233-425)appended with JAZ;B. NINJA(233~425)与JAZ混合液中JAZ氢氘交换结果 Hydrogen-deuterium exchange mass spectrometry for JAZ appended with NINJA(233-425).
2.5 Alpha Screen筛选NINJA与JAZ互作的最小区域
使用Alpha Screen离体互作手段筛选NINJA蛋白与JAZ蛋白互作最小区域,分别选取H6-NINJA(233~425)、H6-NINJA(342~425)、H6-NINJA(359~425)、H6-NINJA(342~406)截短蛋白与H6-NINJA蛋白全长形成对照,发现NINJA(342~406)与JAZ的ZIM结构域是2个蛋白互作最小区域(图5)。
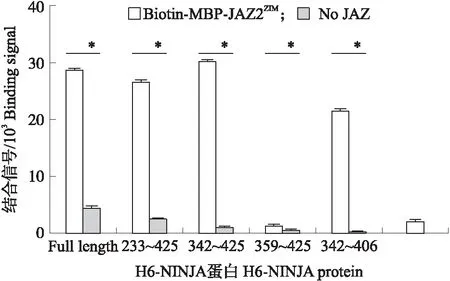
图5 NINJA与JAZ互作的Alpha Screen结果Fig.5 Alpha Screen assay for JAZ and NINJA interaction*P<0.05.
2.6 NINJA截短蛋白的外源表达
构建pETDuet1-MBP-TEV-NINJA(342~406)质粒,并利用大肠杆菌表达系统进行融合蛋白的表达,通过MBP亲和层析柱纯化和TEV蛋白酶酶切,获得NINJA(342~406)、TEV蛋白酶和MBP标签的混合液。其中,NINJA(342~406)蛋白相对分子质量约为6.8×103,MBP标签相对分子质量约为42×103,TEV蛋白酶相对分子质量约为28×103(图6)。
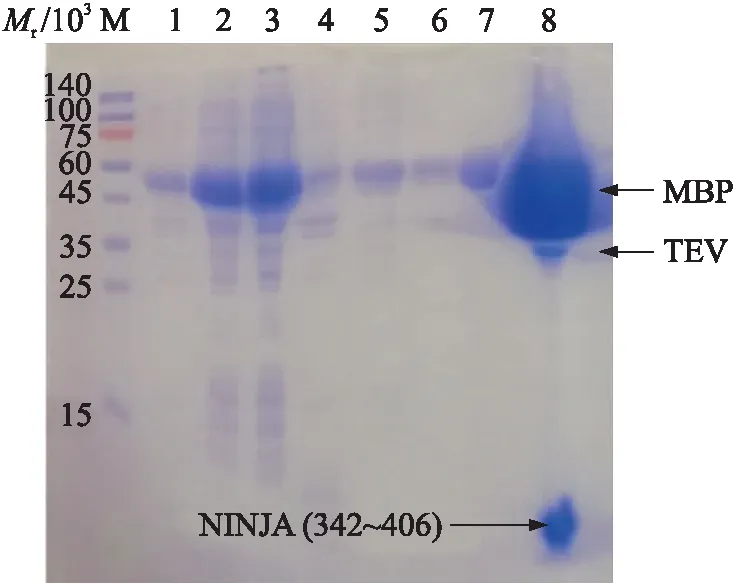
图6 pETDuet1-MBP-TEV-NINJA(342~406) 表达纯化及酶切结果Fig.6 pETDuet1-MBP-TEV-NINJA(342-406)expression, purification and restriction digestion results M.蛋白分子量标准Protein marker;1. 诱导前Uninduce;2. 诱导后Induce;3. 上清液Supernatant;4. 沉淀Pellet;5. 流穿Flow through;6. 缓冲液冲洗液Wash;7. 洗脱Elution;8. 酶切Digestion;MBP:麦芽糖结合蛋白Maltose-binding protein;TEV:TEV蛋白酶TEV protease.
2.7 凝胶过滤层析检测NINJA截短蛋白在溶液中状态
通过凝胶过滤层析将目的蛋白NINJA(342~406)从3种蛋白混合液中进行分离。根据分子质量大的蛋白先出峰,分子质量小的蛋白后出峰的原理,收集57~61号收集管内蛋白溶液进行SDS-PAGE验证,使用紫外分光光度计检测蛋白浓度,最终获得6.8 mg·mL-1目的蛋白NINJA(342~406)(图7)。由于NINJA(342~406)蛋白相对分子质量约为6.8×103,使用15%SDS-PAGE进行验证,NINJA(342~406)以单体形式存在,在目的蛋白的顶峰位置存在少许杂蛋白,但目的蛋白纯度已达到蛋白质结晶的要求。
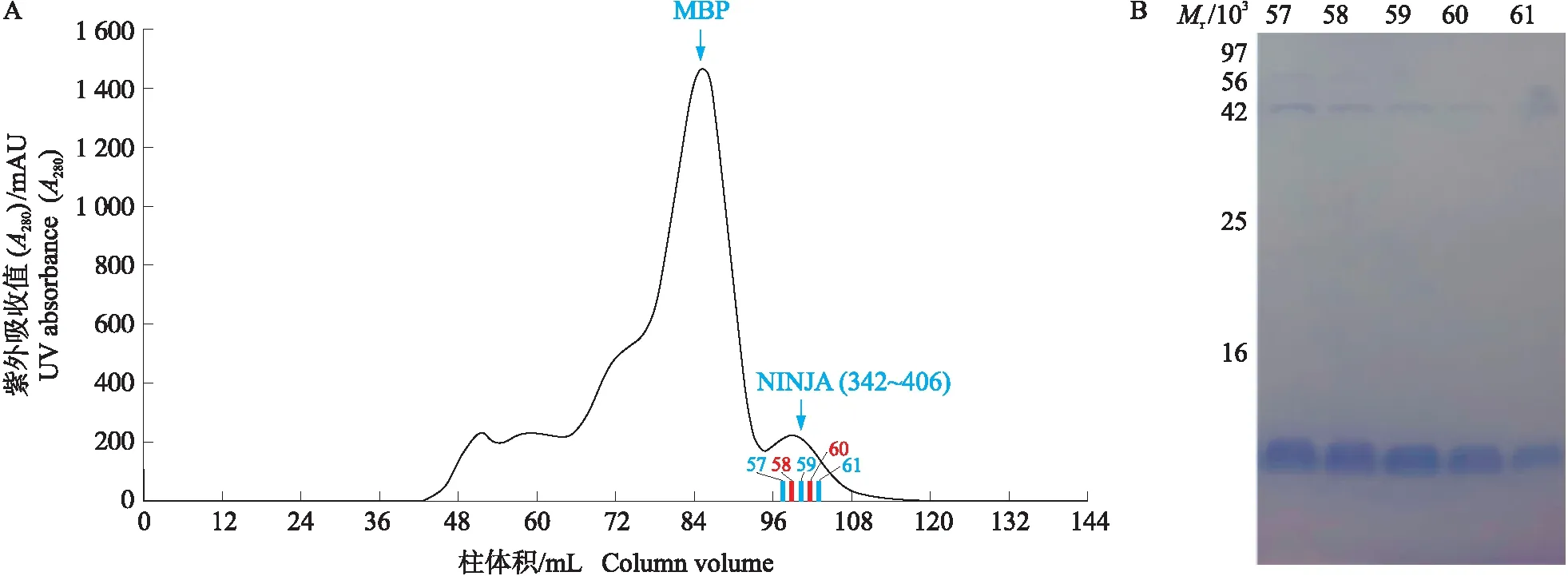
图7 NINJA(342~406)分子排阻色谱纯化(A)及收集液的SDS-PAGE电泳(B)Fig.7 Size exclusion chromatograms of NINJA(342-406)(A)and SDS-PAGE for collections(B)
2.8 溶液状态下检测NINJA(342~406)与JAZ蛋白ZIM多肽(JAZZIM)的互作
NINJA(342~406)蛋白相对分子质量为6.8×103,NINJA(342~406)+JAZ2ZIM相对分子质量为10.2×103。从图8所知:NINJA与JAZ2ZIM多肽在溶液状态下形成较强的相互作用,复合体的出峰位置较NINJA单体出峰位置前移。其中蓝色曲线为NINJA(342~406)蛋白溶液层析图,红色曲线为NINJA(342~406)蛋白与JAZ2ZIM多肽混合溶液层析图(图8)。
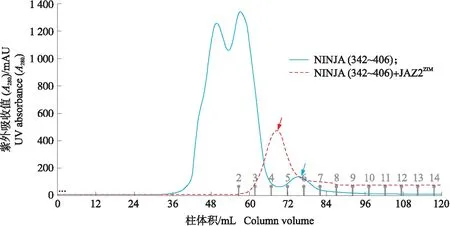
图8 NINJA(342~406)与NINJA(342~406)+JAZ2ZIM复合体分子排阻色谱结果的拟合Fig.8 Overlay of size exclusion chromatograms for NINJA and NINJA(342-406)+JAZ2ZIM
2.9 NINJA(342~406)与JAZ蛋白ZIM多肽复合体结晶条件的筛选
使用Hampton research晶体高通量筛选试剂盒对NINJA(342~406)+JAZ2ZIM复合体结晶条件进行筛选。4 d后,分别在0.2 mol·L-1CaCl2·2H2O、0.1 mol·L-1BIS-Tris(pH6.5)、45% 2-甲基-2,4-戊二醇和 0.2 mol·L-1醋酸铵、0.1 mol·L-1Tris(pH8.5)、45% 2-甲基-2,4-戊二醇条件下,均得到NINJA(342~406)+JAZ2ZIM复合体晶体,10 d后复合体晶体停止生长(图9)。对上述晶体进行X-ray衍射,确定是蛋白质晶体,但是分辨率大于4 Å,故没有收集衍射数据。
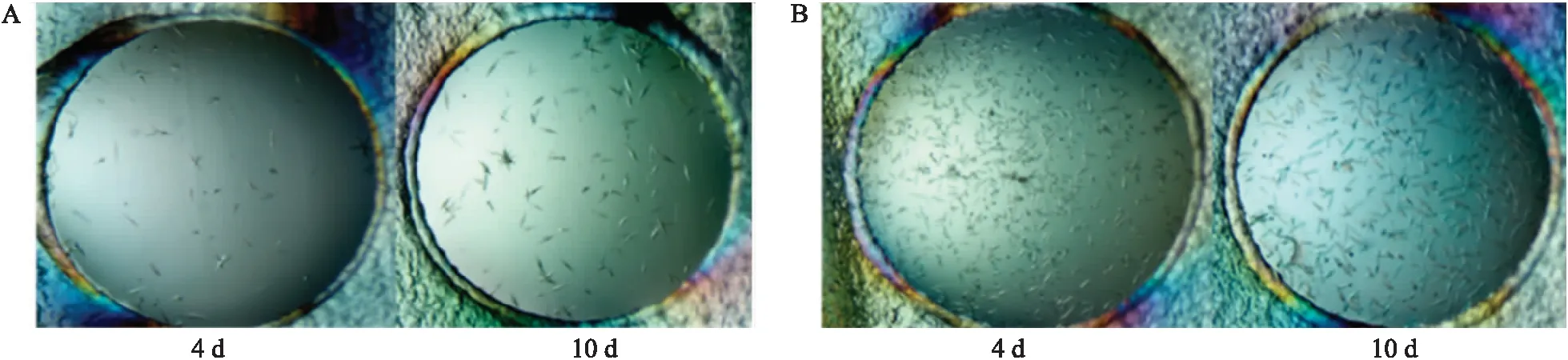
图9 不同条件下的NINJA(342~406)+JAZ2ZIM复合体晶体形态Fig.9 Complex crystals of NINJA(342-406)+JAZ2ZIM in the different conditions A. 生长条件为0.2 mol·L-1 CaCl2·2H2O、0.1 mol·L-1 BIS-Tris(pH6.5)、45% 2-甲基-2,4-戊二醇;B. 生长条件为0.2 mol·L-1醋酸铵、0.1 mol·L-1 Tris(pH8.5)、45% 2-甲基-2,4-戊二醇。A. The growth conditions are 0.2 mol·L-1 CaCl2·2H2O, 0.1 mol·L-1 BIS-Tris(pH6.5),45% 2-methyl-2,4-pentanediol;B. The growth conditions are 0.2 mol·L-1 ammonium acetate,0.1 mol·L-1 Tris(pH8.5),45% 2-methyl-2,4-pentanediol.
3 讨论
蛋白质是生命活动的体现者,大部分生物学过程需要蛋白质之间的相互作用来调控,比如信号转导和细胞周期等[14-18]。本文使用酵母双杂交系统证实JAZ3蛋白ZIM结构域的TIFY基序及羧基端的氨基酸序列是JAZ同源和异源互作及与NINJA互作所必需的。在此结果基础上,通过双分子荧光互补系统进一步证实JAZ蛋白ZIM结构域羧基端的氨基酸序列可直接与JAZ及NINJA蛋白互作,进一步证实了酵母双杂交的结果。在本试验中,NINJA蛋白在水溶液状态下结构不稳定,其羧基端的蛋白序列氢氘交换速率较高,意味着稳定性较低,不宜利用蛋白质结晶技术进行结晶。在NINJA蛋白溶液中加入JAZ蛋白,发现NINJA蛋白330~350的氨基酸序列及JAZ蛋白的ZIM结构域氢氘交换速率大幅降低,意味着JAZ与NINJA结合后复合体的结构状态趋于稳定,说明可以尝试利用蛋白质结晶技术对JAZ与NINJA的复合体进行结晶筛选及结构解析。本文中NINJA和JAZ分别偶联组氨酸及生物素标签,分别结合镍螯合物受体株及链霉亲和素供体株,如果NINJA及JAZ之间产生互作,则有信号产生。结果表明,NINJA蛋白的342~406氨基酸序列及JAZ蛋白的ZIM结构域是NINJA与JAZ互作的最小区域。基于该结果进行了NINJA及JAZ蛋白表达载体的构建及蛋白的纯化。
结构生物学是以生物大分子及其复合物的三维原子结构为基础,全面阐述重要生命过程的分子机制。在结构生物学研究中,能够获得稳定表达且有活性的蛋白是研究的基础。通过基因重组技术,使用不同的蛋白质表达系统,利用不同的纯化标签进行蛋白质分离纯化,最后通过蛋白酶将标签和目的蛋白分离,获得目的蛋白。本文将NINJA(342~406)与MBP标签进行融合,利用大肠杆菌表达系统进行蛋白表达,经亲和层析纯化得到融合蛋白后利用TEV蛋白酶将MBP切除,得到纯度较高的目的蛋白。因为JAZ蛋白的ZIM 结构域片段较小,通过蛋白质合成的方法合成了ZIM多肽。将NINJA(342~406)与ZIM多肽以一定比例孵育后进行结晶条件的筛选,最终在一定条件下得到了晶体,并通过X-ray衍射证实是蛋白质晶体。NINJA和JAZ均没有同源结构,下一步将对NINJA蛋白进行硒代蛋白的纯化及结晶,并对结晶条件进行优化,以期解析NINJA与JAZ蛋白的复合体晶体结构并揭示两者的分子互作机制。
TIFY基序的功能是介导JAZ同源异源互作以及与NINJA互作,对拟南芥中12个JAZ蛋白ZIM结构域进行同源性比对发现,ZIM结构域羧基端氨基酸很保守,但是这些氨基酸的功能仍然不清楚[12]。根据Chung等[12]的研究,JAZ3蛋白既形成同源异源二聚体又与NINJA蛋白互作,为保证试验结果的全面性,选择JAZ3蛋白为研究对象。通过酵母双杂交和双分子荧光互补手段验证活体条件下ZIM结构域羧基端是JAZ与JAZ、NINJA互作所必需的。离体条件下,通过氢氘交换质谱手段初步筛选JAZ与NINJA互作区域并确定二者复合体更容易结晶。采用Alpha Screen体系确定NINJA(342~406)与JAZ2ZIM互作,构建pETDuet1-MBP-TEV-NINJA(342~406)重组质粒,使用原核表达系统获得复合体晶体,对于复合体晶体进行X-ray衍射,确定是蛋白质晶体,因为分辨率大于4 Å,故没有收集衍射数据。事实上在对晶体进行衍射之前均进行了蛋白晶体的确认,比如染色或者电泳的方法。有些时候因为蛋白晶体较小、较少或较为珍贵,为了得到晶体的初步数据,会直接进行X-ray衍射,也能够得到晶体是否为蛋白质晶体的确切结论。本文蛋白质晶体的获得为2个复合体结构解析奠定重要的理论基础,其结果还为植物体内基于分子互作的转录抑制水平的精准调控以及植物免疫调节剂的创制奠定基础。
——一道江苏高考题的奥秘解读和拓展

