OsGLO1调控水稻抗稻瘟病的机制研究
李娇,圣聪,李涛,喻晗晞,李绚,赵弘巍
(南京农业大学植物保护学院/生物互作与作物健康重点实验室,江苏 南京 210095)
由稻瘟病菌(Magnaportheoryzae)引起的稻瘟病是威胁水稻生产的最严重的病害之一[1]。滥用和不规范施用化学药剂对稻瘟病进行防治,严重影响环境和粮食安全。培育具有持久抗性的水稻新品种成为农业可持续发展的重要途径。除了传统的育种手段,通过分子生物技术重组水稻抗病遗传资源具有极大的发展前景。近年来,越来越多的科学家从植物与病原菌的互作方面着手,试图从分子水平对稻瘟病的抗病机制进行解析,通过基因表达和沉默技术等手段研究水稻抗病机制。
乙醇酸氧化酶(GLO)是光呼吸中的关键酶,催化乙醇酸氧化成乙醛酸,产生等物质的量的过氧化氢(H2O2)[2]。细胞内H2O2是重要的活性氧(ROS)组分,还是氧化还原信号的主要传递物,在各种生物过程中起着重要作用[3-5]。作为植物中的信号分子,活性氧在植物抗病免疫反应中发挥重要作用[6-8]。过氧化物酶体中的H2O2主要由乙醇酸氧化酶(GLO)催化的乙醇酸氧化反应贡献[2]。因此,GLO的生理功能通常被认为与H2O2信号传导有关[9-10]。GLO在植物应对非生物胁迫中能发挥一定作用,如高温、强光、干旱等[11-14]。此外,GLO还涉及植物对病原生物的抗性,如烟草、拟南芥中GLO基因的沉默会导致其抗病性减弱[13,15-17],但是水稻GLO是否在抗稻瘟病中起作用还未见报道。
水稻基因组编码4个GLO基因,分别是OsGLO1(Os03g0786100)、OsGLO3(Os04g0623500)、OsGLO4(Os07g0152900)和OsGLO5(Os07g0616500)。Zhang等[18]报道OsGLO1和OsGLO4主要在水稻叶片中表达,而OsGLO3和OsGLO5主要在根中表达。GLO1和GLO4是水稻中GLO活性的主要贡献者,并且它们的表达紧密协调。本课题组前期通过研究水稻原生质体过表达和沉默试验,发现OsGLO1可以激活水稻的早期防卫反应,并调控水杨酸(SA)和茉莉酸(JA)的相关防卫基因的表达水平[19]。
植物激素涉及植物生长发育的各个方面,并且植物可以通过调控激素信号传导途径来应对生物和非生物胁迫[20-22]。特别是在应对病原菌侵入时,植物激素发挥重要作用。不同类型的病原体可能需要植物激活不同的信号传导途径,包括SA、JA和乙烯信号传导等。其中,SA和JA是特征明确的“防御激素”[23]。SA和JA广泛分布于植物类群中,在植物抗病免疫防御中都发挥重要作用[24-25]。本研究旨在探讨OsGLO1在水稻对稻瘟病抗性调控过程中的作用机制,为培育抗稻瘟病的种质资源提供新的思路和方向。
1 材料与方法
1.1 植物材料
以水稻(Oryzasativa)品种‘ZH11’(野生型)以及OsGLO1过表达(OsGLO1-OE)和基因沉默(cas9-glo1)的转基因水稻为材料,在28 ℃恒温箱催芽5 d,将已发芽的种子植入土壤中,在25 ℃、光/暗培养时间为12 h/12 h的温室中生长4周。
1.2 水稻基因组提取
将0.5 g水稻叶片在液氮中研磨成粉末,转移至1.5 mL离心管中,加入500 μL CTAB提取液,摇匀,置于65 ℃水浴锅中15 min,在室内稍微冷却后,加入500 μL苯酚、氯仿、异丙醇(体积比为25∶24∶1)混合液,涡旋振荡20 s,静置5 min,在室温、12 000g离心10 min。吸取上清液于新的1.5 mL EP管中,加入等体积的异丙醇,上下颠倒混匀后,置于-20 ℃冰箱中沉淀3 h以上。将沉淀后的样品4 ℃、12 000g离心 15 min。弃上清液,加入1 mL 75%乙醇溶液,涡旋振荡20 s,4 ℃、12 000g离心5 min。重复此操作2次。弃上清液,放入超净台或者通风橱中吹15 min左右,沉淀变为透明状态即可。最后加入适量的双蒸水溶解DNA,测定浓度后保存于-70 ℃冰箱备用。
1.3 PCR扩增
PCR扩增反应程序:94 ℃ 3 min;94 ℃ 15 s,55 ℃15 s,72 ℃ 30~60 s,34个循环;72 ℃ 5 min。cas9-glo1的上游扩增引物为5′-TTTGGTATCGCCTTCATGTTTCAGAC-3′,下游扩增引物为5′-CCTCGTAACTGGG-TCGTTCATGCTCTT-3′。
1.4 病原菌培养和叶片接种
将稻瘟病菌株Guy11和GZ1(eGFP-tagged Zhong-1,该菌株在原始菌株Zhong-1中加入GFP标签)接种于稻秆培养基(SDC),于28 ℃恒温箱中培养。3 d后将在平板上生长的菌丝刮除,然后转至室内组织培养架上,黑光灯光照培养3 d,诱导孢子形成并收集孢子。在5叶期的水稻叶片表面用10 μL的移液器吸头制造戳伤(伤口间距约为1.3 cm),然后根据Kong等[26]的方法将分生孢子浓度调整为5×105mL-1,加入明胶并使其最终浓度为4 g·L-1,混匀后在每个伤口部位滴加10 μL孢子悬浮液。于25 ℃恒温箱遮光过夜后,置于25 ℃光照培养箱(光/暗时间为12 h/12 h)继续培养。接种5 d后对病害进行拍照,并通过定量PCR比较MoPot2的DNA水平来测定真菌的增殖情况[27]。
1.5 活性氧检测和显微镜分析
使用DAB染色观察稻瘟病菌接种的叶片和叶鞘中H2O2的产生位置和积累量[28]。用Guy11孢子悬浮液(2×105mL-1)对5叶期水稻植株的叶片进行浸泡侵染(10 mL离心管中加入7~8 mL孢子悬浮液,每管放入3段6 cm左右的叶片),于25 ℃恒温箱遮光过夜,再在25 ℃光照培养箱(光/暗时间为12 h/12 h)培养,48 h后使用DAB染色液(pH3.0)对H2O2染色(染色时间大于8 h,于25 ℃培养室避光),然后倒弃DAB,加入漂洗液(乙醇、乙酸、甘油的体积比为3∶1∶1),90~95 ℃水浴15 min脱色,用双蒸水清洗叶片后,制成玻片在显微镜下观察,采用倒置荧光显微镜(Zeiss Axio observe 3)捕获图像。
1.6 植物叶片中的H2O2含量测定
分别剪取Guy11侵染5 d的水稻叶片和未侵染的叶片,在液氮中充分研磨,加入9倍体积的生理盐水,冰水浴条件下机械匀浆,10 000g离心10 min,取上清液待测。用南京建成生物工程研究所的H2O2试剂盒测定H2O2含量。
1.7 GZ1菌株的叶鞘侵染
通过叶鞘注射接种稻瘟病菌GZ1以观察稻瘟病的侵染过程。参照文献[28]的方法,将稻瘟病菌株GZ1的孢子悬浮液浓度调至1×105mL-1,用注射器(1 mL)将孢子悬浮液从分蘖期水稻上剥离叶鞘的一端注入,静置于润湿的滤纸上,于28 ℃恒温箱培养。48 h后切除叶鞘的表皮层,在倒置荧光显微镜(Zeiss Axio observe 3)下观察,并对病菌的侵染过程拍照和分析。每个品种的病菌侵染统计均超过100个分生孢子。
1.8 RNA 提取及荧光定量 PCR
收集不同处理条件下的3叶期叶片,在液氮保护下进行研磨,使用TRIzol试剂(Invitrogen)进行RNA提取。cDNA的合成采用逆转录试剂盒(TaKaRa)。使用荧光定量PCR方法检测防卫相关基因(OsEDS1、OsICS1、OsPAD4、OsPR1a、OsMYC2、OsPBZ1、OsCOL1b和Mopot2)的表达量。引物信息见表1。
1.9 数据处理与分析
采用Excel 2016软件进行数据处理,用SPSS 22.0软件进行差异显著性检验,采用Duncan’s方法进行多重比较。
2 结果与分析
2.1 OsGLO1转基因水稻的验证
以ZH11和OsGLO1-OE的cDNA为模板,通过实时荧光定量PCR对OsGLO1的表达量进行检测和分析。结果表明,OsGLO1-OE中OsGLO1的表达量比ZH11高7倍左右(图1-A),说明OsGLO1基因过表达水稻构建成功。分别提取ZH11和cas9-glo1水稻植株的DNA进行PCR扩增,再进行Sanger测序和序列比对分析。与ZH11相比,cas9-glo1的基因序列中插入了1个“T”碱基(图1-B),说明OsGLO1基因沉默水稻构建成功。荧光定量PCR和PCR扩增结果确定了转基因植物的正确性,为下一步试验奠定了良好的基础。
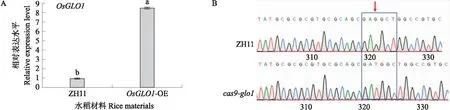
图1 OsGLO1过表达和沉默构建Fig.1 Construction of OsGLO1 over-expression and silencing rice A. OsGLO1在ZH11和OsGLO1-OE中的相对表达量;B. ZH11和cas9-glo1的序列比对分析,箭头指示插入位点(n=3)。不同字母表示不同处理在0.05水平差异显著。A. The relative expression level of OsGLO1 in ZH11 and OsGLO1-OE;B. Sequence alignment analysis of ZH11 and cas9-glo1,the arrow indicates the insertion site(n=3). Different letters above the bars indicate significant differences at the 0.05 level among treatment.
2.2 OsGLO1对水稻稻瘟病抗性的影响
使用稻瘟病菌株Guy11孢子悬浮液分别侵染ZH11、cas9-glo1和OsGLO1-OE植株的离体叶片。侵染 5 d 后观察,发现ZH11水稻呈明显发病症状,病斑呈梭型,中心呈深褐色,病斑上、下端呈枯黄色并向上、下端延伸。与ZH11相比,cas9-glo1的病斑面积明显增大,中心的深褐色区域明显大于野生型,上、下两端的枯黄色延伸更为明显;OsGLO1-OE的叶片病斑面积和中心深褐色区域以及向上、下两端的延伸程度都明显弱于野生型(图2-A)。定量PCR测定结果显示,在OsGLO1过表达水稻叶片中的真菌生物量显著少于其在ZH11水稻中的生物量,而cas9-glo1叶片中的真菌生物量则显著增多(图2-B)。这些结果证实,OsGLO1过表达增强了水稻对稻瘟病的抗性,并抑制稻瘟病菌生长;而OsGLO1沉默抑制了水稻对稻瘟病的抗性,使真菌在叶片组织内增殖更多。

图2 OsGLO1对水稻稻瘟病抗性的影响Fig.2 Effects of OsGLO1 on rice resistance to the blast disease A. Guy11孢子悬浮液侵染离体水稻叶片5 d后的抗病性表型;B. 接种叶片的相对真菌生长量的定量分析。A. Guy11 spore suspension infects the detached rice leaves,disease symptom was recorded 5 days after infection;B. Quantitative analysis of the relative fungal growth on the inoculated leaves.
2.3 OsGLO1对稻瘟病菌生长的影响
使用GZ1菌株侵染水稻叶鞘,再在荧光倒置显微镜下观察和分析稻瘟病菌对叶鞘细胞的侵染情况(图3-A)。侵染48 h后,在ZH11、cas9-glo1和OsGLO1-OE水稻叶鞘中都可以观察到GZ1侵染性菌丝,但GZ1的菌丝在OsGLO1-OE水稻叶鞘中的积累程度明显弱于ZH11株,而在cas9-glo1水稻叶鞘中的积累程度明显高于ZH11株。进一步统计结果表明,GZ1侵染48 h后,在ZH11叶鞘中约25%的稻瘟病菌丝扩展到第3个细胞及以上,约16%的菌丝开始侵入邻近细胞,约48%已经开始侵入第1个细胞,约10%稻瘟病菌仅仅形成附着胞。与ZH11相比,cas9-glo1中约66%的稻瘟病菌丝扩展到第3个细胞及以上,约21%的菌丝开始侵入邻近细胞,约11%的菌丝开始进入第1个细胞,只有约5%稻瘟病菌停留在附着胞阶段。在OsGLO1-OE 叶鞘中,约10%和8%的菌丝分别进入第3个和第2个细胞,侵染第1个细胞的比例高达67%,还有高达15%的仅仅形成了附着胞(图3-B)。上述结果表明,与野生型比较,GZ1在cas9-glo1中的侵染情况明显加重,而在OsGLO1-OE中的侵染明显减弱,进一步证明OsGLO1正调控水稻对稻瘟病的抗病性。
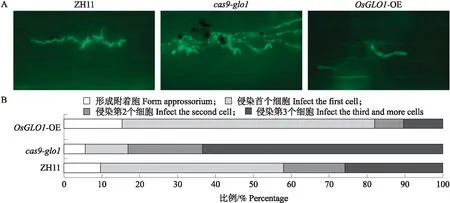
图3 OsGLO1对稻瘟病菌生长的影响Fig.3 Effects of OsGLO1 on Magnaporthe oryzae development A. 倒置荧光显微镜下稻瘟病菌株GZ1侵染叶鞘细胞后48 h的生长情况;B. 对GZ1接种叶鞘48 h后的侵染情况进行定量分析。每个品种的病菌侵染均超过100个分生孢子。A. Hyphae development of the rice blast strain GZ1 in leaf sheath cells under an inverted fluorescence microscope at 48 h;B. Quantitative analysis of the infestation of GZ1 leaf sheath 48 h after inoculation. The fungal infection rate was calculated by using more than 100 conidia.
2.4 OsGLO1对稻瘟病菌侵染后水稻H2O2积累的影响
用Guy11分别侵染水稻离体叶片和叶鞘后,再进行DAB染色,观察稻瘟病菌诱导的活性氧积累情况。侵染48 h后观察,发现ZH11叶片中附着胞周围无活性氧积累。与ZH11相比,OsGLO1-OE叶片中附着胞周围活性氧积累显著增加,而在cas9-glo1中无显著变化(图4-A)。Guy11侵染后的ZH11叶鞘细胞中,菌丝周围有少量活性氧积累。与ZH11相比,cas9-glo1叶鞘细胞中菌丝周围的活性氧积累减少,而OsGLO1-OE中的活性氧显著增加(图4-B)。进一步对Guy11侵染后叶片的H2O2含量进行检测,发现与ZH11相比,OsGLO1-OE 叶片中的H2O2含量显著增加,而cas9-glo1的H2O2含量显著降低。与对照(未侵染的水稻叶片)相比,ZH11和OsGLO1-OE的H2O2含量都显著增加,而cas9-glo1中的H2O2含量无显著变化(图4-C)。这表明OsGLO1过表达植株能通过诱导早期防卫信号ROS的积累来增强对稻瘟病的免疫反应。
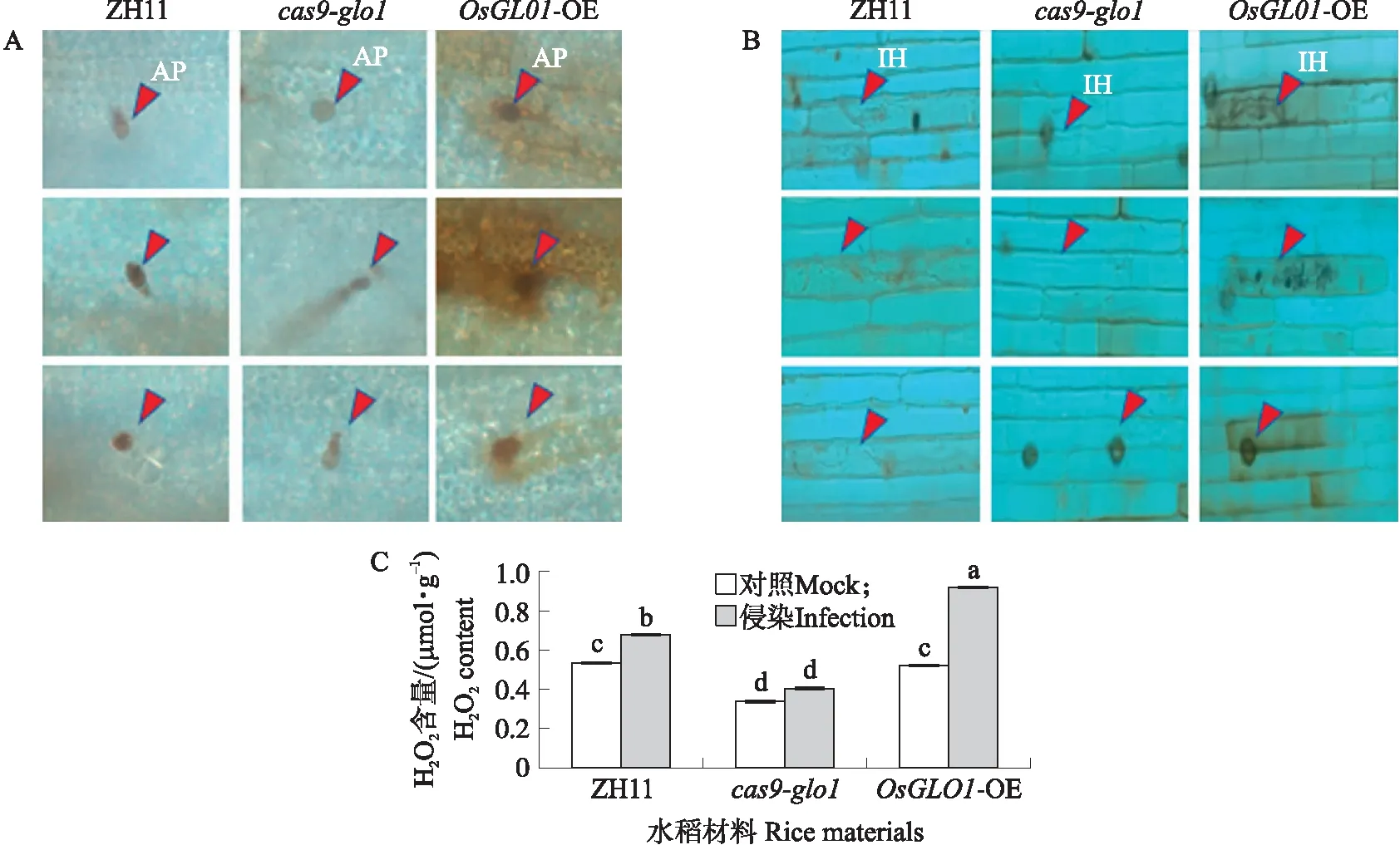
图4 OsGLO1对稻瘟病菌侵染后的水稻H2O2积累的影响Fig.4 Effects of OsGLO1 on the reactive oxygen species accumulation in rice after M.oryzae infected A. 叶片浸泡侵染48 h后DAB染色结果(AP代表稻瘟病菌附着胞);B. 叶鞘注射侵染48 h后DAB染色结果(IH代表侵入型菌丝);C. 水稻叶片中H2O2含量的测定。A. DAB staining after 48 h of leaf immersion and infection(AP stands for appressorium of Magnaporthe oryzae);B. DAB staining after 48 h of leaf sheath infection(IH stands for invasive hyphae);C. Determination of H2O2 content in rice leaves.
2.5 OsGLO1对水稻防卫相关基因表达的影响
从图5可知:相较于ZH11,在OsGLO1-OE水稻株系中,SA信号途径的防卫基因OsPR1a、OsEDS1、OsPAD4和OsICS1的表达量显著增加,尤其是OsPR1a的上调达4倍以上;而在cas9-glo1中,OsPAD4、OsICS1的表达量没有显著变化,OsPR1a和OsEDS1的表达量显著下调,分别约为ZH11的52%和6%。上述结果表明OsGLO1正向调控OsPR1a和OsEDS1的表达。与ZH11相比,OsGLO1-OE、cas9-glo1中JA信号通路的相关防卫基因OsPBZ1表达水平显著降低,OsCOL1b、OsMYC2的表达水平无明显变化(图5-B)。上述结果说明OsGLO1对稻瘟病抗性的调控作用可能与JA信号途径无关,主要是通过激活SA信号通路正调控水稻对稻瘟病的抗性。

图5 SA(A)和JA(B)信号途径防卫相关基因的表达Fig.5 Expression of SA(A)and JA(B)signal pathway defense-related genes
3 讨论
本课题组前期研究结果表明,OsGLO1在水稻原生质体中具有激活早期防卫反应、调控抗病基因表达等功能[19]。OsGLO1可能是亲和型稻瘟病菌的攻击对象,其表达在侵染早期就受到特异性抑制,显示了其在稻瘟病抗性中的重要作用。GLO在番茄、烟草、甜瓜、拟南芥等植物的抗病反应中都发挥作用[15-16,29],但是在水稻抗稻瘟病中作用报道甚少。通过使用OsGLO1过表达和基因沉默转基因材料,本研究考察了OsGLO1的抗病表型和依赖的信号通路,结果表明OsGLO1是水稻抗稻瘟病的正向调控因子。水稻可以通过OsGLO1调控活性氧的积累和SA信号通路防卫基因(如OsPR1a和OsEDS1)的表达水平,增强水稻对稻瘟病菌的抗性,抑制病菌生长和菌丝扩展。
光呼吸是某些植物细胞在高光照和高氧低二氧化碳情况下发生的一个生化过程,是在长期进化过程中为了适应环境变化,提高抗逆性而形成的一条代谢途径[30]。近期的研究表明,水稻光合作用中的光捕获复合体Ⅱ(light-harvesting complex Ⅱ)可以通过磷酸化修饰开启水稻对稻瘟病的抗性[31],建立光合作用与抗病性的联系。本研究结果进一步显示OsGLO1可以诱导PTI(病原相关分子模式诱导的免疫反应)和ETI(效应子诱导的免疫反应)的多个元件,将光呼吸与水稻对稻瘟病的抗性联系起来。这些结果启示,研究水稻基础生理过程或能量代谢对于了解稻瘟病抗性机制具有重要意义,是今后育种和品种改良需要关注的生物过程。
SA信号途径在水稻抵抗稻瘟病的过程中发挥重要作用。水稻的本底水平SA含量高于拟南芥等植物,SA是否在水稻抗病性中起作用存在争议[32]。然而,在SA相关防卫基因的表达量增高[33]、SA产生或代谢相关基因表达增加[34]、介导SA信号传导的转录因子过表达[35]等条件下,都伴随着稻瘟病抗性的增加,表明SA对研究稻瘟病抗性具有重要价值。本研究中OsGLO1过表达植株通过提高SA信号途径中的OsPR1a和OsEDS1等基因的表达水平而增强水稻抗稻瘟病的能力,但与JA信号通路基本无关。OsGLO1促进SA信号通路的机制还有待进一步探究。
致谢:华南农业大学彭新湘课题组提供了水稻材料,四川农业大学王文明课题组提供了稻瘟病菌种(eGFP-tagged Zhong-1),谨致谢意。

