青稞HvnRPS2基因克隆及其在条纹病胁迫下的表达分析
魏 婵,姚晓华,姚有华,安立昆,陈 林,吴昆仑
(青海大学,青海省农林科学院,青海省青稞遗传育种重点实验室,国家麦类改良中心青海青稞分中心,西宁 810016)
青稞(HordeumvulgareL. var.nudumHook. f.)属禾本科小麦族大麦属,为普通大麦的种内变种,是青藏高原上的优势特色农作物[1]。青稞种植产地分布比较广泛,在中国主要分布在西藏、青海,以及四川的甘孜州和阿坝州、云南的迪庆、甘肃的甘南等地,可在青藏高寒高海拔地区正常成熟[2-3]。青稞因独特的医药保健、酿酒、粮食和饲料的作用,人们对青稞的需求急剧上升[4-5]。条纹病是由种子携带麦类核腔菌(Pyrenophoragraminea)引起的系统侵染性种传病害[6-8]。大麦条纹病害在世界上不同大麦种植区普遍发生,中国以长江流域发病较为普遍[9-11]。2012年青海省内青稞条纹病发生面积约5.2万hm2,严重威胁青稞的丰产稳产[12]。目前主要防治方法是播种前药剂拌种[13],但青藏高原生态环境非常脆弱,严控农药化肥,抗病品种选育是最有效、最环保的方式。目前抗条纹病基因筛选的研究相对较少,国外学者利用抗和不抗条纹病的大麦品种杂交后代进行定量性状位点(QTL)分析,定位出2个与抗病相关的基因Rdg1a和Rdg2a,过量表达这2个基因能够显著提高大麦对条纹病菌株的抗性[14-15]。另有学者利用传统分群分析法(bulksegregant analysis,BSA)定位出抗病基因Rdg3[16]。姚晓华等[17]通过转录组测序(RNA-seq)获得一个条纹病胁迫下差异表达的AGO1基因,发现该基因受条纹病胁迫的诱导;杨雪等[18]克隆获得一个青稞抗条纹病基因HvtRGA,发现该基因受条纹病胁迫诱导表达,且抗病品种‘昆仑14号’感病后基因表达量显著高于感病品种‘Z1141’。近年来随着全球气候的变化,青稞种植区降雨量增多,条纹病频发,因此进一步分析、鉴定新的青稞抗条纹病基因非常必要。
目前抗病R蛋白大多数属于NBS-LRR类R蛋白,主要具有NBS(nucleotide-binding site)和LRR(leucine-rich repeat)结构域[19]。NB-ARC属于NBS-LRR类蛋白中的一个大家族,具有高度保守的NB-ARC结构域,可以通过结合ADP或ATP来参与植物抗病蛋白的构象变化,进而激活植物免疫响应与病原菌识别[20]。RPS2是典型的NB-ARC类抗病基因,在拟南芥中研究较多。例如:拟南芥的RPS2具有NBS和LRR结构域,在拟南芥的抗细菌性病害(Pseudomonassyringae)中发挥重要作用[21];HSP90与RAR1和SGT1相互作用,对拟南芥中RPS2介导的抗病性至关重要[22];RPS2基因对携带avrRpt2基因的细菌病原体具有抗性[23]。另外,在东乡野生稻中,利用NBS保守结构域获得的探针及基于RecA文库富集方法筛选并克隆了RPS2基因[24]。在粳稻的全基因组测序结果中也发现有类似RPS2的基因[25]。Zeng等[26]利用全基因组测序的方法获得了青稞HvnRPS2基因的蛋白序列,但尚未见核苷酸序列和其在抗病方面的研究报道。
本研究通过分析不同抗性青稞品种条纹病感染后正常叶片和感病叶片的RNA-seq结果,经过比较鉴定出一个差异表达的HvnRPS2基因。在抗病青稞品种‘昆仑14号’和感病青稞品种‘Z1141’ 中克隆了该基因,并利用生物信息学软件对其序列信息、理化特性及与其他物种的进化关系进行了分析,推测了其可能功能。同时利用实时荧光定量(qRT-PCR)技术分析了在条纹病胁迫下,HvnRPS2基因在不同抗病性青稞品种和不同感病时期的表达模式。研究结果为进一步分析HvnRPS2基因在青稞抗条纹病中的功能及其抗病机理奠定基础。
1 材料和方法
1.1 材 料
青稞抗病品种‘昆仑14号’和感病品种‘Z1141’均由青海大学农林科学院作物栽培与育种研究所青稞研究室繁育保存提供。
1.2 方 法
1.2.1 青稞叶片总RNA的提取及cDNA合成对青稞抗条纹病品种‘昆仑14号’和感病品种‘Z1141’用条纹病原菌种侵染后,利用TaKaRa宝日医生物技术(北京)有限公司的RNA提取试剂盒,分别于感染后10、20、30、40和50 d提取正常叶片和感病叶片总RNA,测定RNA的浓度和纯度,并将RNA浓度稀释成一致,用1.2%琼脂糖凝胶电泳检测RNA质量。并参照TaKaRa宝日医生物技术(北京)有限公司的cDNA合成试剂盒(PrimeScript 1st Strand cDNA Synthesis Kit)反转录成cDNA模板,-20 ℃保存备用。
1.2.2 青稞HvnRPS2基因的克隆用条纹病原菌侵染青稞抗条纹病品种‘昆仑14号’和感病品种‘Z1141’[27],经转录组测序后,选取1个差异表达的RPS2基因(Gene ID: HORVU2Hr1G089020)。利用Primer primer 5.0设计RPS2基因(Gene ID: HORVU2Hr1G089020)的全长引物(表1)。以‘昆仑14号’和‘Z1141’的叶片cDNA为模板进行PCR扩增。扩增体系参照姚晓华等[17]的方法。利用柱式凝胶回收试剂盒(上海生工生物工程技术服务有限公司)回收目的条带,用1.2%琼脂糖凝胶电泳检测回收产物的质量。用超微量核酸蛋白测量仪(Nano Photometer)测定回收产物的浓度和纯度,取3 μL回收产物并将其连接到pEasy-Blunt载体(全式金生物)上,再转化至大肠杆菌Trans-T1感受态细胞,放置37 ℃恒温培养箱12~16 h,利用蓝白斑筛选随机挑取10个单克隆菌落至含Kan+抗性的LB液体培养基培养3~4 h,使用通用引物M13F/R对3个阳性克隆单菌落进行菌液PCR鉴定筛选,送至上海生物工程股份有限公司进行测序。
1.2.3 青稞HvnRPS2基因生物信息学分析利用Protparma(http://www.expasy.org/tools/protparam.html)和Protscale(https://web.expasy.org/protscale/)分析该蛋白的理化性质和亲/疏水性;利用SignalP 4.1(http://www.Detaibio.com/tools/signal-peptide.html)和TMHMM-2.0(http://www.cbs.dtu.dk/services/ TMHMM-2.0/)分析目的蛋白是否存在信号肽和跨膜结构;利用NCBI(https://www.ncbi.nlm.nih.gov/)、SPOMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_sopma.html)和SWISS-MODEL(https://swissmodel.expasy.org/)软件,对HvnRPS2蛋白分别进行结构域分析、二级结构和三级结构预测;利用NCBI中Blastp功能,查询与HvnRPS2蛋白同源的其他9个禾本科物种RPS2蛋白序列,利用DNAMAN6.0软件进行多序列比对和一致性分析[17]。
从大麦参考基因组(ftp://ftp.gramene.org/pub/gramene/release-36/fasta/hordeum_vulgare/dna/)调取与HvnRPS2进化关系较近的6个大麦NB-ARC类基因(Gene ID: HORVU0Hr1G008580、HORVU2Hr1G089020、HORVU5Hr1G113500、HORVU7Hr1G055680、HORVU2Hr1G064140和HORVU3Hr1G077670),从水稻参考基因组(http://rice.plantbiology.msu.edu/pub/data/Eukaryotic_Projects/o_sativa/annotation_dbs/pseudomolecules/version_7.0/all.dir/all.con)调取6个水稻NB-ARC类基因(Gene ID: LOC_Os09g10054、LOC_Os09g14060、LOC_Os09g14100、LOC_Os04g1401039460、LOC_Os01g57870和LOC_Os03g14900),从拟南芥参考基因组(ftp://ftp.ensemblgenomes.org/pub/plants/release-43/fasta/arabidopsis_thaliana/dna/Arabidopsis_thaliana.TAIR10.dna.toplevel.fa.gz)调取3个拟南芥NB-ARC类基因(Gene ID: AT1G15890、AT3G15700和AT4G27220)和从玉米参考基因组(ftp://ftp.ensemblgenomes.org/pub/plants/release-43/fasta/zea_mays/dna/Zea_mays.B73_RefGen_v4.dna.toplevel.fa.gz)调取2个玉米NB-ARC类基因(Gene ID: Zm00001d003048和Zm00001d043233),根据它们编码的氨基酸序列,利用Mega 7.0软件及ITOL(https://itol.embl.de)构建系统进化树。
1.2.4HvnRPS2在青稞条纹病胁迫下的表达量分析采用Primer 5.0设计扩增获得的HvnRPS2基因的qRT-PCR引物,以条纹病侵染10、20、30、40和50 d的‘昆仑14号’和‘Z1141’正常叶片和感病叶片的cDNA(200 ng·μL-1)为模板,以18SrRNA为内参进行qRT-PCR,引物序列见表1。反应体系为20 μL,其中TB Green premix Ex Taq II(Tli RNaseH Plus)(2X)10 μL,cDNA模板2 μL,PCR上/下游引物(10μmol·L-1)各0.8 μL和ddH2O 6.4 μL。qRT-PCR扩增程序为:95 ℃预变性5 min;95 ℃变性 5 s,60 ℃退火30 s,72 ℃延伸30 s,循环40次;溶解曲线,95 ℃ 5 s,70 ℃ 1 min,实验结果应用2-ΔΔCt法计算基因相对表达量[28]。每个样品设3个生物学重复和3个技术重复,利用SPSS22.0进行显著性检测。

表1 引物信息
2 结果与分析
2.1 青稞HvnRPS2基因的克隆与序列分析
以青稞抗病品种‘昆仑14号’和感病品种‘Z1141’的叶片cDNA为模板,以HvnRPS2-F/R为引物,经PCR扩增获得一条约3 000 bp的目的条带(图1)。测序结果表明,其完整开放阅读框为2 760 bp,编码919个氨基酸。序列比对结果显示,来自‘昆仑14号’和‘Z1141’的碱基序列和编码的氨基酸序列均100%一致。利用NCBI在线工具对其序列进行保守结构域预测,发现该基因具有典型的NB-ARC和LRR结构域。

M. DL5000;1. 昆仑14号;2. Z1141;M. DL5000; 1. Kunlun 14; 2. Z1141图1 HvnRPS2基因的PCR扩增Fig.1 PCR amplification of HvnRPS2
蛋白质理化性质分析表明,HvnRPS2蛋白分子式为C4628H7417N125901378S47,分子量为104.2 kD,不稳定指数为45.85,脂溶指数是101.64,理论等电点为5.95,是个亲水性的不稳定酸性蛋白,不存在跨膜结构,且无信号肽。该蛋白的二级结构主要由无规卷曲(58.11%)和α-螺旋(29.92%)组成,其中无规卷曲占,α-螺旋,这两个二级结构在蛋白行使功能时可能发挥重要作用(图2)。三维结构预测,由图3可知,HvnRPS2蛋白的功能结构域折叠成祥龙状,N端包含了NB-ARC特征结构域;C端主要包含LRR特征结构域。Unipro(https://www.uniprot.org/)基因注释结果表明该蛋白为RPS2,因此将该基因命名为HvnRPS2。
蓝色. α-螺旋;红色. 延伸链;绿色. β转角;橙色. 无规则卷曲图2 HvnRPS2蛋白二级结构预测Blue. α-helix; Red. Extended chain; Green. β-turn; Orange. Random coilFig.2 Secondary structure prediction of HvnRPS2

图3 HvnRPS2蛋白三级结构预测Fig.3 Teritary structure prediction of HvnRPS2
2.2 HvnRPS2蛋白的同源比较及系统进化分析
采用DNAMAN 6.0进行氨基酸序列比对,结果发现,青稞HvnRPS2蛋白与大麦、山羊草、二穗短柄草等10个禾本科植物的蛋白序列相似性为75.58%,其中与大麦、二穗短柄草、小麦、山羊草的RPS2氨基酸序列相似性较高,分别为99.89%、94.57%、94.56%和94.36%,且这些序列都具有高度保守的NB-ARC、ATPase-2、LRR和LRR-8结构域(图4),其中NB-ARC、LRR和LRR-8结构域在上述禾本科植物种的相似性分别为85.16%,92.73%和91.97%。可见,10个RPS2蛋白虽然相似性不太高,但3个结构域相似性均大于85%,推测这3个保守的结构域在HvnRPS2蛋白的功能发挥中起重要作用。
从大麦、拟南芥、水稻(日本晴)和玉米的参考基因组中调取与青稞HvnRPS2基因进化关系相近的17个NB-ARC家族基因,利用它们编码的氨基酸序列构建系统进化树。由图5可知,18个NB-ARC基因家族成员根据R基因编码的蛋白被划分为5类,其中HvnRPS2与大麦和水稻的NB-ARC类蛋白在同一分支,推测它们具有类似的功能。

HORVU. 大麦;AT. 拟南芥;Zm. 玉米;LOC. 日本晴;粉色区域代表亲缘关系最近图5 HvnRPS2蛋白与其他NB-ARC类基因系统进化分析HORVU. Hordeum vulgare; AT. Arabidopsis thaliana; Zm. Zea mays; LOC. Oryza sativa subsp. japonica. cv. nipponbare; The pink area represents the closest kinshipFig.5 Phylogenetic tree analysis of the HvnRPS2 and NB-ARC in other plants
2.3 HvnRPS2在条纹病胁迫下的表达
以正常叶片为对照,以18SrRNA为内参基因,对HvnRPS2基因的表达模式进行qRT-PCR分析。由图6可知,条纹病病原菌侵染10~20 d,HvnRPS2基因表达量显著下降,其中‘昆仑14号’正常叶片下降47.79%,感病叶片下降89.52%;‘Z1141’正常叶片下降38.67%,感病叶片下降78.51%;‘昆仑14号’下降值显著高于‘Z1141’。侵染20~40 d,HvnRPS2基因表达量显著上调,并在40 d达到最高值,其中‘昆仑14号’正常叶片升高1.52倍,感病叶片升高2.69倍;‘Z1141’正常叶片升高1.63倍,感病叶片升高2.81倍;且‘Z1141’升高值高于‘昆仑14号’。侵染40~50 d,HvnRPS2基因表达量显著下降,其中‘昆仑14号’正常叶片下降31.77%,感病叶片下降95.53%;‘Z1141’正常叶片下降28.6%,感病叶片下降86.15%;且‘昆仑14号’下降值显著高于‘Z1141’。为进一步分析不同抗性品种的HvnRPS2基因在条纹病侵染下的响应模式,对表达量进行多项式曲线拟合。结果表明,随着条纹病胁迫时间的延长,HvnRPS2基因在不同抗性品种中的表达量均呈现先下降后上升而后下降的变化趋势,与正常叶片相比,感病叶片的HvnRPS2基因表达量极显著下调,且抗病品种的表达量下调值显著高于感病品种(P<0.01)。推测HvnRPS2在青稞抗条纹病过程中发挥重要的负调控作用。
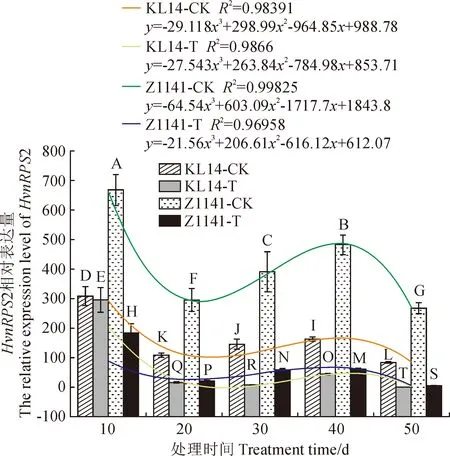
KL14-CK.‘昆仑14号’正常叶片;KL14-T.‘昆仑14号’感病叶片;Z1141-CK. ‘Z1141’正常叶片;Z1141-T. ‘Z1141’感病叶片;不同大写字母表示差异极显著(P<0.01)图6 不同抗性品种HvnRPS2基因在条纹病胁迫下的表达模式KL14-CK. The normal leaves of ‘Kunlun 14’; KL14-T. The susceptible leaves of ‘Kunlun 14’; Z1141-CK. The normal leaves of ‘Z1141’; Z1141-T. The susceptible leaves of ‘Z1141’; Different capital letters indicate differences at 0.01 levelFig.6 Expression pattern of HvnRPS2 gene in different resistant Tibetan hulless barley varieties infection with leaf stripe disease
3 讨 论
本实验克隆的HvRPS2基因的氨基酸序列与Zeng等[26]公布的西藏青稞基因组中HvnRPS2氨基酸序列相似性高达100%,但并未公布其核苷酸序列;在NCBI中,与大麦HvRPS2氨基酸序列相似性高达99.89%,验证了本实验克隆的基因即为青稞HvnRPS2。研究表明,RPS蛋白包含高度保守的结构域,如NBS、LRR、LRR-8和P-loop,这些结构域通过结合ADP或ATP来调节植物抗病蛋白的构象变化,从而调节下游抗病信号的传导[29]。本研究结果显示,HvnRPS2蛋白具有典型的NBS保守结构域和LRR结构域。LRR可以通过参与蛋白质之间的互作并结合病原体衍生出来的分子来识别病原菌[30],LRR区域的突变能够改变植物的抗性[31]。陶易等[32]对拟南芥RPS2基因NBS和LRR部位的突变进行了分析,发现LRR结构域参与信号感知,蛋白质的N末端部分,包括N末端疏水结构域、NBS和其他保守结构域,在信号转导中起作用。推测HvnRPS2的NBS和LRR结构域在青稞抗条纹病过程发挥重要的功能。
与不同物种NB-ARC类基因的进化分析表明,青稞HvnRPS2基因与水稻LOC_Os09g14060基因和大麦HORVU2Hr1G089020基因聚为一支。前人在水稻抗稻曲病遗传机制的研究中,利用抗性品种RYT2668和高感品种PR116杂交获得的重组自交系进行QTL定位,分别在水稻2、4、5、7、9染色体上定位了7个QTL,位于9号染色体的主效QTL qRFSr9.1包含116个ORF,其中聚为一类的3个抗病基因 (Gene ID: LOC_Os09g14010、LOC_Os09g14060和LOC_Os09g14100),被注释为RPS2型抗病蛋白[33]。大麦HORVU2Hr1G089020在Phytozome上被注释为编码抗病蛋白RPS2,包含NBS保守结构域和LRR结构域,但目前未见相关功能的报道。因此推测HvnRPS2基因可能在青稞抗条纹病中发挥作用,但其作用机制有待进一步研究。
研究表明,拟南芥的RPS2基因在水稻中过表达后,对真菌病原体稻瘟病菌和细菌病原体水稻白叶枯病菌产生正响应[34]。而本研究中,条纹病胁迫下HvnRPS2基因则被抑制表达,且在抗病品种中的下调值显著高于感病品种,这种不同可能跟病原菌侵染时间、病原菌类型及上下游调控的基因有关。一些抗病相关基因在病原菌入侵时会被抑制表达,起到负调控的作用,如SGT1和SRFR1通过免疫共沉淀相互作用,共同负调节R蛋白的积累,以防止免疫反应的自动激活[35];RPS2表达活性受NBS-LRR结构域及基序调控,从而直接或间接调控植物的抗病性,N末端的突变导致蛋白质对拟南芥RPS2产生负面影响,拟南芥RPS2与AvrRpt2介导RIN4之间存在负反馈调节,RPS2的防御通路在激活过程中通过消除RIN4而感知抗病启动信号产生抗病性[36-37]。HvnRPS2基因对条纹病的这种负响应模式可能是调控了下游的R基因,从而直接或间接调控青稞的抗病性,但其机制有待进一步研究。另有研究表明,植物遭受逆境时,体内某些抗逆生理指标和基因往往会出现先降低后升高再降低应激反应[38-40]。某些抗逆基因在抵抗非生物逆境胁迫时具有功能冗余性,在对小麦抗逆基因TaSnRK2.9的抗逆功能研究中发现,在ABA诱导后的6 h,该基因的表达量呈现先降低后升高再降低的趋势水平,推测TaSnRK2.9参与了ABA介导的信号调控,因其负反馈调控导致TaSnRK2.9基因表达的短暂下降,最终则达到一个平衡状态[41-42]。当尖孢镰孢菌侵染油桐幼苗根系时,油桐3个NPR1类基因的表达都被显著抑制,其中VfNRP3在侵染后被完全抑制表达,VfNPR1和VfNRP5在侵染中后期稍有恢复,但都未能达到野生型的表达。本研究发现在条纹病胁迫下,HvnRPS2基因表达模式与抗性基因VfNPR1和VfNRP5的表达模式相似[43]。可见HvnRPS2基因是一个条纹病的负调控基因,今后我们可以利用基因敲除、基因编辑等方法将该基因从基因组中敲除,从而提高青稞的抗病性。本结果为研究HvnRPS2基因在青稞抗条纹病中的作用和调控机理奠定基础。
本研究从‘昆仑14号’和‘Z1141’青稞品种克隆的HvnRPS2,具有高度保守的NB-ARC和LRR结构域,属于青稞NBS-LRR类进化分支中的NB-ARC家族成员。其在青稞条纹病侵染后的表达模式表明,与正常叶片相比,感病叶片的HvnRPS2基因表达量极显著下调,且抗病品种基因表达量下调值显著高于感病品种,推测HvnRPS2在青稞抗条纹病调控过程中发挥重要的负调控作用。

