中空Gd2O3微球的制备与表征及其在小鼠模型成像中的应用
赵敏智,林志艳,张 加,许卫兵,蒲陆梅*
(1.甘肃农业大学 理学院,甘肃 兰州 730070;2.甘肃中医药大学 临床医学学院,甘肃 兰州 730070)
目前临床诊断中使用最多的成像技术分别是X射线计算机断层成像(CT成像)、正电子发射型计算机断层成像(PET成像)、荧光成像(FI成像)和磁共振成像(MRI成像)[1-4],其中MRI利用人体不同组织间弛豫时间的差异进行成像,具有空间分辨率高、不受组织穿透能力的限制和对人体无害等优点而越来越受到关注[5].然而,为了增加不同组织图像的对比度,提高诊断结果的准确性,在测试MRI之前需注射造影剂.MRI造影剂可分为T1和T2型两种,T1型造影剂通过降低组织周围水分子中质子的纵向弛豫时间,从而增强磁共振成像信号,因其对MRI图像有增加亮度的作用,又被称为阳性造影剂.T2型造影剂通过降低组织周围水分子中质子的横向弛豫时间,从而减弱磁共振成像信号,因其对MRI图像有增加暗度的作用,又被称为阴性造影剂,所以临床中基本不使用[6].临床中获准应用的主要是使信号增强的T1造影剂,其中钆(Gd)离子由于核外具有7个未成对电子,表现出最强的顺磁性,能够最大程度的增强MRI信号强度而被广泛用作T1型造影剂[7].
Huang等[8]以Gd(NO3)3·6H2O和Eu(NO3)3·6H2O为起始原料,采用一锅水热法合成了Gd(OH)3∶Eu-NRs, 其纵向弛豫率r1为4.78 L·mmol-1·s-1.Park等[9]利用Gd(NO3)3·6H2O和不同溶剂合成了具有棒状、颗粒状和片状的Gd(OH)3纳米晶体,然而其纵向弛豫率r1为2.58~7.17 L·mmol-1·s-1.Huang等[10]合成了一种具有FI的高灵敏度和MRI的高空间分辨率优点的双模式成像材料Gd-CQDs@N-Fe3O4,r1为5.16 L·mmol-1·s-1,r2为115.6 L·mmol-1·s-1,r2/r1=22.4.Ren等[11]制备了显示绿色荧光的钆螯合功能化碳量子点[Gd(Ⅲ)/CQDs],具有很好的磁共振性能,r1为6.4 L·mmol-1·s-1.虽然已有大量基于Gd(Ⅲ)的T1型造影剂被成功制备,然而,目前钆基造影剂仍然面临纵向弛豫率低的问题.因此设计制备弛豫性能较高的Gd基造影剂具有重要意义.
近年来中空结构的材料由于具有较大的内部空间、较高的比表面积以及小的密度等优点,因而在化学工程、制药和生物应用等各个领域都有很大的应用前景.基于以上分析,文中首先以葡萄糖为原料,用水热法制备碳微球模板,再以尿素作为沉淀剂制备了前驱体,最后利用高温煅烧除去碳微球模板,成功制备了具有中空结构的Gd2O3微球.对中空Gd2O3微球的形貌、结构、表面修饰基团、细胞毒性和造影剂性能进行了详细的表征.研究了所制备中空微球造影剂的体外毒性和驰豫性能,并将其应用于活体小鼠模型的造影.
1 实验部分
1.1 材料
六水硝酸钆(Gd(NO3)3·6H2O,99%)购于上海源叶生物科技有限公司;葡萄糖(C6H12O6)和甲醛(CH2O)溶液购于烟台市双双化工有限公司;尿素购于天津市津东天正精细化工试剂厂;无水乙醇购于成都市科隆化学品有限公司;RPMI 1640培养基、3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)、胎牛血清(FBS)均购于北京索莱宝科技有限公司;二甲基亚砜(DMSO)购于天津恒兴化学试剂制造有限公司;昆明小鼠购于兰州大学医学院;去离子水实验室自制.
1.2 碳微球的制备
准确称取2.00 g葡萄糖和量取2.00 mL甲醛溶液溶解于25.00 mL去离子水中,待形成澄清透明溶液后,将其转移至聚四氟乙烯内衬中并密封于不锈钢反应釜中,于160 ℃烘箱中加热6 h.待反应釜自然冷却至室温后,将反应釜中的溶液倒出并离心,弃去上清液,得黑褐色沉淀物,用乙醇和去离子水洗涤3次,置于80 ℃烘箱中烘干6 h,得到碳微球.
1.3 中空Gd2O3微球的制备
准确称取0.902 g Gd(NO3)3溶于60.00 mL去离子水中,剧烈搅拌下加入6.00 g尿素,待形成澄清透明的溶液后,加入0.200 g上述制备的碳微球,并超声15 min.随后将溶液转入圆底烧瓶中,剧烈搅拌下于85 ℃持续反应6.0 h,待溶液冷却至室温后离心收集沉淀物,称为前驱体.将干燥后的前驱体置于马弗炉中于800 ℃下煅烧2.0 h获得中空Gd2O3微球.
1.4 测试与表征
利用iS50 FT-IR(Nicolet公司)对样品进行傅里叶红外光谱表征.用Netzsch STA 409 PC Analyzer热重分析仪以10 ℃·min-1的升温速度,从25 ℃到900 ℃对样品进行热重分析.中空Gd2O3微球的粒度和Zeta电位由Zeta粒度分析仪(SALD,2300,SHIMADZU)在室温下测得.使用VG MultiLab 2000对样品进行XPS分析.中空Gd2O3微球的XRD数据由XRD-6100(日本岛津)测量.TEM形貌由JEM-2100(日本株式会社)在200 kV下采集.利用JSM-6701F(日本株式会社)扫描电子显微镜观察样品的形貌,表征前需要对样品进行离子溅射喷金2 min.采用电感耦合等离子体(ICPPLASMA 1000)法测定溶液中Gd3+的准确浓度.样品的T1和T2加权图像是在0.5 T核磁共振分析仪(MesoMR23-060H-Ⅰ, 苏州Niumag分析仪器有限公司)上采集.
1.5 细胞毒性试验
使用MTT法评估中空微球的细胞毒性.人肝癌细胞HepG2用包含10%胎牛血清(FBS)、青霉素(100 U·mL-1)和链霉素(0.1mg·mL-1)的RPMI 1640培养基在5% CO2、37 ℃的培养箱中培养24 h后,将HepG2(5×103/孔)细胞接入96孔板中,培养过夜使细胞贴壁生长,然后加入不同Gd(Ⅲ)浓度的(20,40,80,160,320 μg L-1)溶液,继续培养48 h后,每孔加入20 μL MTT(5 mg·mL-1)在培养箱中孵化4 h,弃去每孔中的培养基并加入150 μL DMSO,振荡10 min,在490 nm的酶标仪下记录其吸光度(OD),用下式计算细胞存活率.
1.6 体外活性测试
准确称取200 mg中空Gd2O3微球分散在10 mL环己烷中,加入100 μL吐温-20,超声1 h后获得白色乳状液,在白色乳状液中加入10 mL蒸馏水并置于75℃水浴锅中加热搅拌2 h,便得中空Gd2O3微球溶液[12].
1.7 活体试验
取8周龄的昆明小鼠6只,随机分为实验组和对照组,每组3只,分别注射60 μL 8%水合氯醛诱导麻醉,对小鼠进行注射前扫描成像,随后将100 μL中空Gd2O3微球溶液通过尾静脉注射入小鼠体内,分别于注射后不同时间点对小鼠进行成像.扫描成像均采用T1加权成像TR=500 ms,TE=20 ms,切片厚度为1.7 mm,25 ℃.
2 结果与讨论
2.1 制备与表征
如图1所示,中空Gd2O3微球的形成过程分为3步:① 以葡萄糖为原料,在高温高压条件下将其脱水碳化形成碳微球模板;② 以尿素为沉淀剂,将Gd3+在溶液中转化为Gd(OH)CO3,而后沉积在碳微球模板的表面,形成具有核壳结构的前驱体;③ 空气气氛中经过800℃煅烧,前驱体中的碳微球核模板被碳化燃烧去除,无定形的Gd(OH)CO3外壳受热被分解生成Gd2O3,进而获得中空Gd2O3微球.
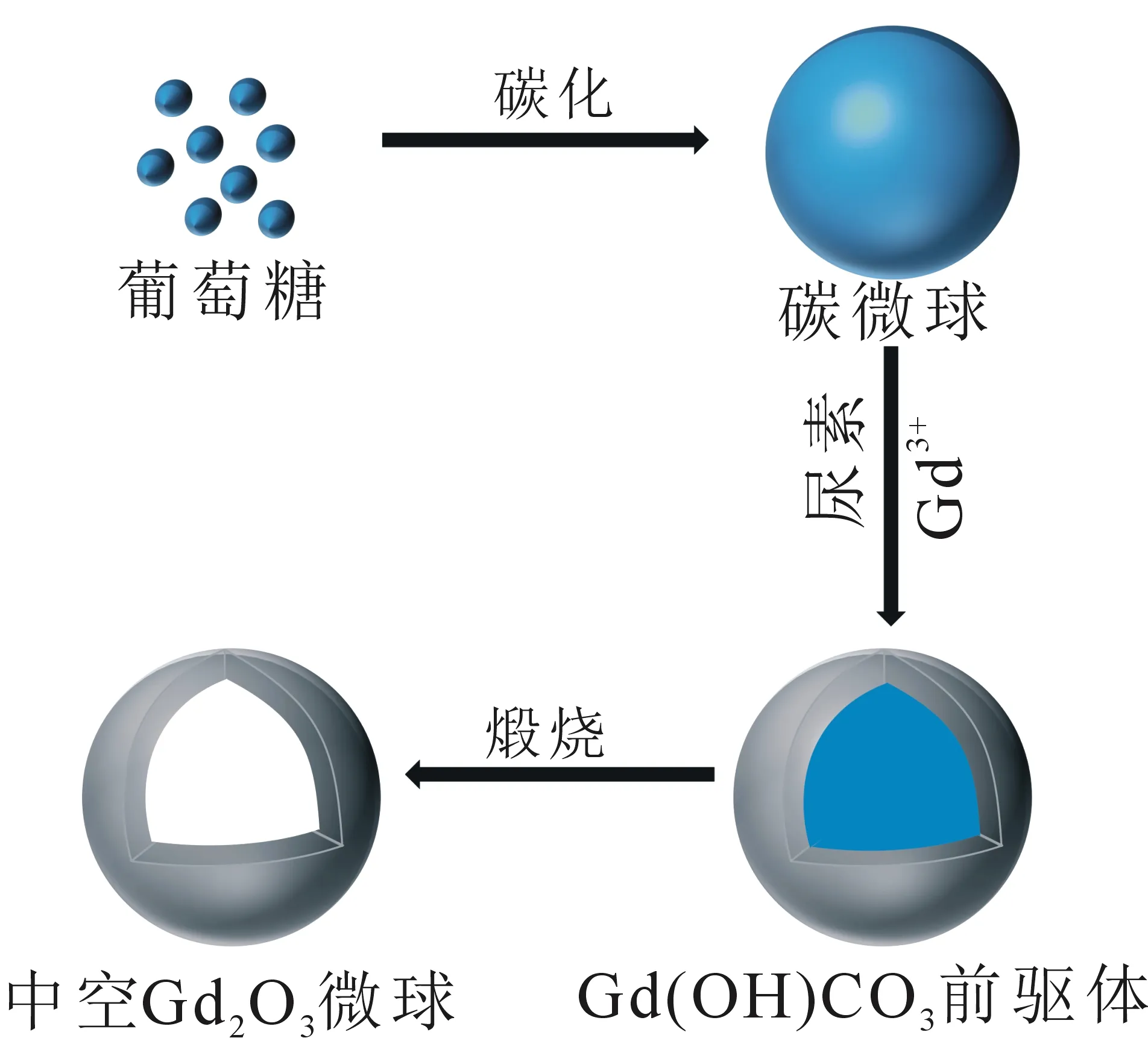
图1 中空Gd2O3微球的形成示意图
首先对碳微球、前驱体、中空Gd2O3微球进行红外光谱分析.如图2所示,从碳微球的曲线可以看出,在3 412 cm-1处的吸收峰归属于羟基(—OH)的伸缩振动,1 706 cm-1处对应羰基(C=O)的振动,以上2种极性基团有利于提高碳微球在水中的分散性.1 612 cm-1处的吸收峰为双键(C=C)的不对称伸缩振动,表明在碳微球形成过程中发生了碳化反应[13-14].1 202和1 021 cm-1处分别对应C—OH和糖苷键(—C—O—C—)的伸缩振动,证明反应过程中发生了葡萄糖缩聚.前驱体的红外图谱中归属于C=O的振动峰略有减弱,这可能是由于碳微球模板被Gd(OH)CO3包裹所导致.而位于1 550和1 450 cm-1处的吸收峰相较于碳微球模板有所增强,这是由于前驱体上残留的沉淀剂尿素引起.中空Gd2O3微球中几乎无碳微球和前驱体中的官能团,这是由于经过高温煅烧后,碳微球模板已经完全被除去,而Gd(OH)CO3也全部转化为Gd2O3所引起.在534 cm-1处出现了新的峰,可以将其归属于Gd—O键的伸缩振动[15-16].基于以上分析,说明经过煅烧后前驱体已经成功转化为中空Gd2O3微球.
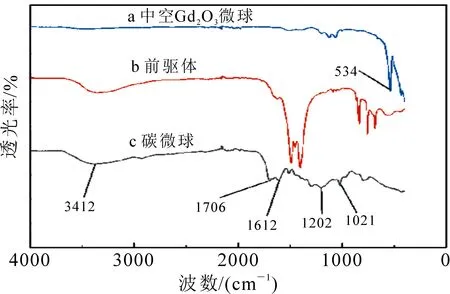
图2 碳球、前驱体和中空Gd2O3微球的FT-IR光谱

图3 碳球、前驱体和中空Gd2O3微球的热重曲线
图3为碳微球、前驱体和中空Gd2O3微球的热重分析曲线.可以看出当温度升高到500℃时,碳微球的质量损失接近100%,说明碳微球模板在800 ℃煅烧后可以完全去除.对于前驱体,25~150 ℃失重约为5.8%,这是由于吸附在材料表面的水分挥发所导致;200~500 ℃的质量损失则归属于前驱体中碳微球的燃烧所造成,质量损失为32.6%;500~700 ℃的缓慢失重可归因于前驱体中Gd(OH)CO3转化为Gd2O3,失重约为8.3%.观察中空Gd2O3微球的曲线可以看到,中空Gd2O3微球几乎没有失重,说明煅烧后形成了纯的中空Gd2O3微球.
图4为碳微球、前驱体及中空Gd2O3微球的粒径分布图.可以看出所制备的碳微球、前驱体和中空Gd2O3的平均粒径分别约为450,600和550 nm,分布系数分别为0.456,0.154和0.434,表明该中空微球形成了单分散分布.前驱体粒径增大可能是因为Gd(OH)CO3附着在碳微球表面,而中空Gd2O3微球粒径略微减小可能是由于煅烧过程中碳微球模板被完全除去,Gd(OH)CO3在转变为Gd2O3的过程中有所收缩导致.碳模板、前驱体和中空Gd2O3的电位如图5所示,3种材料的电位值分别为-23.73,-24.75和-16.82 mV,较大的负电位有利于材料发挥生物活性.
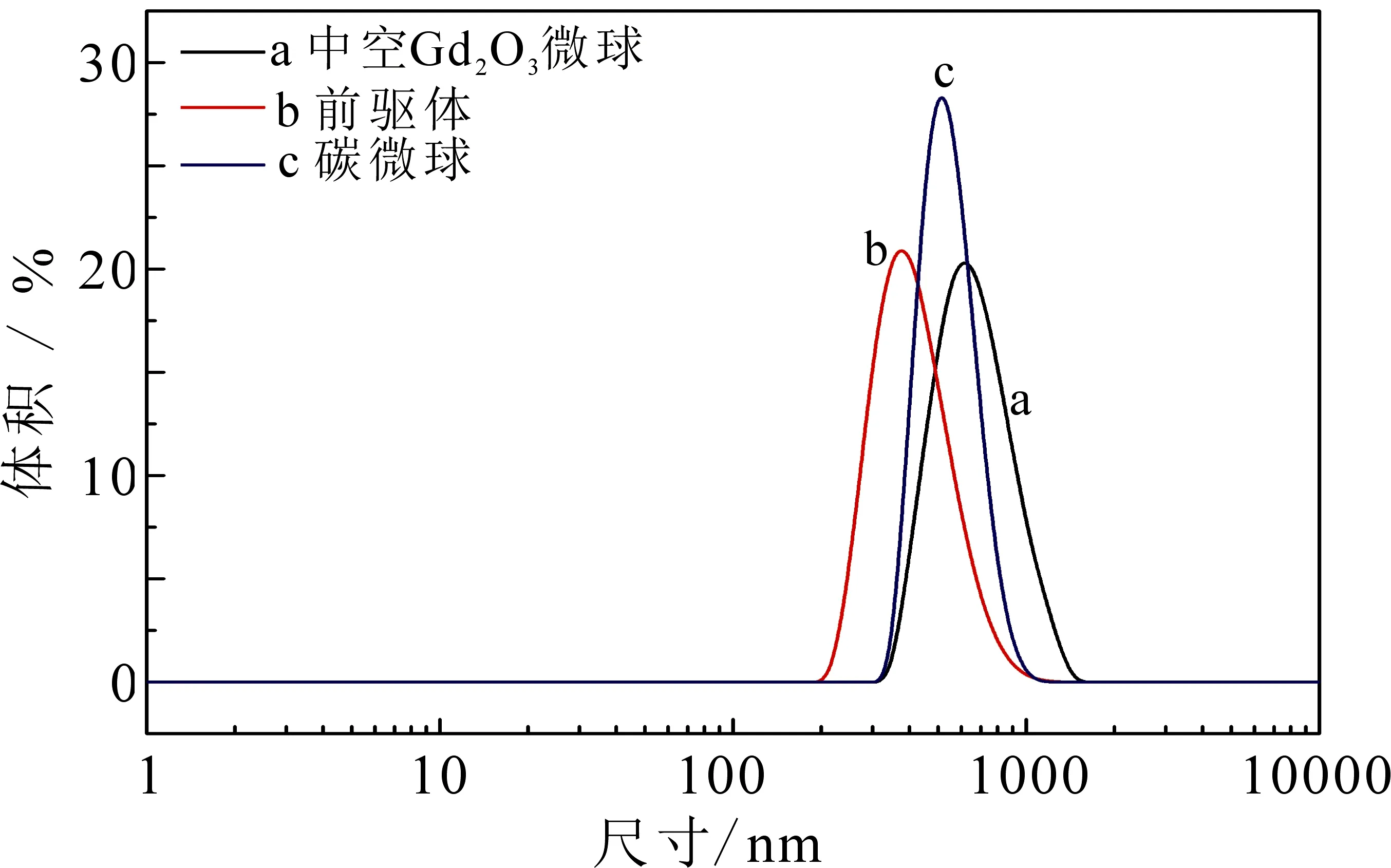
图4 碳球、前驱体和中空Gd2O3微球的粒径
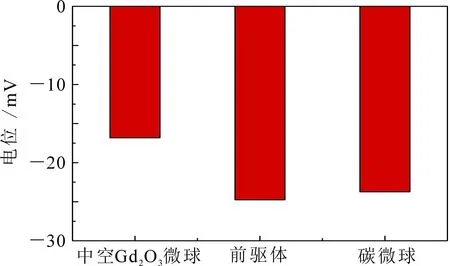
图5 碳球、前驱体和中空Gd2O3微球的电位
图6为碳微球模板、前驱体和中空Gd2O3微球的XRD图谱.碳微球在2θ为22.0°出现宽峰,对应于石墨的(002)晶面,表明经过水热反应后,葡萄糖已被完全碳化.而前驱体分别在2θ=16.36°,20.94°,24.57°,27.33°和34.36°处有明显的衍射峰,很好地与Gd(OH)CO3标准卡片(JCPDS No.43-0604)对应,可以推测无定形产物为Gd(OH)CO3.经过800 ℃煅烧后产物中空Gd2O3微球在2θ=20.0°,28.5°,47.5°和56.3°有强衍射峰,分别对应(211),(222),(400)和(622)晶面衍射峰,这与Gd2O3标准卡(JCPDS No.43-1014)对应,并且没有形成其他的杂峰,说明制备的中空Gd2O3微球是纯立方相的Gd2O3.
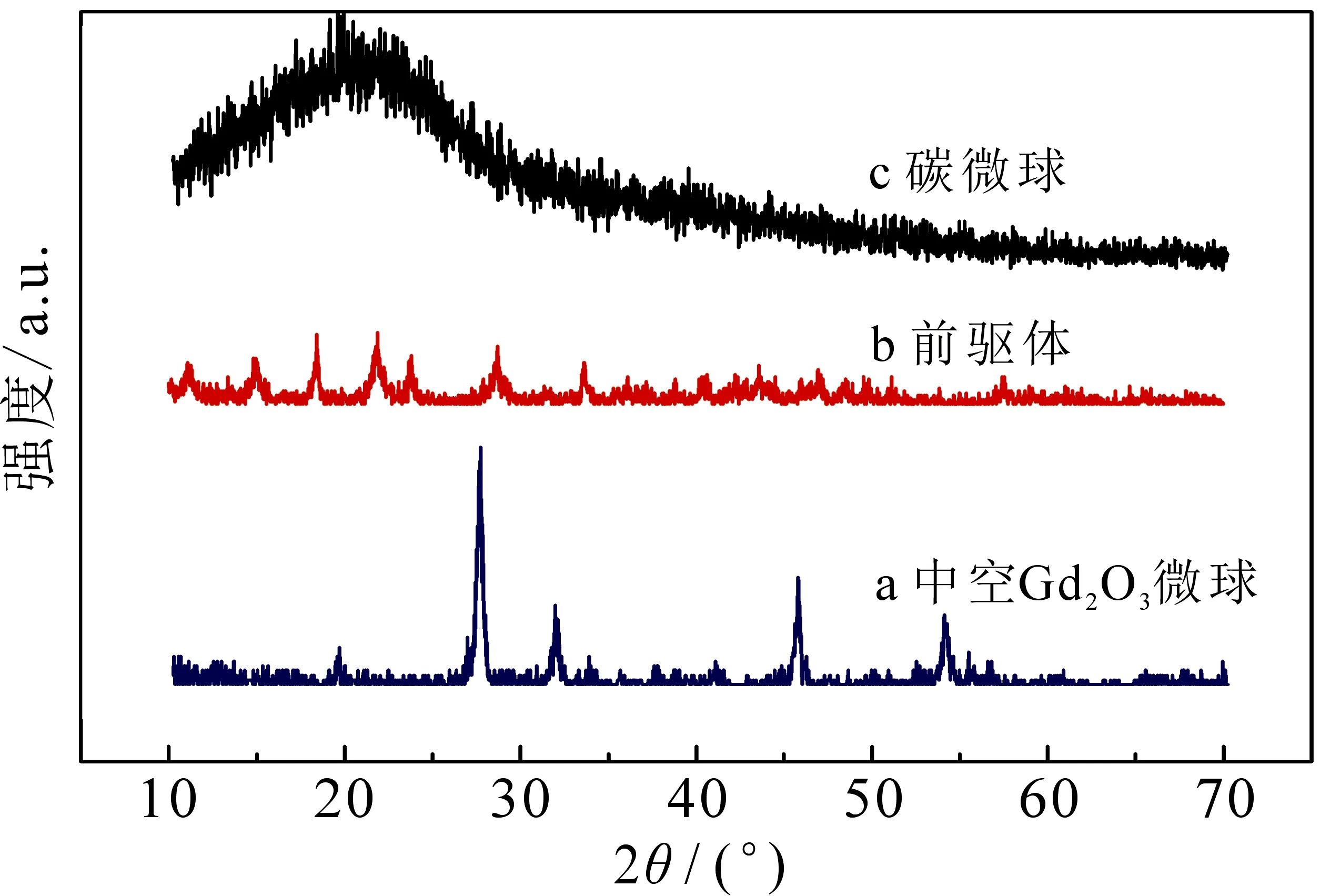
图6 碳球、前驱体和Gd2O3中空微球的XRD图谱
用XPS对中空Gd2O3微球的表面化学组成进行了测定.XPS全谱如图7a所示,结合能为141,1 187和531 eV的峰分别对应于Gd 4d,Gd 3d和O 1s,可以看出样品中只存在O和Gd两种元素,进一步证明经过高温煅烧后,前驱体已经发生完全转变[17-18].图7b为O元素的精细图谱,其中Gd2O3中的O结合能位于530 eV,而位于527 eV处的O元素则来源于结合在材料表面的水分子[19].Gd元素的精细谱如图7c所示,其中Gd 3d5/2和Gd 3d3/2的结合能分别为1 187和1 218 eV.定量分析表明, 中空Gd2O3微球表面O和Gd两种元素的原子百分比含量分别为39.90%和2.76%.值得注意的是其中发现了原子百分比为31.19%的碳元素,这可能来源于残留的碳和空气中的CO2.

图7 中空Gd2O3微球的XPS谱
通过扫描电镜(SEM)和透射电镜(TEM)分析了中空Gd2O3微球的形态和微观结构.SEM形貌如图8(a)所示,可以看出所制备的中空Gd2O3微球表面光滑,部分粒子呈现出较为规则的球形结构,还有部分结构为椭球形,大量的粒子由于高的表面结合能而出现团聚现象,这可能与样品的高温煅烧有关,其尺寸约为500 nm.图8(b)为TEM形貌,可以看出浅色边缘与深色中心形成鲜明对比,显示出良好的中空结构,壳厚约为20 nm,且粒径分布较为均一,有良好的球形结构.
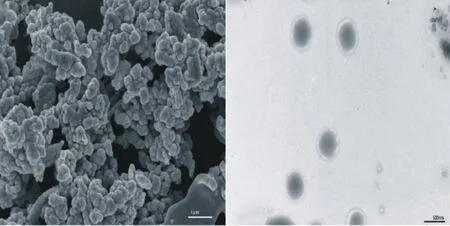
(a)扫描电镜 (b)透射电镜
2.2 MTT及体外MRI
较低的毒性是生物医用材料的首要要求.不同浓度的中空Gd2O3微球对HePG2细胞存活率的影响见图9.可以看出,在低浓度时HepG2细胞的活性基本与对照组相同,达到了93.7%,即使在浓度为320 μg·L-1时,细胞存活率仍然高于90%,表明所制备的中空微球对HepG2细胞无明显的毒副作用,表现出较好的生物相溶性.
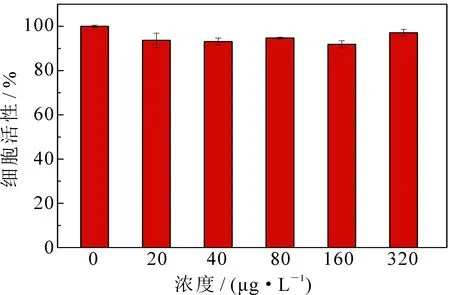
图9 HepG2细胞与不同浓度的中空Gd2O3微球(0,20,40,80,160,320 μg·L-1)孵化48 h后的存活率
为进一步研究所制备中空微球的体外MRI性能,配置了一系列包含Gd3+浓度不同的中空Gd2O3微球溶液,Gd3+的浓度利用ICP-MS结合标准曲线法进行准确测试.以5%的硝酸溶液作为溶剂,首先配置了浓度为25,50,100,250和500 μg·L-1的Gd3+标准溶液,于ICP-MS上测试上述标准溶液的信号强度,并绘制标准曲线(图10),可以看出,所绘制的标准曲线R2值为0.996 8,表现出较好的线性相关性.将所配置5个不同浓度的Gd2O3溶液同样进行ICP-MS测试,将其溶液的信号强度代入标准曲线,准确获得所配置溶液中钆离子的浓度如图10所示,浓度在0.015 6~0.254 9 mmol·L-1,显示出较好的梯度性.
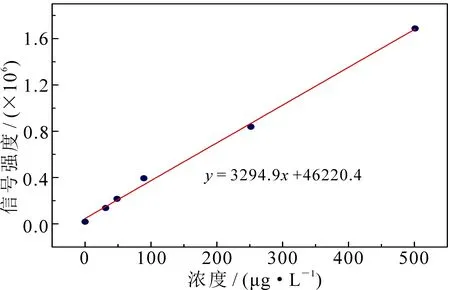
图10 ICP-MS测得Gd3+标准曲线及用标准曲线测得样品中Gd3+的浓度
在获得准确浓度的基础上,研究了所制备的中空Gd2O3微球溶液的体外核磁共振造影性能.图11为5个不同Gd离子浓度的中空Gd2O3微球溶液的T1,T2加权图像,以纯水作为对照,可以看出随着钆离子浓度的增大,T1,T2加权图像都逐渐变亮,但是T1图像的增加程度要高于T2的,进一步说明该中空微球可作为较好的T1造影剂.
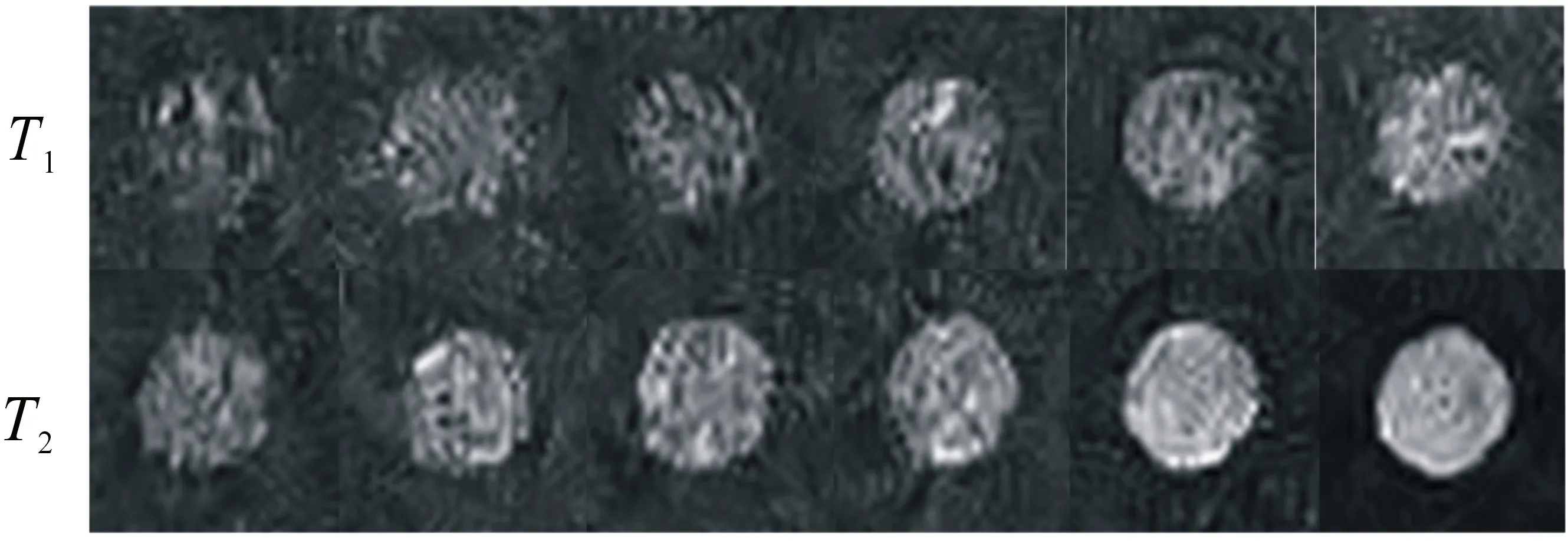
图11 T1,T2体外加权图像(从左至右Gd3+浓度依次为0,0.015 6,0.031 3,0.062 5,0.125 0, 0.250 0 mmol·L-1)
随后分别测试了所配置溶液的纵向(T1)和横向(T2)弛豫时间,分别以1/T1和1/T2对Gd3+浓度作图,进行线性拟合,则拟合曲线斜率即对应为纵向(r1)和横向(r2)弛豫率,结果如图12所示,所制备中空Gd2O3微球的纵向(r1)和横向(r2)弛豫率分别为10.46和13.82 L·mmol-1·s-1,其中r1值是目前临床用造影剂(4.0 L·mmol-1·s-1)的2.5倍,同时r2/r1的比值低至1.32[20],表明该中空Gd2O3微球可作为T1型造影剂.
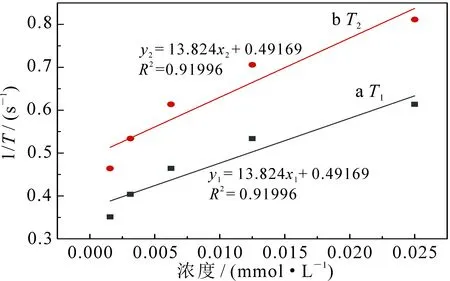
图和与不同浓度Gd3+之间的线性相关曲线
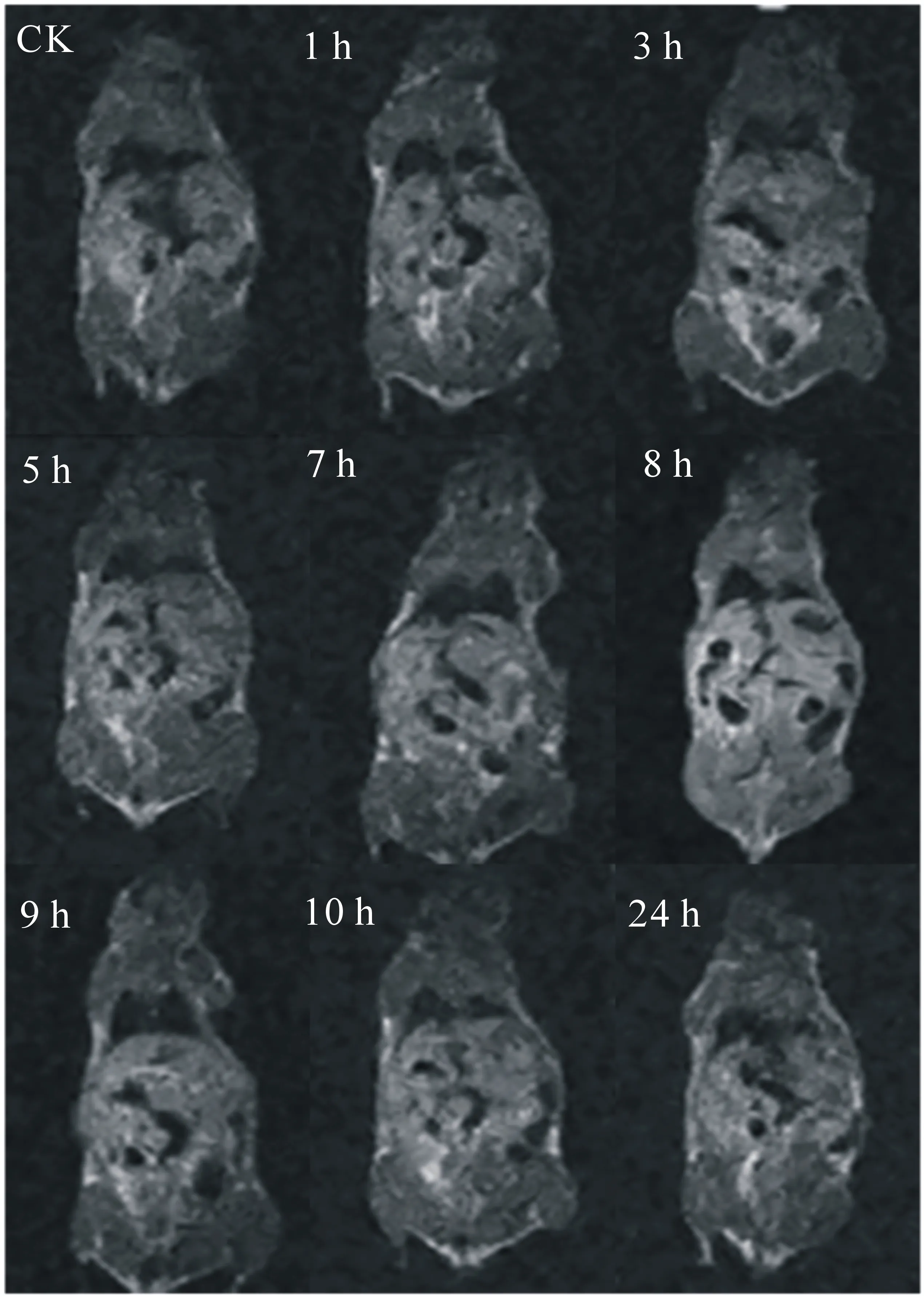
图13 尾静脉注射Gd2O3空心微球溶液后不同时间的扫描成像
2.3 活体MRI测试
通过活体成像进一步验证了中空Gd2O3微球的MRI性能,由于Gd2O3在纯水中的分散性有限,因此加入无毒且生物相容性好的吐温-20作为分散剂,将Gd2O3微球配制成浓度为10 mg·mL-1的Gd3+溶液,取20 μL对小鼠进行尾静脉注射,注射前和注射后不同时间点的小鼠冠位T1加权成像见图13.可以看出,相较于注射前的小鼠全身图像,注射中空Gd2O3微球后,随着时间的延长,小鼠整个身体图像的亮度都有所提高,说明该微球经静脉注射后很快进入小鼠体液循环,而肝脏部位的变化最为明显;注射8 h后,亮度达到最高值,此后图像的亮度随着时间进一步延长而逐渐降低;24 h后,基本恢复到注射前的水平,表明该中空微球被顺利的排出小鼠体外.上述结果进一步说明所制备的中空Gd2O3微球能够提高小鼠模型的T1图像亮度,这对于提高诊断的准确性有着重要的意义,也进一步表明所制备的中空Gd2O3微球作为T1型造影材料展示出良好的应用前景.
3 结论
通过碳微球模板法,成功制备了中空Gd2O3微球,该微球直径约为500 nm,壳厚约为20 nm,电位为-16.82 mV.体外活性表明该微球具有较低的细胞毒性,纵向弛豫率r1为10.457 L·mmol-1·s-1,且r2/r1=1.32,被用于小鼠活体成像表现出较好的造影效果,有望作为新型的T1型造影剂被广泛应用于成像技术.

