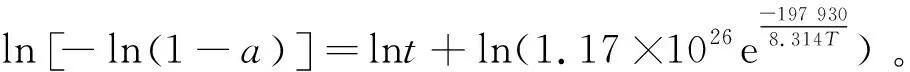高钛高炉渣酸浸液沸腾水解制备偏钛酸的过程动力学研究
唐玉梅, 何思祺,黄 晨,王 岩
(1.西南科技大学 环境与资源学院,四川 绵阳 621010;2.绵阳师范学院 环境资源工程学院,四川 绵阳 621010)
0 引言
攀枝花钢铁厂在利用钒钛磁铁矿炼铁的同时会产生一种TiO2质量分数在18%~22%的工业固体废弃物——高钛高炉渣[1]。当前我国对高炉渣主要采取渣场堆积的方式处理,此方法存在占地面积大、污染环境、对周围人畜健康会造成潜在威胁等问题[2-3]。因此,探寻高钛高炉渣的有效处理方式很有必要。
高钛高炉渣中钛含量较高,在资源化过程中很难直接用于建筑材料[4],因此相较于将高钛高炉渣整体用作制备某种材料的原料而言[5],我国学者对高钛高炉渣的研究主要集中在更有研究意义和经济价值的提钛利用方面。提钛工艺中的硫酸法提钛,因其工艺技术成熟、反应稳定易控制[6]、操作简单、可以同时提取多种有价组分[7],特别是对钛具有较高的提取率[8-10],而迅速成为研究的热点。采用硫酸处理高钛高炉渣,可将渣中的固相Ti转化为可溶的Ti4+,对于含Ti4+的酸浸液,可以采取沸腾水解的方法实现钛的沉淀[11]。而Ti4+的水解沉淀过程则是分离提取Ti4+的决定性步骤,适宜的水解条件可以最大化促进Ti4+转化成偏钛酸并保证反应产物具有良好的粒子性能,以实现后续固液相的高效过滤分离[12]。因此,探究适宜的水解条件从而提高水解率和保证水解产物的质量,对于实现高钛高炉渣中Ti的高效提取与利用,达到废物处理与资源化利用的双重目的具有重要意义。
通过动力学分析,可深入了解高钛高炉渣硫酸浸取液中有价组分的水解特性或机理,预测反应速率,从而可以有效调控反应条件,提高含Ti4+酸浸液中有价组分的水解率。国内外早就研究过含Ti4+溶液的水解动力学,但大多采用的是钛盐、Ti(SO4)2或TiOSO4等纯净的水解原料[13],而对以硫酸处理高钛高炉渣所得的含Ti4+酸浸液作为原料水解的过程动力学研究报道甚少。基于此,本研究将pH维持在其他离子(Fe3+、Mg2+、Al3+)不发生沉淀的范围内,利用酸浸液中的TiOSO4可以发生沸腾水解的特性,考查不同水解时间内底液pH和水解温度与水解率之间的关系,拟合水解过程动力学模型并计算反应活化能等,以期为高钛高炉渣硫酸浸取液沸腾水解制备偏钛酸提供理论基础。
1 实验部分
1.1 实验原料及试剂
原料:攀钢水淬高钛高炉渣经浓硫酸焙烧、稀硫酸浸取获得的富Ti4+浸取液,含有的主要金属阳离子及其质量浓度见表1。
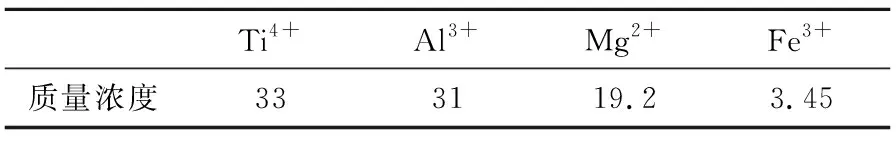
表1 高钛高炉渣酸浸液中各阳离子的质量浓度 单位:g/L
试剂:超纯水(电阻率>18 MΩ·cm),浓硫酸(质量分数为95.0%~98.0%)。
1.2 实验仪器
调速型蠕动泵(BT102S),pH计(pHS-3C),集热式恒温加热磁力搅拌器(油浴,DF-101S)。
1.3 实验步骤
a.研究pH随水解时间对水解率的影响时,配制pH为1.5、1.6、1.7的硫酸底液,并将底液加热至80 ℃,底液与富Ti4+酸浸液用量比为1∶4,通过蠕动泵将获得的酸浸液以6.6 mL/min 的速率分别匀速加入不同pH的硫酸底液中,在一定搅拌速度下混合均匀,并将酸浸液添加过程中的温度维持在80 ℃;酸浸液滴加完后,将不同pH的混合溶液均加热至105 ℃;待混合溶液出现灰点时停止加热和搅拌,熟化水解一定时间(5、10、15、20、25、30、40、50、60 min);熟化结束后再次对反应溶液进行搅拌,并加热至105 ℃反应60 min,直至水解结束。
b.探讨水解温度随时间对水解率的影响时,维持底液温度、加料速率以及底液和酸浸液用量与步骤a一致,在底液pH为1.7的情况下加入酸浸液,加料完成后分别将混合液加热至90、95、100、110 ℃,待出现灰点时停止加热并进行一定时间(5、10、15、20、25、30、40、50、60 min)的熟化水解;熟化结束后再次进行反应,加热至与第一次水解相同的温度,反应60 min,直至水解结束。
c.水解率计算。对水解料浆进行固液分离,计算对应实验条件下的水解率,进而完成动力学计算分析。
2 结果与讨论
2.1 底液pH对Ti4+水解率的影响
在水解温度为105 ℃,pH分别为1.5、1.6、1.7的条件下,浸取液中Ti4+水解率随水解时间的变化规律如图1所示。由图1可知,随着pH的增大,Ti4+水解率也随之增大。Ti4+水解的反应方程式为
Ti(SO4)2+H2O = TiOSO4+H2SO4,
(1)
TiOSO4+2H2O = H2TiO3↓+H2SO4。
(2)
由式(1)、式(2)可知:水解反应过程中H+的增加不利于反应的进行,因此pH的增大可以促进Ti4+转化生成偏钛酸,使得Ti4+水解率随pH增大而增大;但不同pH下Ti4+的最终水解率相近,均超过了90%。因此,可以推断,Ti4+与H2O反应生成H2TiO3的水解率受pH的影响较小,本实验探究范围内的溶液pH虽有一定差别,但实际上各溶液酸度相近且都较高,因此延长沸腾时间也可实现Ti4+的沉淀,并获得与升高pH同等的水解率。随着反应的进行,溶液中的Ti4+消耗减少,且生成的H2SO4对Ti4+水解具有一定抑制作用[14]。图1呈现出随着水解时间的增加,曲线趋于平缓即Ti4+水解率的增大逐渐变慢,并在反应末端趋于稳定。
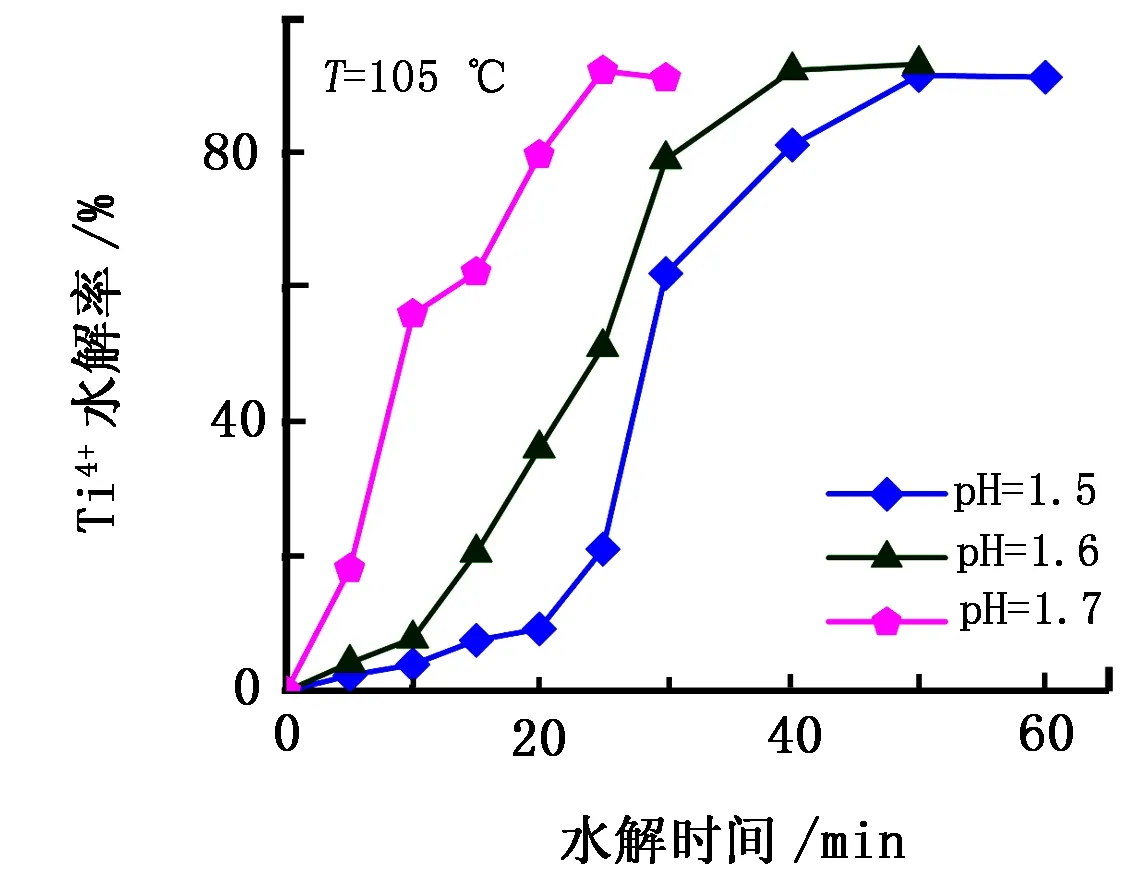
图1 不同底液pH下Ti4+水解率随水解时间的变化规律
2.2 水解温度对Ti4+水解率的影响
在pH为1.7,水解温度分别为90、95、100、110 ℃的条件下,浸取液中Ti4+水解率随水解时间的变化规律如图2所示。
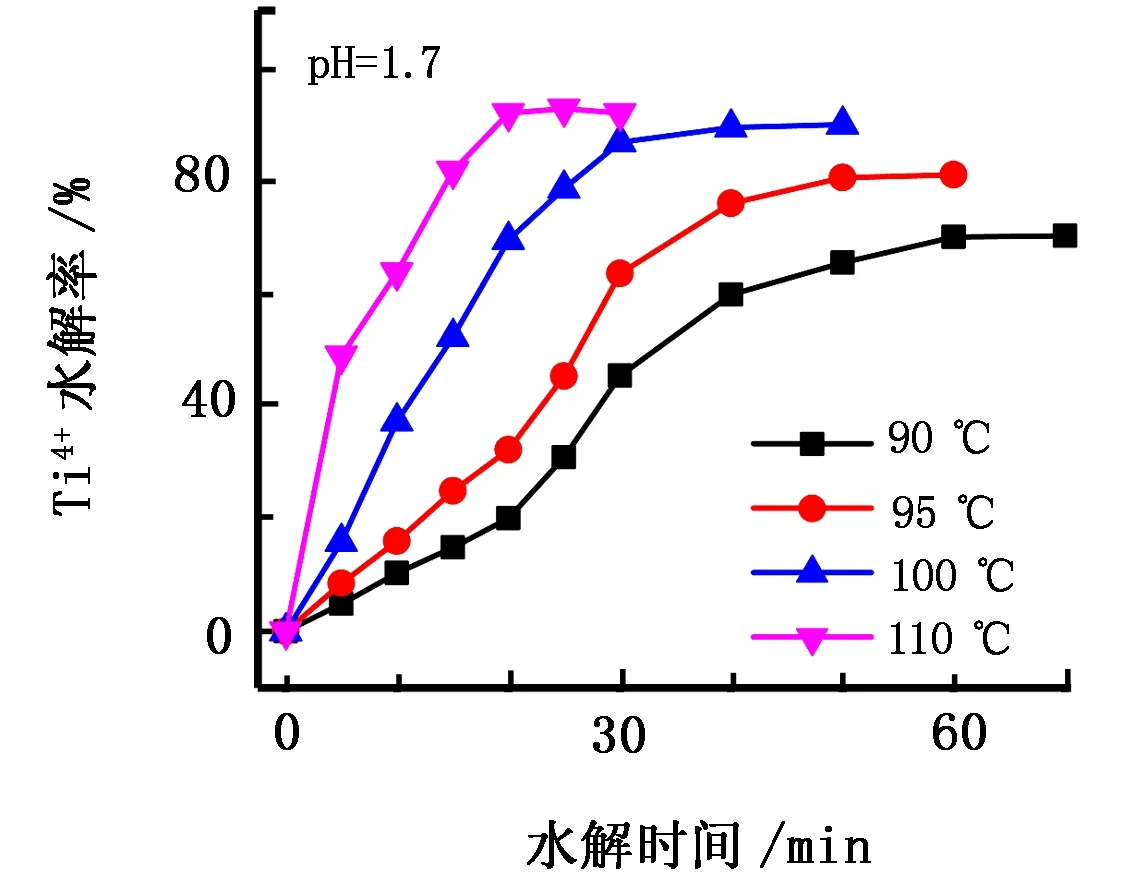
图2 不同水解温度下Ti4+水解率随水解时间的变化规律
实验结果表明,在同一水解时间下,随着水解温度的升高,Ti4+反应速率和水解率都增大。从反应热角度分析,含钛酸浸液的沸腾水解属于吸热反应,反应温度升高,利于水解反应正向进行,使得酸浸液中Ti4+水解率随温度升高而增大[15]。根据分子热运动理论,沸腾水解过程中,浸取液中包括水分子与Ti4+在内的各种粒子在不停地无规则运动,随着反应温度的升高,反应体系的黏度降低,粒子的运动速率加快;同时温度的升高也增加了溶液中反应活化分子的数量和能量,促进了溶液中各种粒子的有效碰撞,从而使Ti4+水解反应速率和水解率均随着温度的升高而增大。
2.3 水解动力学模型的拟合
TiOSO4溶液中Ti4+水解获得H2TiO3晶体的反应不是简单的相变化,其可能涉及物理变化、化学反应以及晶体生长等诸多过程,因此可以用成核动力学Avrami方程[16-17]和生长动力学方程[18]模拟溶液中Ti4+的水解过程。Avrami方程为
ln[-ln(1-a)]=nlnt+lnK1,
(3)
式中:a为Ti4+的水解率,%;t为水解时间,min;K1为反应速率常数;n是Avrami指数,取决于成核机理和生长维数,其值为
n=α+σ,
(4)
式中,α为晶核的生长方向数,σ为晶核长大经过的串联反应步骤数。
生长动力学方程为
lg(1-α)=K2lgt+K3,
(5)
(6)
(7)
式中:D为扩散系数;σ为边界层厚度;r0为各级粒子平均半径;n0为各级粒子的数目;τ为聚沉时间,min。
将不同底液pH和水解温度下随时间变化获得的Ti4+水解率(见图1、图2)按照式(3)、式(5)进行线性拟合,结果见图3和图4。
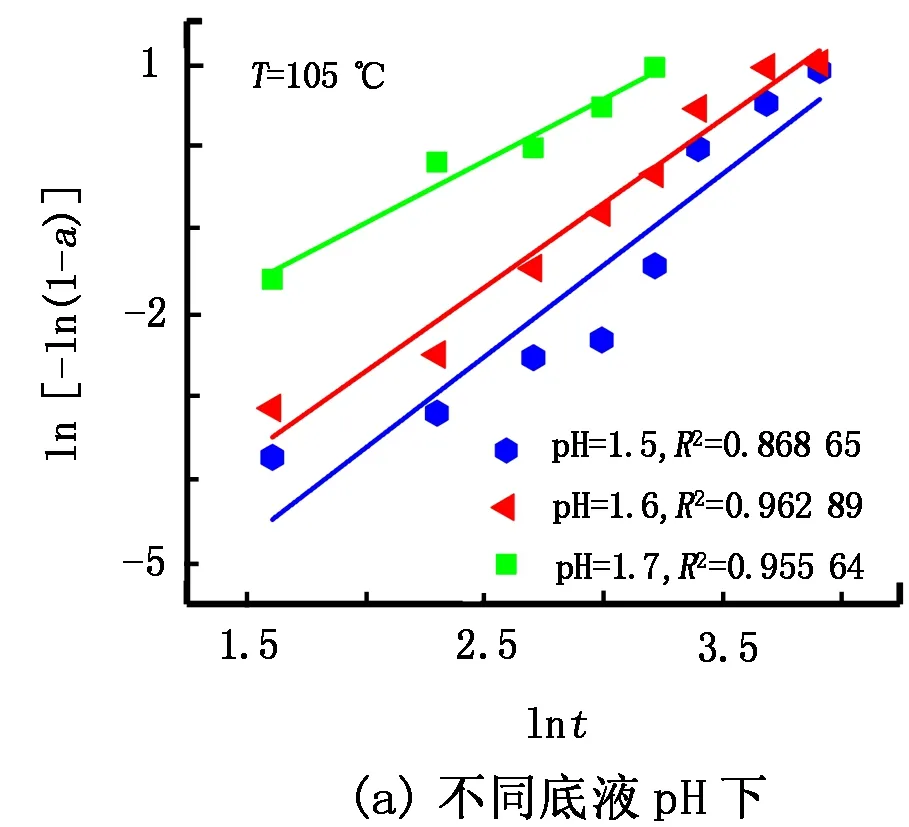
图3 不同底液pH及水解温度下ln[-ln(1-a)]与lnt的拟合关系
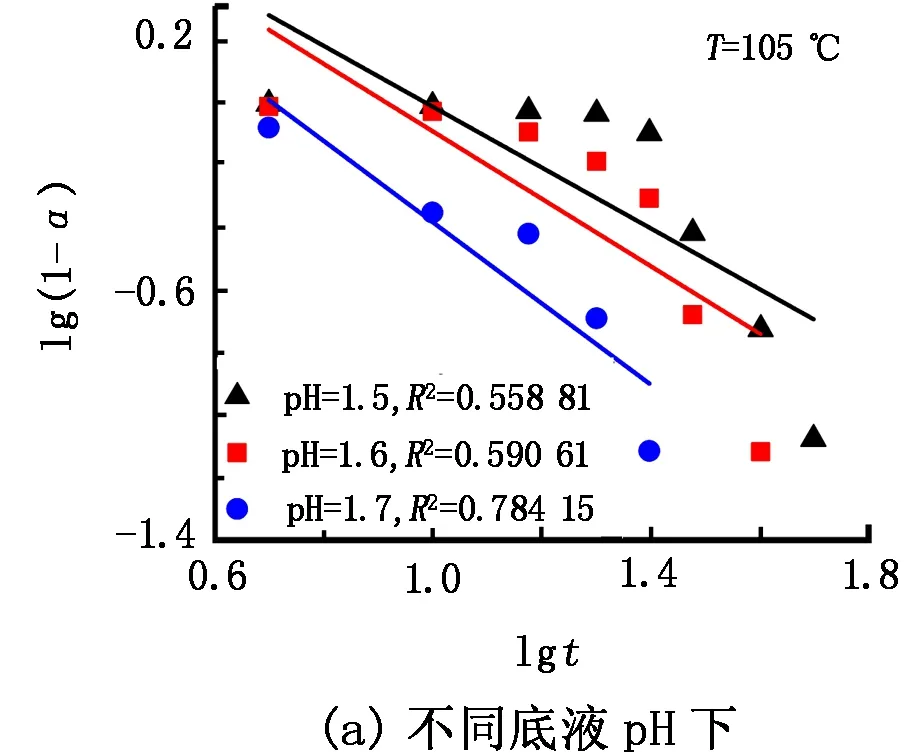
图4 不同底液pH及水解温度下lg(1-α)与lgt的拟合关系
由图3可知,采用Avrami方程进行拟合时,在不同底液pH和水解温度下,水解模型与实验结果的线性相关性均较高,相关系数R2都在0.86以上,普遍超过了0.95。
由图4可知,采用生长动力学方程拟合时,lg(1-α)与lgt的线性关系较差,相关系数R2值普遍在0.8以下,最高仅有0.85。因此可以认为H2TiO3晶体的形成过程动力学方程为Avrami方程,即偏钛酸的形成反应速率由颗粒形核过程控制。
2.4 水解动力学方程的拟合
对Avrami方程进行线性拟合后得到不同底液pH和水解温度下的拟合方程(见表2和表3)。由表2可知,当底液pH改变时,n有一定变化。当pH相对较小(为1.5和1.6)时,n在2左右;当pH为1.7时,n约为1.5。对不同底液pH和水解温度下的水解产物进行XRD分析,结果见图5。图5中水解产物的特征衍射峰均较宽,因此可以认为生成了无定形偏钛酸[19],即Avrami方程中的生长方向数α为0,此时n=σ。所以当pH为1.5和1.6时,晶体形成需要经历一次和二次成核[20];当pH为1.7时,通过一次成核即可形成H2TiO3晶体。在水解温度改变时,表3中的n都约等于1,因此可以认为本实验探讨温度下H2TiO3晶体形成只需经历一次成核且水解温度的改变不会影响H2TiO3晶体的成核次数[21]。
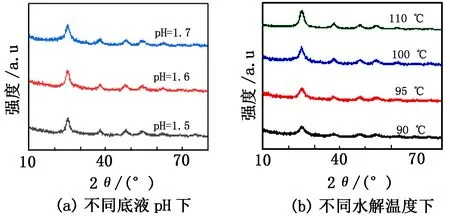
图5 不同底液pH及水解温度下水解产物的XRD图谱
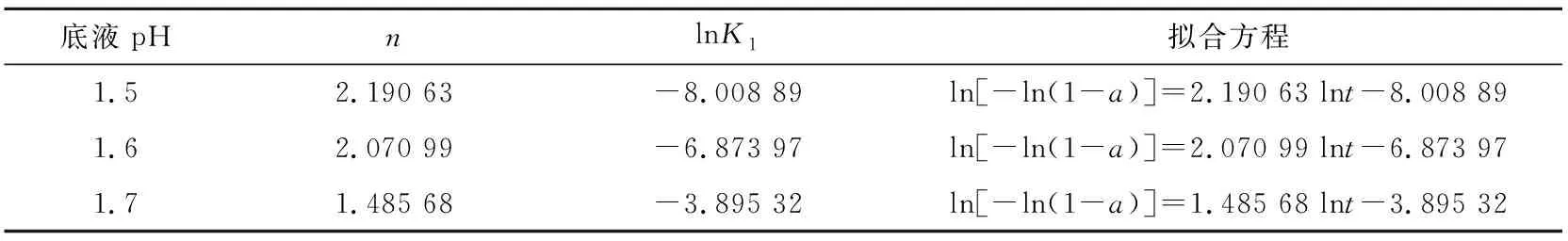
表2 不同底液pH下成核动力学模型的拟合参数及方程
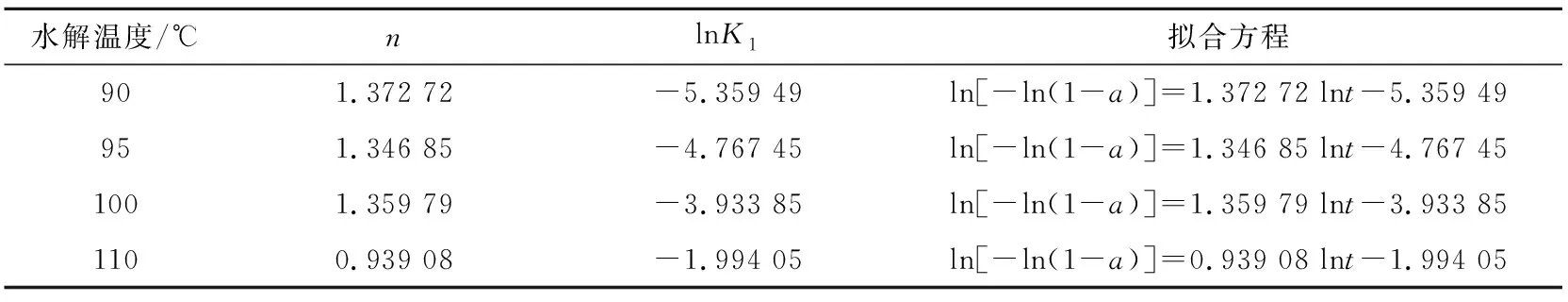
表3 不同水解温度下成核动力学模型的拟合参数及方程
当前众多研究认为水解温度主要影响水解反应体系的能量变化,当外界提供的能量高于反应所需活化能时,水解反应发生,水解反应速率常数和水解温度的关系符合Arrhenius方程,因此Avrami方程中的反应速率常数K1可以通过Arrhenius方程拟合获得。Arrhenius方程及其自然对数式为
K1=Ae-Ea/RT
,
(8)
(9)
式中:A为指前因子;Ea为表观活化能,J/mol;R为摩尔气体常数,取8.314 J/(mol·K);T为水解温度,K。
将表3中的数据代入式(9),获得lnK1与T-1的拟合线性关系图(见图6)。将图中拟合直线方程的斜率代入式(9)计算得到Ti4+水解活化能Ea为197 930 J/mol,根据图中直线的截距计算得到指前因子A为1.17×1026。将获得的A和Ea代入式(8),可以得到
(10)

图6 Arrhenius方程拟合曲线
进一步可以获得最终的半经验式动力学方程:
(11)
3 结论
a.底液pH和水解温度与Ti4+的水解率成正相关,在反应时间相同时,底液pH越大和水解温度越高,Ti4+的水解率越高。
b.酸浸液中Ti4+的水解符合Avrami成核动力学模型,H2TiO3晶体成核过程受pH影响较大,当pH小于1.7时,水解形成H2TiO3晶体需要经历一次和二次成核;当pH等于1.7时,一次成核即可形成H2TiO3晶体;水解温度不影响晶体的成核次数。