ROP 蛋白在植物生长发育及逆境响应中的作用研究进展
郭亚如,陈 欣,黄俊骏
(河南师范大学生命科学学院,河南 新乡 453007)
G蛋白是真核生物细胞内普遍存在的一类信号转导蛋白,根据其亚基组成与分子质量可以分为异源三聚体蛋白、小G 蛋白和其他几种特殊的GTP(Guanosine triphosphate)结合蛋白[1]。ROP(Rho‐related GTPases from plants)蛋白是植物特有的一类小G 蛋白。近年来,对ROP 蛋白的功能研究成了植物信号转导方面的热点,从各种植物中分离到的ROP 基因也越来越多。ROP 基因最早于1993 年在豌豆中被发现[2],之后又在多种植物中被鉴定出来。其中,拟南芥中有11 个ROP 基因,玉米中有9 个ROP 基因,油菜中有11 个ROP 基因,葡萄中有7 个ROP 基因,水稻中有7个ROP基因,苜蓿中有7个ROP基因,烟草中有6 个ROP 基因,巴西橡胶树中有5 个ROP 基因,番茄中有9个ROP基因[3‐4]。
ROP 蛋白通过GTP(激活)/GDP(Guanosine diphosphate)(失活)状态的改变,与其下游信号分子共同调控花粉管的顶端生长[5‐7]、膜泡运输[8]、活性氧产生[9‐10]、激素应答反应[11]等多种生命活动,在植物生长发育及抗逆胁迫响应方面具有重要作用[12]。例如,拟南芥ROP1和ROP2蛋白参与调控植物的生长发育[8,13],拟南芥ROP11蛋白参与调控植物抗旱胁迫应答,香蕉ROP5蛋白参与调控植物盐胁迫应答[3]等(图1)。综述了ROP蛋白的结构及其在植物生长发育和逆境胁迫应答中的作用,以期为植物抗逆遗传改良和育种提供参考。
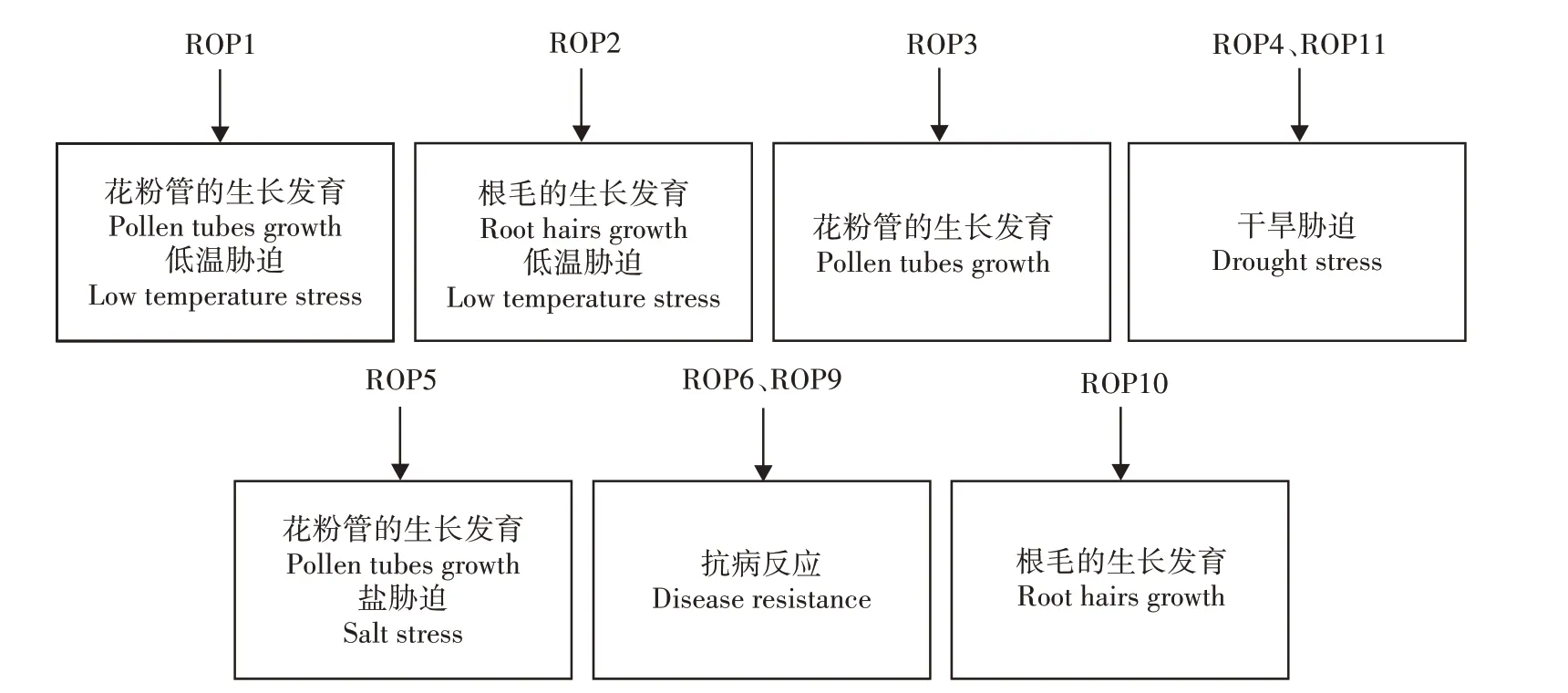
图1 ROP蛋白在植物生长发育和逆境胁迫响应中的作用Fig.1 Function of ROP protein in plant growth and development and adversity stress response
1 ROP蛋白结构
ROP 蛋白由约200 个氨基酸残基构成,分子质量介于21~24 ku。ROP 蛋白包含7 个功能结构域,分别为G1—G5、RHO(Ras homologue)插入区域和HVR(Hypervariable)区域[14]。G1—G5 结构域在整个小G 蛋白家族内高度保守,其中,G1—G3 是GTP水解区域,具有GTP 酶活性,也是磷酸化和Mg2+结合效应区;G4 和G5 是GTP 结合区域。RHO 插入区域是ROP 家族特有的,由9~11 个氨基酸组成。HVR 区域是C 端多变区域,其作为蛋白质翻译后脂修饰的位点可影响ROP 蛋白在细胞质膜上的定位。这些结构域决定了ROP 蛋白的功能和在细胞内结合的位置[14‐15]。
2 ROP蛋白在植物生长发育中的作用
植物的生长发育是一个复杂的调控过程,受基因的精细表达和外在环境因素共同调控。ROP 蛋白调控植物生长发育,主要包括花粉管和根毛的生长发育。
2.1 花粉管的生长发育
在拟南芥中,ROP1 蛋白分布于花粉管顶端的质膜上,并在花粉管生长过程中形成帽状分布,激活花粉管顶端区域,从而促进花粉管的顶端生长[5‐7]。当ROP1 蛋白活性降低时,花粉管的长度和宽度都会缩短[16]。研究发现,RopGEFs(Rop guanine nucleotide exchange factors)、ROP1 和PRK2(Pollen‐specific receptor‐like kinase)蛋白形成的信号网络调控拟南芥花粉管的顶端生长[17]。此外,RopGEFs 蛋白与PRK6相互作用会激活信号开关ROP1蛋白,进而调控花粉管的生长发育[18‐19]。也有研究发现,ROP1 蛋白通过其效应蛋白RIC3(Rop‐interactive CRIB motif‐containing protein 3)的囊泡输送到花粉管顶端的生长位点,以此促进花粉管的生长发育[8,20]。综上,ROP1 蛋白主要参与了植物花粉管的生长发育,这为进一步研究花粉管发育的内在机制提供了方向,但是否有其他ROP 蛋白家族成员参与其中还未见报道。
2.2 根毛的生长发育
JONES等[21]首次发现,ROP2蛋白在根毛的极性生长中发挥重要作用,在拟南芥中过表达ROP2基因能加快根毛的极性生长,且ROP2基因在根毛整个发育过程中都表达。研究发现,在拟南芥中,敲除ROP2和MAP18(Microtubule‐associated protein 18)基因都会导致根毛长度变短,而过表达MAP18和ROP2基因会导致多个尖端或分枝的根毛伸长,进一步分析发现,MAP18 蛋白能使ROP2 蛋白定位在根毛的顶端,从而促进根毛的伸长[13]。另外,PAT4(Protein S‐acyl transferase 4)介导的S 酰化反应可促进ROP2与根毛顶端的结合,当PAT4功能丧失后会导致ROP2 蛋白含量显著减少,从而抑制根毛的生长[22]。除了ROP2 蛋白,研究发现,ROP10 蛋白也参与根毛的生长发育[23]。在苜蓿中发现了定位于根毛顶端质膜上的ROP10蛋白,超表达ROP10基因植株根毛变长,沉默ROP10基因表达植株的根毛伸长受到抑制[23]。深入分析发现,ROP 蛋白可能通过调控活性氧来影响根毛的生长发育[24‐25]。
3 ROP蛋白在植物逆境胁迫响应中的作用
低温、干旱、高盐、病虫害等逆境胁迫会影响植物地理分布和作物产量。研究表明,ROP 蛋白参与植物对低温、干旱、高盐、病虫害等逆境胁迫的应答[26‐28]。
3.1 低温
研究发现,ROP 蛋白在缓解低温胁迫对植物的损害过程中发挥着积极的作用。枇杷果实中的3个ROP 基因家族成员ROP1、ROP2 和ROP3 正调控冷害诱导的枇杷果实木质化[29]。众所周知,“表皮烫伤”是苹果果实的主要生理疾病[30]。当苹果长时间处于低温条件下时,为了防止苹果“表面烫伤”,ROP-GAP(GTPase activating protein)信号途径可通过调节NADPH(Nicotinamide adenine dinucleotide phosphate)氧化酶的活性,使活性氧处于动态平衡,以此参与果实抵御低温胁迫[27,31]。另外,SUN等[32]也证实了ROP蛋白通过调控活性氧来抵御低温胁迫。
3.2 干旱
近年来,由于气候变化导致的温度升高和水资源匮乏已经成为亟待解决的全球性难题。干旱信号会激发ABA(Abscisic acid)、油菜素甾醇和乙烯等植物激素以及ROP 蛋白的响应[33‐34]。在拟南芥中超表达香蕉ROP基因,干旱胁迫条件下,转基因植株的存活率(35%~65%)明显高于野生型对照(16%)[35],表明在拟南芥中超表达ROP基因可以提高转基因植株的抗旱性。随后在拟南芥中发现,ROP11 在ABA 诱导的保卫细胞气孔关闭过程中发挥负调控作用,以此参与抗干旱胁迫应答[11]。此外,当拟南芥ROP基因表达被抑制后,突变体表现出对干旱胁迫的敏感性,而野生型对照对干旱胁迫不敏感,表明ROP 蛋白参与了植物的抗干旱胁迫响应[36]。另外,林群婷等[37]研究发现,干旱胁迫条件下,水稻ROP 家族成员Rac5(Rop‐interacting CRIB‐containing protein)基因被诱导表达,说明Rac5基因可能参与植物的干旱胁迫响应。
3.3 高盐
植物ROP 蛋白主要通过与下游效应因子结合、调控过氧化氢酶活性、升高K+/Na+值等途径抵御盐胁迫。研究表明,拟南芥ROP2 蛋白通过其下游效应因子RIC1 调控微管重组以应对高盐胁迫[26]。受盐胁迫时,过表达烟草ROP1基因的拟南芥植株过氧化氢酶活性较野生型对照提高,过氧化氢含量增加,根变短,对盐胁迫的敏感性增强,而沉默烟草ROP1基因表达植株表现出耐盐性[38],表明烟草ROP1 蛋白负调控植物的耐盐性。另外,超表达香蕉ROP5g基因拟南芥植株的耐盐性增强,这主要归因于转基因植株细胞质K+/Na+值和Ca2+浓度升高[3]。综上,ROP蛋白参与了植物响应盐胁迫过程。
3.4 病虫害
植物ROP 蛋白在植物病虫害防御中具有重要作用。在拟南芥和马铃薯中,ROP蛋白通过调控SA(Salicylic acid)信号途径对植物的抗病反应进行应答,进而增强植物的抗病性[39]。在水稻中,Rac1 蛋白通过CERK1(Chitin elicitor receptor kinase)介导的信号途径调控活性氧,进而参与植物对稻瘟病的响应[9‐10]。在苜蓿中,ROP9 蛋白抑制了菌根和红曲霉早期菌丝的定殖[28]。在大麦中,RacB基因沉默表达大麦对白粉病菌(Blumeria graminis)的抗性增强,说明RacB 负调控大麦的抗病性[40]。在烟草中过表达小麦Rac1基因促进了CCR(Cinnamyl‐COA reductase)和CAD(Cinnamy alcohol dehydrogenase)基因的表达,从而增加了总木质素含量,最终增强了烟草对黑胫病和青枯病的抗性[41]。另外,ROP 蛋白可作为分子开关,通过激活多种免疫反应增强植物对病原体的抵抗力[42]。类似地,作为分子开关,辣椒ROP1 蛋白通过介导茉莉酸/乙烯的信号转导参与辣椒对青枯病的抗性反应[43]。
4 展望
目前,利用各种过表达植株和功能缺失突变体进行的一系列研究证明,ROP 蛋白在植物中作为分子开关参与调控根毛和花粉管的生长发育,通过激活免疫反应、增加木质素含量、调节酶活性等来参与植物的抗逆胁迫反应。但是,目前关于ROP 蛋白在植物生长发育和逆境胁迫响应中的作用研究还处于初级阶段,研究内容多停留在对现象的描述,对其具体作用机制的研究还不够深入。在未来的研究中,可在参考借鉴哺乳动物中小G 蛋白的作用机制研究的基础上,结合植物自身生长发育的特点,利用近年来迅速发展起来的基因编辑、基因组学等技术对植物ROP 的功能、作用机制等进行更加深入的研究,并将研究成果进行转化,促进作物生产。

