基于二代基因测序在免疫抑制合并重症肺炎病原诊断及治疗中的应用
马肖龙,高锋,冯思涵
重症肺炎(SP)是在一些心肺疾病的基础上附加危险因素共同作用导致的肺炎,临床发生率较高[1]。有研究显示约20%的社区获得性肺炎患者存在免疫抑制,免疫抑制并急性低氧性呼吸衰竭患者的短期病死率约50%[2-3]。由于免疫抑制合并SP 患者自身免疫调节异常,易造成大范围组织的应激损伤,患者长期使用免疫抑制剂,导致其细胞体液免疫受到抑制,因此免疫抑制合并SP患者的病情往往可控性差,生存率低。病原的早期鉴别决定了治疗方案的精准度[4]。二代基因测序(NGS)高通量基因测序是一种快速、精准及低成本的基因检测新方法,可快速、精准地诊疗急危重症感染,能对多个基因和未知序列进行同步测序[5-6]。本研究以免疫抑制合并SP 患者为研究对象,基于肺泡罐洗液病原感染NGS 指导抗生素使用,探讨NGS 在免疫抑制合并SP 中的应用价值。现报道如下。
1 资料与方法
1.1 一般资料 回顾性收集2020 年1月至2021 年5 月在浙江省嘉兴市第一医院就诊的60 例免疫抑制合并SP 患者。纳入标准:(1)符合免疫抑制合并SP诊断标准;(2)未使用其他方案进行治疗;(3)对本研究方案知情,且自愿参与并签署知情同意书。排除标准:(1)治疗期间出现全身炎症反应及异常表现;(2)有严重精神疾病;(3)支气管镜检查禁忌者。按治疗方法不同分为观察组和对照组,各30 例,对照组男23 例,女7 例;平均年龄(55.3±10.2)岁;平均入院时间(16.12±5.84)d;合并基础疾病:关节病5例,淋巴瘤2 例,抗中性粒细胞浆抗体(ANCA)相关性血管炎2 例,糖尿病8例,结缔组织病2例,呼吸系统疾病5例,癌症4 例,心脑血管疾病1 例,其他1 例。观察组男21 例,女9 例;平均年龄(54.7±9.7)岁;平均入院时间(15.51±6.23)d;合并基础疾病:关节病6 例,淋巴瘤3 例,ANCA相关性血管炎2 例,糖尿病7 例,结缔组织病4 例,呼吸系统疾病3 例,癌症2 例,心脑血管疾病2 例,其他1 例。两组一般资料差异无统计学意义(P>0.05)。
1.2 诊断标准 SP诊断标准:参照第七版《内科学》的诊断标准,即符合以下l条主要标准或3 条次要标准者为SP[7]。主要标准:(1)需要有创机械通气;(2)感染性休克需要血管收缩剂治疗。次要标准:(1)呼吸频率≥30 次/min;(2)氧合指数≤250 mmHg(1 mmHg≈0.133 kPa);(3)多肺叶浸润;(4)意识障碍或定向障碍;(5)血尿素氮≥20 mg/dl;(6)低血压,收缩压<90 mmHg;(7)白细胞(WBC)减少(<4.0×109/L);(8)血小板减少(<10.0×109/L);(9)核心体温<36 ℃[6]。免疫抑制诊断标准:血液系统肿瘤、实体恶性肿瘤、肿瘤化疗、实体器官移植及人类免疫缺陷病毒(HIV)感染,长期口服泼尼松或大剂量静脉使用糖皮质激素治疗≥2 周,长期接受免疫抑制剂治疗。
1.3 方法 对照组病原鉴定采用VITEK MS 质谱仪(法国梅里埃)进行细菌鉴定,药敏根据菌种阴性菌和阳性菌分别采用梅里埃全自动分析仪VITEK 2 Compact 仪器相对应的GN-AST 卡和GP-AST 卡检测最低抑菌浓度(MIC值)。观察组采用NGS 检测肺泡灌洗液的感染病原,同时进行药敏试验,根据测定结果选择敏感抗生素进行治疗。对照组早期采用经验性用药给予广谱抗菌药物治疗,根据上述病原学检测、药敏试验及初步疗效调整用药方案,同步调整免疫抑制剂用量,接受抗菌药物治疗的同时保持营养支持,纠正低蛋白血症。观察组在对照组治疗方案的基础上,根据NGS 测定鉴别报告与患者病程进展调整抗菌方案。
1.4 观察指标 两组在治疗第1、3、7天检查血常规[WBC、淋巴细胞(LYM)水平]、血气分析[氧分压(PaO2)、二氧化碳分压(PCO2)]、血清C 反应蛋白(CRP)、降钙素原(PCT)、血钾、丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、肌酐(CR)水平及胸部CT 或X 线片。疗效判定:根据患者胸部CT 判定是否有效,有效为患者下呼吸道感染症状有不同程度的消退和改善,统计患者生存时间,绘制30 d 生存曲线,计算生存率[4]。
1.5 统计方法 采用SPSS 20.0 统计软件进行分析,计量资料以均数±标准差表示,重复测量数据采用单因素方差分析,组间比较采用t 检验或非参数检验;计数资料采用检验。P<0.05 为差异有统计学意义。
2 结果
2.1 观察组病原检测结果 NGS 病原检查结果与传统痰培养病原检测存在差异,NGS病原检查阳性检出率为83.3%,传统痰培养病原检测阳性检出率为40.0%;其中传统痰培养阴性14 例,但NGS 结果阳性,见表1。病原菌分别为椰氏肺孢子菌、巨细胞病毒、单纯疱疹病毒、军团菌、屎肠球菌、白色念珠菌、嗜麦芽窄食单胞菌、副流感嗜血杆菌、缓症链球菌、龋齿放线菌、铜绿假单胞菌及溶血性葡萄球菌。
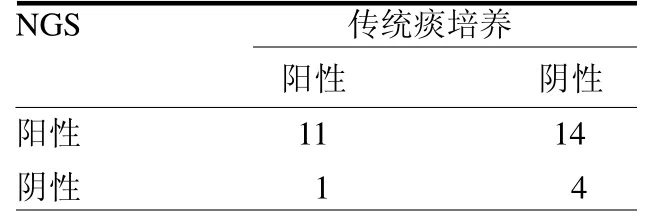
表1 观察组病原学检测结果 例
2.2 两组炎症细胞水平比较 第7 天时,观察组WBC水平低于对照组,LYM水平高于对照组(t=2.405、2.689,均P<0.05),见表2。

表2 两组炎症细胞水平比较 109/L
2.3 两组血气分析指标比较 随着治疗时间的延长,两组PaO2均升高,第7天时,观察组PaO2高于对照组(t=3.512,P<0.05);两组PaCO2水平先升高后降低,第7 天时,观察组PaCO2高于对照组(t=2.977,P<0.05)。见表3。

表3 两组血气分析指标比较 mmHg
2.4 两组炎性因子表达水平比较 两组第1 天各炎症因子表达水平差异均无统计学意义(均P>0.05),观察组第3天及第7 天CRP、PCT、ALT、AST、CR表达水平均低于对照组(均P<0.05)。见表4。
2.5 生存曲线分析 观察组30 d 生存率为83.33%,高于对照组的60.00%(=4.02,P<0.05),见彩图1。
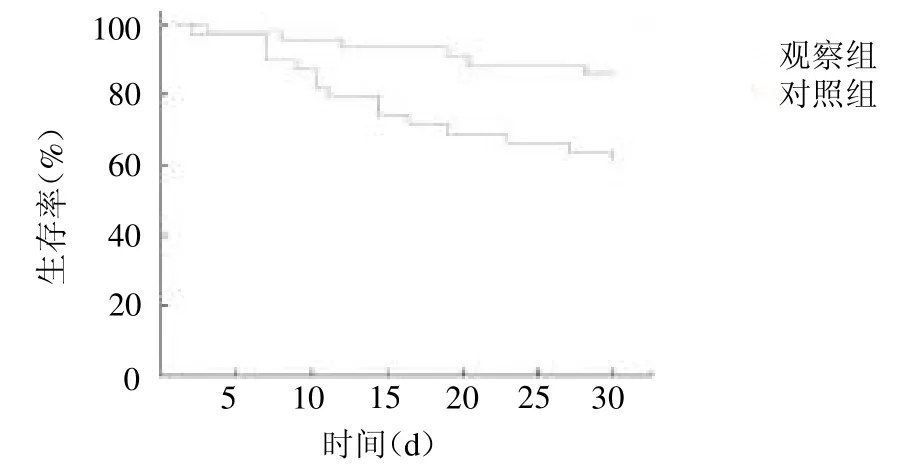
图1 生存曲线分析
3 讨论
SP 是病死率较高的一种呼吸道疾病,免疫抑制并发SP患者病原学尤为复杂,其病死率仅次于恶性肿瘤和心脑血管疾病[8]。免疫抑制患者的免疫反应长期处于抑制状态,极易引起感染发生,常见的感染性疾病就是肺部感染,炎症反应失控和免疫失衡是重症感染的一大核心问题[9]。目前主流治疗方式是大量使用抗生素进行抗菌治疗,现行抗生素的协同原则易导致耐药菌株的出现,无法及时且有效地控制感染,导致病情恶化,因此了解病原菌的分布特征及耐药情况是选择、优化抗菌用药精准度的前提[10]。临床上应用较广泛的肺炎检测方法主要有痰细菌培养、血培养、血肺炎支原体、咽试子和肺泡灌洗液检测。纤维支气管镜通过留取肺泡灌洗液进行病原筛查,为疾病的诊断提供依据,其与痰培养、咽试子相比,后者所取痰液标本更多来源于上呼吸道,容易遭到上气道定植菌的污染,从而可能得出与临床表现不相符的结果,不能达到真正指导临床用药的目的。因此临床上针对肺炎病原的筛查,需提高病原检出率,为临床合理使用抗生素提供依据[11-12]。
NGS 技术可通过提取感染部位标本的病原微生物核酸,采用常规文库构建流程,对标本中的核酸进行测序并计算出序列数,序列数与标本的病原体载量负荷、核酸提取量呈正相关的关系,在短时间内检测包括细菌、真菌、病毒、寄生虫、分枝杆菌、支原体和衣原体等在内的多种病原微生物[13]。NGS 技术具有检测速度快、准确率高、成本低、覆盖面广以及产出巨大等特点,且采用宏基因组高通量技术检测病原微生物的灵敏度和特异度均优于传统的方法,并且受抗菌药物的影响较小,细菌学与分子生物学结合的检查技术是医学上重要的进展之一,为临床上诊断疑难性感染类疾病带来了革命性的突破[14]。
本研究通过探讨NGS 技术在免疫抑制合并SP诊断中的应用价值,结果发现观察组的NGS 病原检查结果与传统痰培养病原检测存在差异,传统痰培养病原鉴定为阴性的情况下,NGS 病原检查为阳性,NGS 病原检测阳性率为83.3%,传统痰培养病原检测阳性率为40.0%。本研究对传统痰培养病原检测的假阴性病例进行统计,发现未检出的病原菌分别为椰氏肺孢子菌、嗜麦芽窄食单胞菌、副流感嗜血杆菌、缓症链球菌、龋齿放线菌、铜绿假单胞菌及溶血性葡萄球菌等。此可见,传统痰培养病原检测方法对病原菌的检出具有明显的局限性,临床鉴别需要更为精准的方法对病原菌进行鉴别,并指导临床改进治疗方案。在NGS 病原检查结果的指导下,观察组在治疗过程中,炎症细胞因子、炎性因子水平及血气分析等指标均优于对照组,且30d生存率高于对照组(均<0.05)。
综上所述,根据NGS技术病原检查结果指导调整优化抗生素的治疗方案可提高免疫抑制合并SP患者的治疗效果,降低病死率,NGS 技术对于感染性疾病病原早期诊断及治疗的有效工具,对指导临床治疗具有重要的价值。

