急性胰腺炎患者合并感染性胰腺坏死的影响因素及其列线图模型构建
林 羽, 王 萍, 石 珍
急性胰腺炎(acute pancreatitis, AP)病因复杂,以胆石症诱发的胆源性AP最为多见,受高脂血症及饮酒等因素影响[1]。部分AP患者症状较轻,有自限性,病死率低[2],也有部分AP患者经治疗后病情进展,发生感染性胰腺坏死(infected pancreatic necrosis, IPN),增加患者院内病死率[3]。既往研究[4-5]对AP患者并发IPN因素进行分析,得出危险因素包括病程、降钙素原(procalcitonin, PCT)、脂肪酶(lipase, LPS)水平及急性生理学与慢性健康状况评分 Ⅱ(acute physiology and chronic health evaluation scoring systemⅡ, APACHEⅡ)等,但未分析各因素影响IPN的机制,且未将各危险因素整合为预测模型,无法有效预测AP患者IPN发生风险,临床应用尚有局限。基于此,本研究进一步观察AP患者合并IPN的影响因素,并构建列线图模型,报道如下。
1 资料与方法
1.1一般资料 制定纳入及排除标准,回顾性分析长江航运总医院2015年1月至2021年1月收治的516例AP患者的临床资料,用于建模及内部验证,按照同样标准,从Dryad数据知识库中筛选独立的AP患者1062例,回顾性分析患者资料,用于外部验证。本研究经医院医学伦理委员会审核并批准(伦审批号:2014-37号)。
1.2纳入与排除标准 纳入标准:①符合AP诊断标准[6],经CT检查确诊;②有急性腹痛症状;③行辅助检查可见血清淀粉酶(AMS)水平超过3倍正常值上限;④初次发病;⑤认知功能正常,可配合调查。排除标准:①合并腹部恶性肿瘤;②入院时已患有IPN;③入组前1个月服用过激素或免疫抑制剂。
1.3方法
1.3.1 基线资料 记录患者年龄、性别、发病原因、发病至入院时间、慢性疾病史(高血压、糖尿病、高脂血症)、入院时APACHEⅡ评分、血红蛋白(hemoglobin, Hb)、白蛋白(albumin, ALB)、白细胞计数(white blood cell count, WBC)、PCT、AMS、LPS、第一周发生低血压情况(以收缩压≤90 mm Hg,舒张压≤60 mm Hg判定为低血压)、合并胰腺外感染情况(通过CT检查评估)、合并低氧血症(在呼吸空气时,氧分压<60 mm Hg,血氧饱和度<90%)、合并多器官功能衰竭(结合血气指标、肾功能、颅内压、心力衰竭等情况综合评估)、禁食时间、有无应用机械通气、有无应用抗生素。APACHEⅡ评分:参照有关文献[7]评估:总分为0~71分,分值越高,病情越严重。各指标检测方法:抽取患者空腹肘静脉血6 mL,分装于两管,一管血液标本以4500 r/min的速度、8 cm的离心半径离心10 min,取血清,采用贝克曼库尔特AU680型全自动生化分析仪检测AMS、LPS水平,检测方法为酶动力学法,采用法国梅里埃公司VIDAS30型全自动免疫荧光分析仪检测PCTS水平。一管血液标本不做离心处理,采用日本希森美康公司XT-1800i型血细胞分析仪及仪器配套的试剂检测Hb、ALB、WBC水平。
1.3.2 治疗方案 参照指南[6]治疗原则,患者需禁食,实施吸氧、肠内营养支持、胃肠减压、抑制胰酶、抗感染、纠正水电解质紊乱等治疗,患者若出现脓毒症及多器官功能障碍,行机械通气、血液透析等治疗,根据患者病情决定是否应用抗生素。
1.3.3 IPN评估 记录患者住院期间IPN发生情况,患者临床表现为脓毒血症,出现气泡征,行细针穿刺抽吸物涂片检出真菌或细菌,判定为IPN。将患者分为合并IPN组与未合并IPN组,采用Logistic回归分析检验AP患者合并IPN的影响因素,应用R语言建立预测AP患者合并IPN的列线图模型,采用Bootstrap法进行模型验证,并探讨列线图模型对AP患者发生IPN的预测效能。
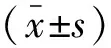
2 结果
2.1内部验证组与外部验证组一般资料 两组一般资料比较差异无统计学意义(P>0.05),具有可比性,见表1。
2.2回归分析检验AP患者发生IPN的影响因素 将APACHEⅡ评分、PCT、LPS、合并胰腺外感染情况、合并低氧血症、合并多器官功能衰竭、有无应用机械通气、有无应用抗生素纳入作为自变量,变量赋值见表2,将IPN发生情况作为因变量(1=合并IPN,0=未合并IPN)。经Logistic回归分析结果显示,APACHEⅡ评分高、PCT及LPS水平高、合并胰腺外感染、合并低氧血症及合并多器官功能衰竭是AP患者发生IPN的危险因素(OR>1,P<0.05);应用抗生素是AP患者发生IPN的保护因素(OR<1,P<0.05)。见表3。
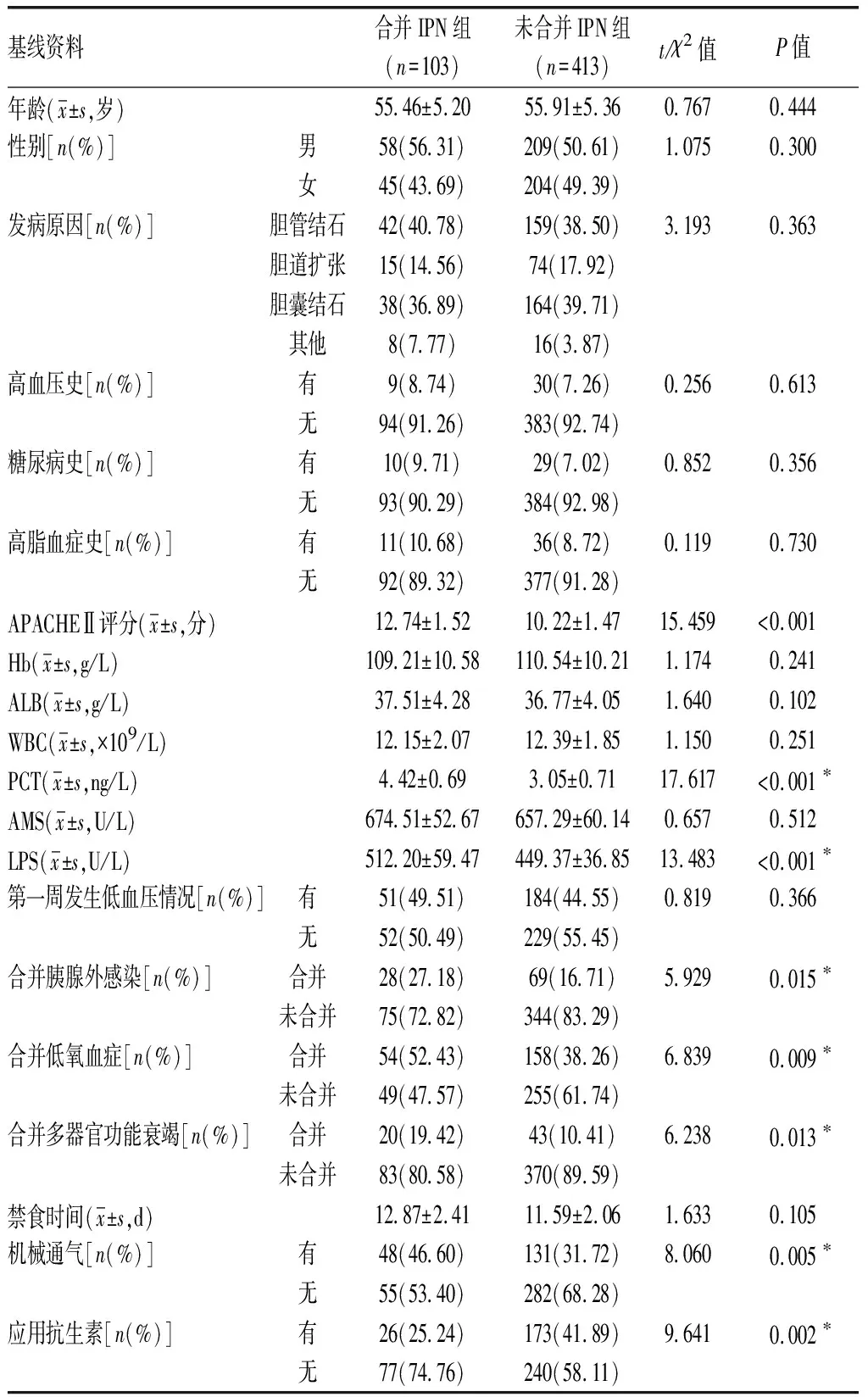
表3 AP患者合并IPN组与未合并IPN组基线资料比较
2.3IPN发生情况 内部验证组516例AP患者中,有103例(19.96%)发生IPN,有413例(80.04%)未发生IPN。
2.4合并IPN组与未合并IPN组基线资料 合并IPN组APACHEⅡ评分、PCT及LPS水平高于未合并IPN组,合并胰腺外感染、合并低氧血症、合并多器官功能衰竭、行机械通气占比高于未合并IPN组,应用抗生素占比低于未合并IPN组,差异均有统计学意义(P<0.05);两组其他基线资料比较差异无统计学意义(P>0.05)。见表3。
2.5构建预测AP患者合并IPN的列线图模型 基于APACHEⅡ评分、PCT、LPS水平、合并胰腺外感染情况、合并低氧血症、合并多器官功能衰竭、有无应用机械通气、有无应用抗生素,建立预测AP患者发生IPN的列线图模型,见图1。同时使用Bootstrap内部验证法对预测AP患者发生IPN的列线图模型进行验证,校准曲线和Y=X直线相近,模型校准度良好,C-index值为0.814,说明模型具有良好的区分度,见图2。并对列线图模型进行内部验证,绘制ROC曲线发现,列线图模型预测AP患者IPN发生风险的AUC为0.827>0.80,有一定预测价值,对应的AUC的95%置信区间0.773-0.880、P<0.001、特异度0.777、敏感度0.748、约登指数0.525,见图3。
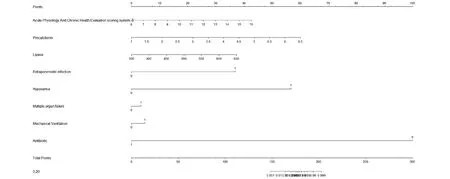
图1 预测AP患者合并IPN的列线图模型
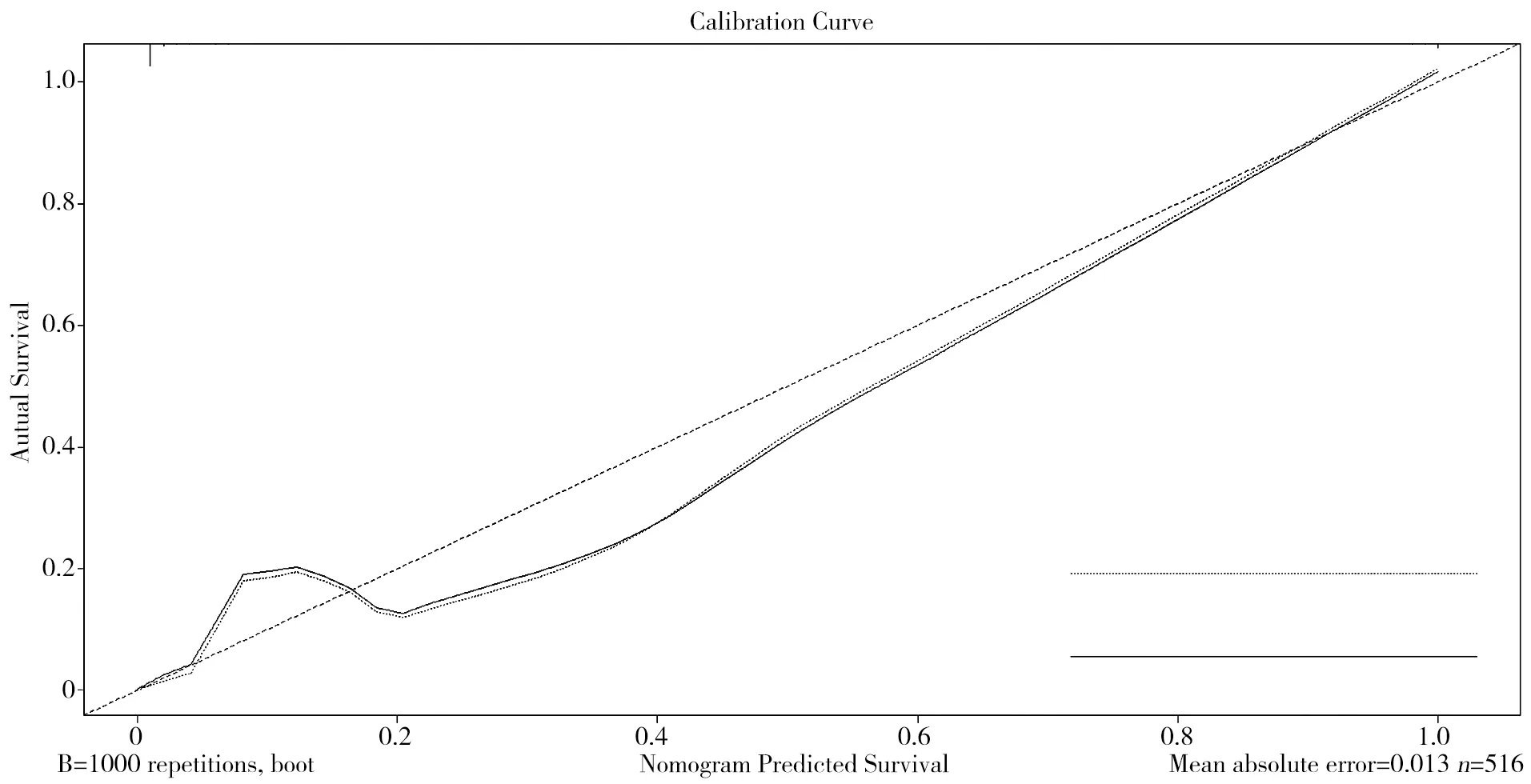
图2 预测AP患者合并IPN列线图的校准曲线
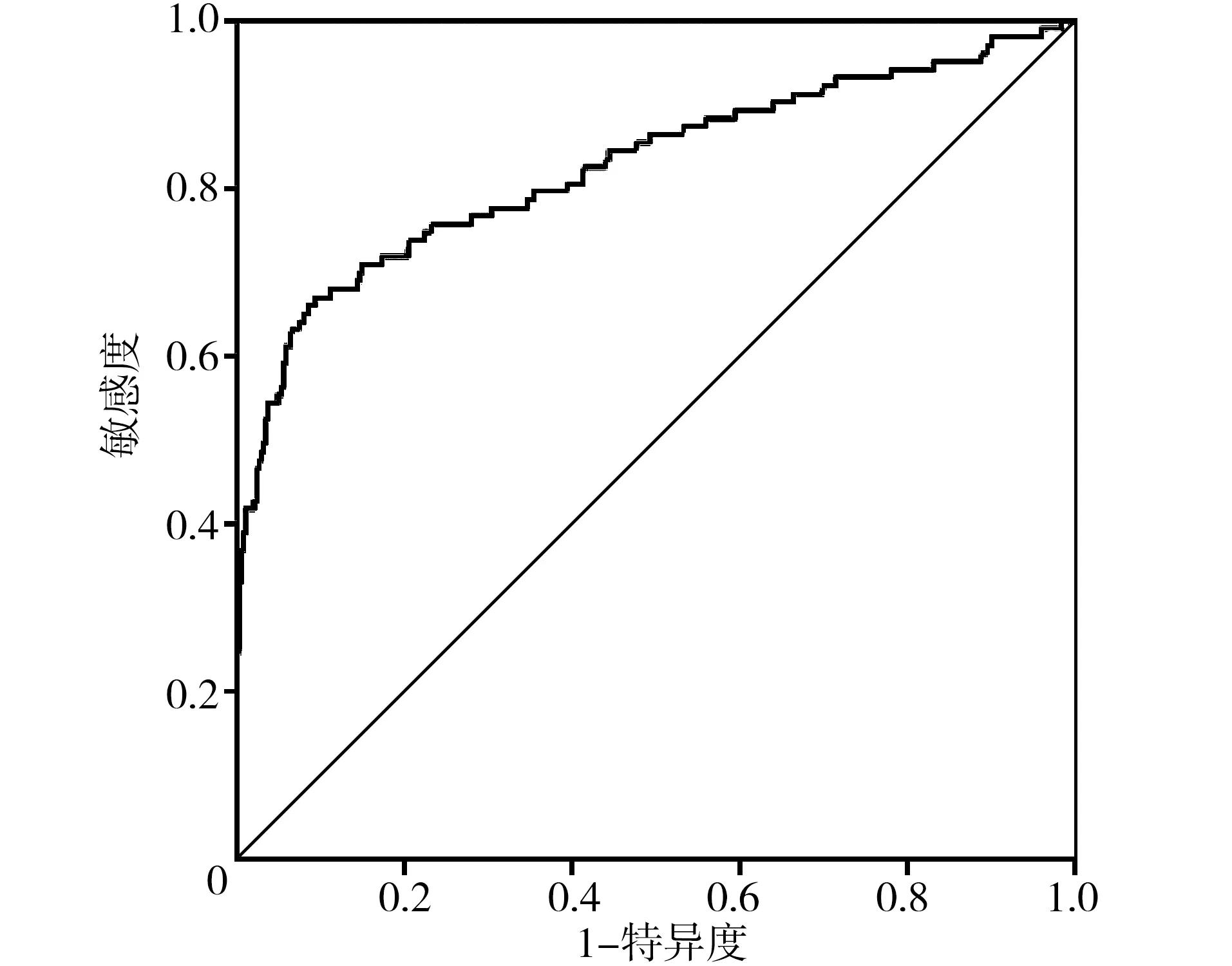
图3 预测AP患者合并IPN列线图模型内部验证的ROC曲线
2.6列线图模型外部验证 对列线图模型进行外部验证,绘制ROC曲线发现,列线图模型预测AP患者IPN发生风险的AUC为0.932>0.90,有高预测价值,对应AUC的95%置信区间0.903~0.960、P<0.001、特异度0.782、敏感度0.903、约登指数0.685,见图4。

图4 预测AP患者合并IPN列线图模型外部验证的ROC曲线
3 讨论
AP发病期间有两个病死高峰,第一个病死高峰在急性反应期,胰酶大量释放,胰腺组织发生无菌性坏死,细胞因子和炎症介质过度分泌,诱发全身炎症反应综合征;第二个病死高峰发生于全身感染期,无菌性胰腺坏死继发细菌感染,造成IPN[8-9]。因AP诊治水平提高,患者在第一个病死高峰期内的病死率得到控制,但发生IPN的风险尚未能有效降低。
刘燕等[10]研究结果显示,AP患者短期IPN发生率可达19.44%。本研究结果显示,内部验证组516例AP患者中,103例发生IPN,413例未发生IPN。初步比较合并IPN组与未合并IPN组基线资料后,经Logistic回归分析结果显示,APACHEⅡ评分高、PCT及LPS水平高、合并胰腺外感染、合并低氧血症及合并多器官功能衰竭是AP患者发生IPN的危险因素,应用抗生素是AP患者发生IPN的保护因素。
对各项因素与IPN发生的关系进行分析。APACHEⅡ评分高:APACHEⅡ评分主要评估患者慢性健康与急性生理状况、年龄状况,评分升高者健康与生理状况差,病情更易发生进展,继发感染风险高,易发生IPN[11]。PCT水平高:PCT多由甲状腺素细胞分泌,在正常生理状态下分泌量小,血液中含量低,而在机体存在感染时,肝组织中多种细胞过量分泌PCT,造成血液中PCT水平升高[12-13]。因此PCT可作为早期感染的诊断指标,PCT水平越高,患者早期感染越严重,治疗后更易发生继发感染,增加IPN发生风险。LPS水平高:LPS组织来源较少,主要由胰腺组织产生,作为脂肪水解酶类物质,在胰腺水肿、细胞坏死时,胞内LPS大量进入血液循环,持续时间长[14]。目前临床将LPS作为AP的特异性诊断指标之一,LPS水平越高,胰腺局部炎症越重,胰腺组织受损严重,受损范围越大,发生继发性感染的风险越高,更易发生IPN。合并胰腺外感染:AP患者常可伴发尿路感染、肠道感染、肺部感染,各类型胰腺外部感染可加重全身炎症反应综合征,增加病原菌产生及迁移可能,继而可发生IPN[15]。合并低氧血症:AP可造成胰腺组织灌注不足,引发微循环受损,合并低氧血症可进一步加重胰腺组织缺氧程度。增加胰腺组织损伤风险,继发性感染发生风险增加,易发生IPN[16]。合并多器官功能衰竭:多器官功能衰竭以继发性感染为突出表现,患者免疫功能进一步降低,抗感染能力低下,可持续数天,在此期间IPN发生风险高[17]。应用抗生素:早期应用抗生素预防可减少胰腺感染发生,但不合理应用抗生素可增加真菌感染及细菌耐药风险[18]。因此,目前临床对AP患者抗生素的使用仍有较大争议。本研究结果显示,应用抗生素利于降低IPN发生风险,说明抗生素应用对预防IPN尚有一定效果。分析原因为,AP患者因氧自由基、炎症介质大量释放,造成机体肠道屏障损伤,致病菌增加,并可经门脉系统、淋巴累及胰腺组织,而应用抗生素可预防AP患者肠道菌群移位,及时控制感染,利于预防IPN[19]。但抗生素的合理应用方案尚有待进一步探讨,还需观察患者远期预后不良风险,进一步改进抗生素应用方案。
建立预测AP患者发生IPN的列线图模型,并行内部及外部验证得出,模型具有良好的区分度;内部验证有一定的预测价值;外部验证有高预测价值。临床可将AP患者发生IPN的列线图模型推广应用,对存在高IPN发生风险的患者,可合理应用抗生素,积极治疗原发病,并应用益生菌治疗,减少肠道有害菌群移位。因本研究未能观察AP患者C反应蛋白及白细胞介素等指标,结论尚有局限,未来还应进一步完善纳入AP患者各项资料,改进列线图模型,进一步制定IPN预防措施。
综上所述,AP患者发生IPN受APACHEⅡ评分、PCT、LPS、合并胰腺外感染、合并低氧血症、合并多器官功能衰竭、机械通气及应用抗生素影响,基于多种因素建立列线图模型,可为临床合理预测AP患者IPN发生风险提供有效手段,并进一步制定预防措施。

