18F-FDG PET/CT动态评价单纯125I粒子植入或联合顺铂化学治疗兔VX2肺癌效果
王 娟,王荣福,王 正,赵瑞峰,姚永熠
(1.晋城大医院核医学科,山西 晋城 048006;2.北京大学第一医院核医学科,北京 100034;3.北京大学国际医院核医学科,北京 102206)
肺癌发病率高、预后差,主要治疗方法包括手术、化学治疗(简称化疗)及放射治疗(简称放疗)等[1]。低剂量125I放射性粒子植入术是近距离治疗恶性肿瘤的精确放疗技术[2],副作用小[3]。18F-FDG PET/CT对大部分肿瘤均有较高诊断价值[3-5],亦可用于评价125I粒子植入术的治疗效果[6-8]。本研究建立兔VX2肺癌模型,采用18F-FDG PET/CT动态观察单纯125I粒子植入术及联合顺铂化疗的干预效果。
1 材料与方法
1.1 实验动物及材料 新西兰大耳白兔30只(清洁级),雌雄不限,月龄3~4个月,体质量2~3 kg,由山西海斯制药厂提供。18F-FDG由山西省晋城大医院核医学科生产,放射化学纯度>95%。125I粒子购自天津赛德公司,放射性活度为25.9 MBq(0.7 mCi),直径0.8 mm,长4.5 mm,半衰期59.6天。顺铂购自哈尔滨誉衡齐鲁制药有限公司。VX2肿瘤瘤块购自北京标准物资公司。
1.2 制备动物模型及分组干预 将预先制备的荷瘤兔VX2肿瘤组织剪成1 mm3组织块,以生理盐水重悬后注射入30只3~4月龄实验兔右肺下叶;14天后PET/CT示右肺下叶形成最大径1~2 cm结节,制备兔VX2肺癌模型成功。
将30只肿瘤兔随机分3组,每组10只。对A组依据PET/CT所示右肺病灶情况,以治疗计划系统(treatment plan system, TPS)确定治疗靶区及其他正常区域所需要剂量后,于CT引导下采用粒子植入器植入25.9 MBq(0.7 mCi)125I粒子。对B组经耳缘静脉注射顺铂(7 mg/kg体质量);C组予以上2种干预。实验过程完全遵守晋城大医院医学伦理委员会相关规定。
1.3 仪器与方法 分别于治疗前及治疗后第3、7、14天,采用Siemens Biography 52环大孔径PET/CT扫描仪对实验兔行全身PET/CT扫描。检查前实验兔停饲、禁饮6 h,予肌肉注射速眠新(0.3 ml/kg体质量)后保定于检查床,如检查期间动物清醒,则腹腔注射5%戊巴比妥钠。经耳缘静脉注射18F-FDG(18.5 MBq/kg体质量),并于40~60 min后采集全身图像。PET:3D模式,层厚3.75 mm,矩阵128×128,每个床位采集4 min;CT:管电压120 kV,管电流200 mA,转速0.8 s/rot,床速22.5 mm/s,矩阵512×512。不同时间点PET/CT扫描参数一致。
1.4 图像分析 对PET图像行衰减校正处理后,于Xeleris工作站进行图像融合;以工作站自带Elipsoid Isocontour 3D测量软件分别于右肺肿瘤部位及肝右叶勾画直径2 cm圆形ROI,测量其最大标准摄取值(maximum standard uptake value, SUVmax),计算肿瘤SUVmax/肝脏SUVmax(SUVT/L)。
1.5 病理学观察 于各时间点PET/CT检查后经耳缘静脉注射空气处死动物,取出双肺组织测量肿瘤最大径,置于10%甲醛中固定,常规切片后行HE染色,观察病灶组织形态学变化。
1.6 统计学分析 采用SPSS 13.0统计分析软件。以±s表示计量资料,多组间比较采用方差分析,两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
3组间及A、B组内治疗前及治疗后不同时间点肿瘤最大径差异均无统计学意义(P均>0.05),见表1。治疗后第14天,C组肿瘤最大径较治疗前缩小(P<0.05)。治疗后第7、14天,C组SUVT/L值均较A、B组降低(P均<0.05);A、B组SUVT/L值较治疗前降低。C组治疗后第3、7、14天SUVT/L值均较治疗前降低(P均<0.05)。见图1及表2。
表2 3组实验兔不同时间点SUVT/L值比较(±s)

表2 3组实验兔不同时间点SUVT/L值比较(±s)
组别SUVT/L治疗前(n=10)治疗后第3天(n=8)治疗后第7天(n=6)治疗后第14天(n=4)F值P值A组8.97±1.326.07±0.364.08±0.72$2.17±0.77$2.780.10B组8.32±1.047.32±0.585.07±1.04$2.82±1.34$2.690.10C组7.97±1.455.96±1.36$3.82±1.28*#$1.72±0.96*#$4.680.02F值2.212.294.264.79——P值0.140.140.020.01——
注:*:与同时间点A组比较,P<0.05;#:与同时间点B组比较,P<0.05;¥:与同组治疗前比较,P<0.05
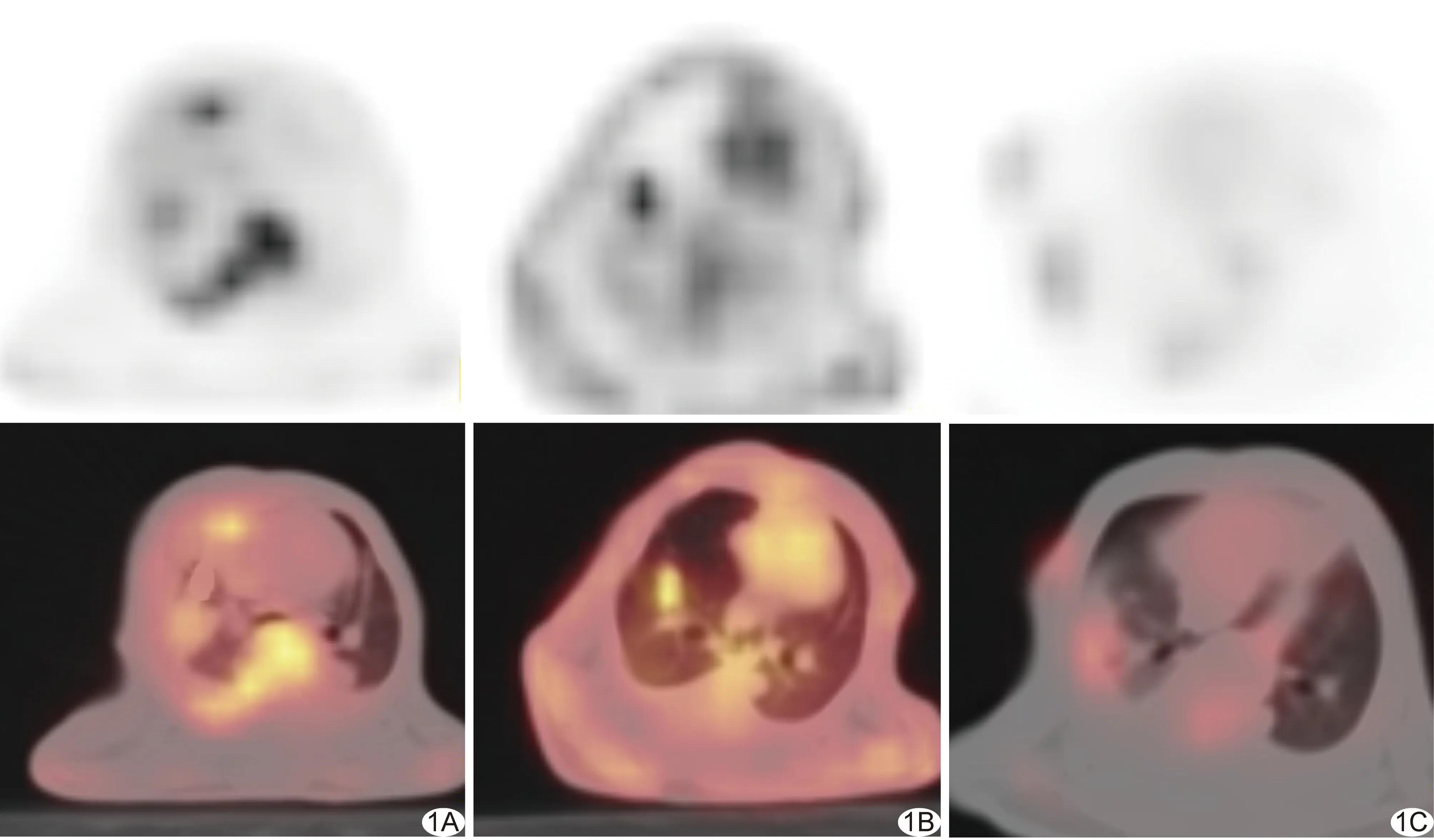
图1 治疗后第14天最大密度投影(maximum intensity projection, MIP)图及PET/CT融合图 A.上下图分别为A组MIP图及PET/CT融合图,SUVT/L=2.07; B.上下图分别为B组MIP图及PET/CT融合图,SUVT/L=3.20; C.上下图分别为C组MIP图及PET/CT融合图,SUVT/L=0.47
表1 3组实验兔不同时间点肿瘤最大径比较(mm,±s)
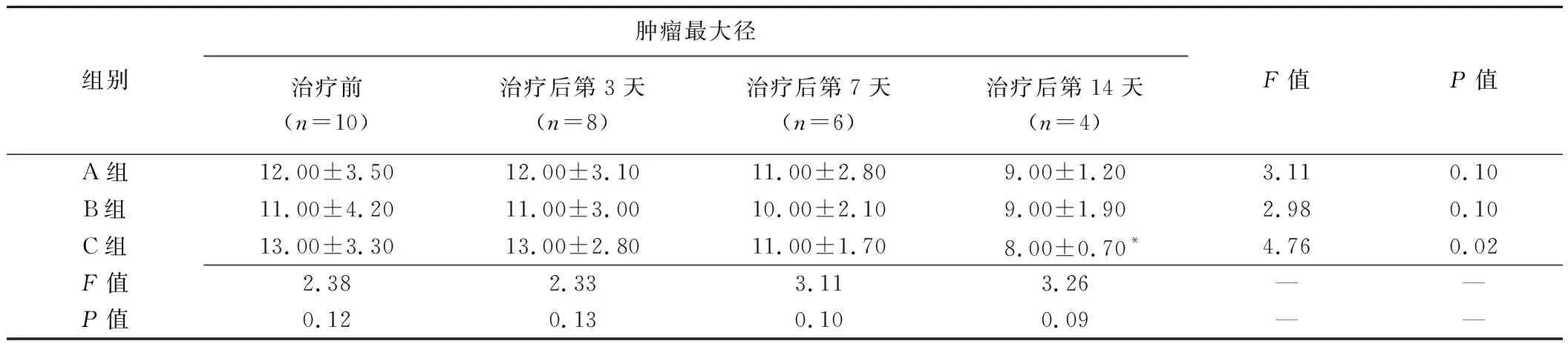
表1 3组实验兔不同时间点肿瘤最大径比较(mm,±s)
组别肿瘤最大径治疗前(n=10)治疗后第3天(n=8)治疗后第7天(n=6)治疗后第14天(n=4)F值P值A组12.00±3.5012.00±3.1011.00±2.809.00±1.203.110.10B组11.00±4.2011.00±3.0010.00±2.109.00±1.902.980.10C组13.00±3.3013.00±2.8011.00±1.708.00±0.70*4.760.02F值2.382.333.113.26——P值0.120.130.100.09——
注:*:与同组治疗前比较,>P<0.05
3组治疗后肿瘤细胞均逐渐减少。治疗后第3天,C组肿瘤细胞较A、B组减少,并见较多炎症细胞;治疗后第7天,A、C组肿瘤细胞较B组减少,并见更多炎症细胞,且C组较A组更显著;治疗后第14天,C组仅见少量肿瘤细胞,炎症细胞及纤维组织进一步增加。见图2。
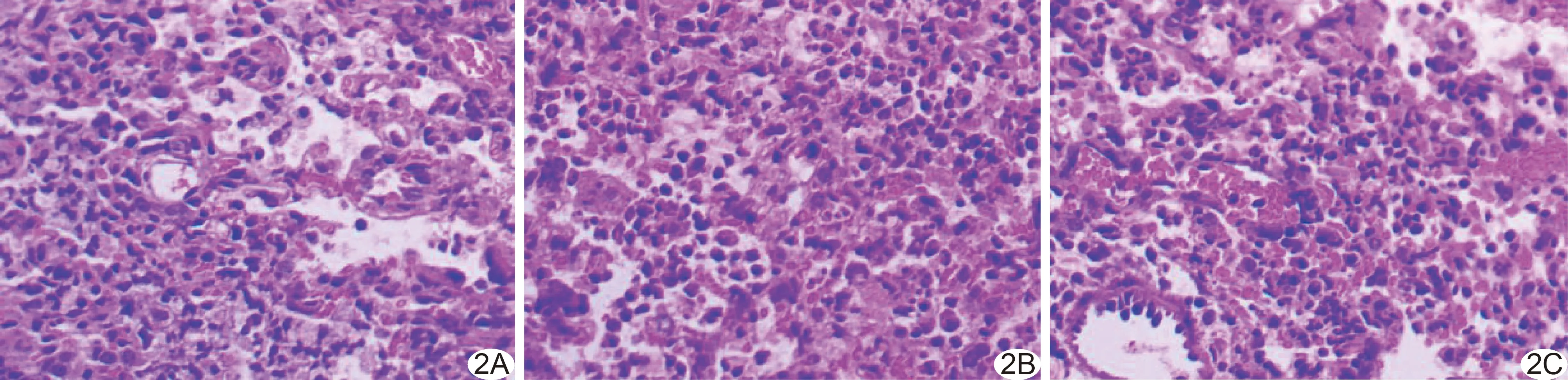
图2 治疗后第14天肺癌组织病理图(HE,×200) A~C.分别为A~C组,C组肿瘤细胞及血管生成均相比A、B组减少,炎症细胞较A、B组增多
3 讨论
VX2瘤株属于鳞癌类型,对放疗敏感。新西兰大耳白兔性格温顺,疗效评价结果接近人体,且便于实验操作[9]。18F-FDG PET/CT用于肿瘤主要包括鉴别诊断良、恶性肿块和恶性肿瘤的临床分期及再分期等。本研究将VX2肿瘤组织接种于3~4月龄新西兰大耳白兔右肺下叶,成功制备30只兔VX2肺癌模型,观察18F-FDG PET/CT动态观察单纯125I粒子植入术及联合化疗对兔VX2肺癌的干预效果的价值
王莹等[10]报道,以肝脏作为非病灶本底计算靶病灶SUVmax/肝脏SUVmax可用于鉴别肺部良恶性结节,且准确性较高。LEE等[11]提出以肿瘤SUVmax/肝脏SUVmax作为定量指标,对评估胃癌术后复发及有无淋巴结转移具有较高价值。潘栋辉等[12]认为32P-磷酸铬-聚-L-乳酸粒子可显著抑制兔VX2肺肿瘤糖代谢,促进肿瘤细胞凋亡,且肿瘤SUVT/L代谢情况与粒子剂量存在效应关系,不同时间窗内SUVT/L值与肿瘤治疗效果密切相关。
本研究结果显示,联合治疗后第7、14天,C组SUVT/L值均较A、B组降低,且治疗后第14天C组肿瘤最大径较治疗前缩小,病理仅见少量肿瘤细胞而炎症细胞及纤维组织增多,提示联合治疗较单纯治疗效果更佳。联合治疗后第3、7、14天SUVT/L值均较治疗前降低,而A、B组治疗后第7、14天SUVT/L值与治疗前差异有统计学意义,表明联合治疗方案见效更快。单纯粒子植入术后第3、7、14天SUVT/L值均较单纯化疗后略低,且病理结果显示单纯粒子植入术后第7、14天较单纯化疗后炎症细胞更多,提示125I粒子植入术对于肿瘤局部的治疗效果优于单纯化疗,原因可能在于125I粒子的放射性激活炎症反应诱导炎症介质分泌,促进F-FDG代谢而致SUVT/L值增高[13-14];但单纯粒子植入术及单纯化疗后第3、7、14天SUVT/L值差异均无统计学意义,可能与样本量少有关。
综上,18F-FDG PET/CT以肝脏为非靶病灶计算SUVT/L值可动态观察不同治疗方案对兔VX2肺癌的干预效果;125I粒子植入术联合顺铂化疗后第3天即可以此方法观察疗效。但本研究样本量少、观察时间点有限,有待进一步完善。

