左心耳封堵术后影响封堵器不完全内皮化的危险因素
苏 蕾,吴 阳,陈各才,杨桂荣,王中阳
(1.大连医科大学研究生院,辽宁 大连 116000;2.泰州市人民医院超声科,3.心内科,江苏 泰州 225300)
心房颤动(atrial fibrillation, AF)属常见心律失常,脑卒中为其最严重并发症之一,致残率和致死率极高,故AF患者需常规口服抗凝药物(oral anticoagulants, OAC)以预防血栓形成。左心耳封堵术(left atrial appendage occlusion, LAAO)现已成为预防存在出血性并发症或服药依从性差的AF患者发生脑卒中的方法,其临床有效性及安全性已获证实[1-2],但仍存在心包积液、空气栓塞、封堵器移位或栓塞及器械表面血栓形成(device-related thrombosis, DRT)等并发症[3]。DRT与LAAO术后系统性栓塞事件有关,是AF患者长期预后的影响因素[4-5]。完全内皮化之前,封堵器表面易形成血栓,尤其是伞端等存在金属螺钉处[1]。本研究分析LAAO治疗AF术后封堵器不完全内皮化的影响因素。
1 资料与方法
1.1 一般资料 回顾性分析2019年7月—2021年11月53例于泰州市人民医院接受LAAO的AF患者,男29例,女24例,年龄47~84岁,平均年龄(67.8±8.7)岁。纳入标准:①接受LAAO,植入Watchman封堵器;②释放封堵器后,即刻经食管超声心动图(transesophageal echocardiography, TEE)未发现>5 mm的残余分流。排除标准:①不能配合治疗或失访;②随访期间发生封堵器脱落;③存在严重肾功能不全。检查前患者均签署知情同意书。
1.2 经胸超声心动图检查 采用Philips Epiq 7C超声诊断仪、X5-1探头(1.0~5.0 MHz),常规检测左心房内径(left atrium diameter, LAD)及左心室射血分数(left ventricular ejection fraction, LVEF);以彩色多普勒技术观察是否存在二尖瓣反流(mitral regurgitation, MR),若存在则以半定量方法(反流束长度、宽度、面积)综合评估MR程度,定义反流束长度超过左心房上下径1/3为轻度及以上MR。
1.3 LAAO方法 采用Philips Epiq 7C超声诊断仪,2.0~7.0 MHz经食管探头X7-2t; Siemens Artist Q ceiling 数字减影血管造影(digital subiraction angiography, DSA) 机。嘱患者平卧于手术台,行全身麻醉后,在TEE及DSA引导下,将Watchman封堵器送至左心耳(left atrial appendage, LAA),满足释放标准(位置、稳定性、压缩比和密封性)后释放,并即刻应用TEE观察、记录有无残余分流(图1)。
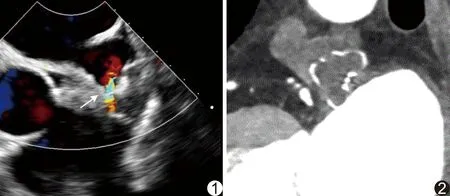
图1 AF患者,女,65岁,LAAO术后即刻TEE显示LAA残余分流(箭) 图2 AF患者,女,56岁, LAAO术后3个月,双源CT MPR图示LAA内无对比剂进入,封堵器完全内皮化
1.4 术后随访 术后随即开始OAC治疗。于术后3个月行双源CT检查,采用Siemens Somatom Force 128层双源CT机,以前瞻性心电触发序列进行扫描,全自动实时调控射线剂量,30%~80% R-R间期曝光。采用双筒高压注射器以5.0 ml/s流率注入对比剂碘普罗胺(370 mgI/ml)60~80 ml后行增强扫描,范围自气管隆嵴下1 cm至心脏膈面。以CT多平面重建(multiplanar reconstruction, MPR)技术评估封堵器是否完全内皮化,以LAA腔内CT值≤心肌CT值为完全内皮化(图2);LAA内有对比剂进入、腔内CT值>心肌CT值为不完全内皮化[6-7](图3A);以MPR图像所示封堵器与LAA壁之间存在间隙为器械周围漏(peri-device leak, PDL),封堵器心房面见低密度充盈缺损时诊断为DRT(图3B)。
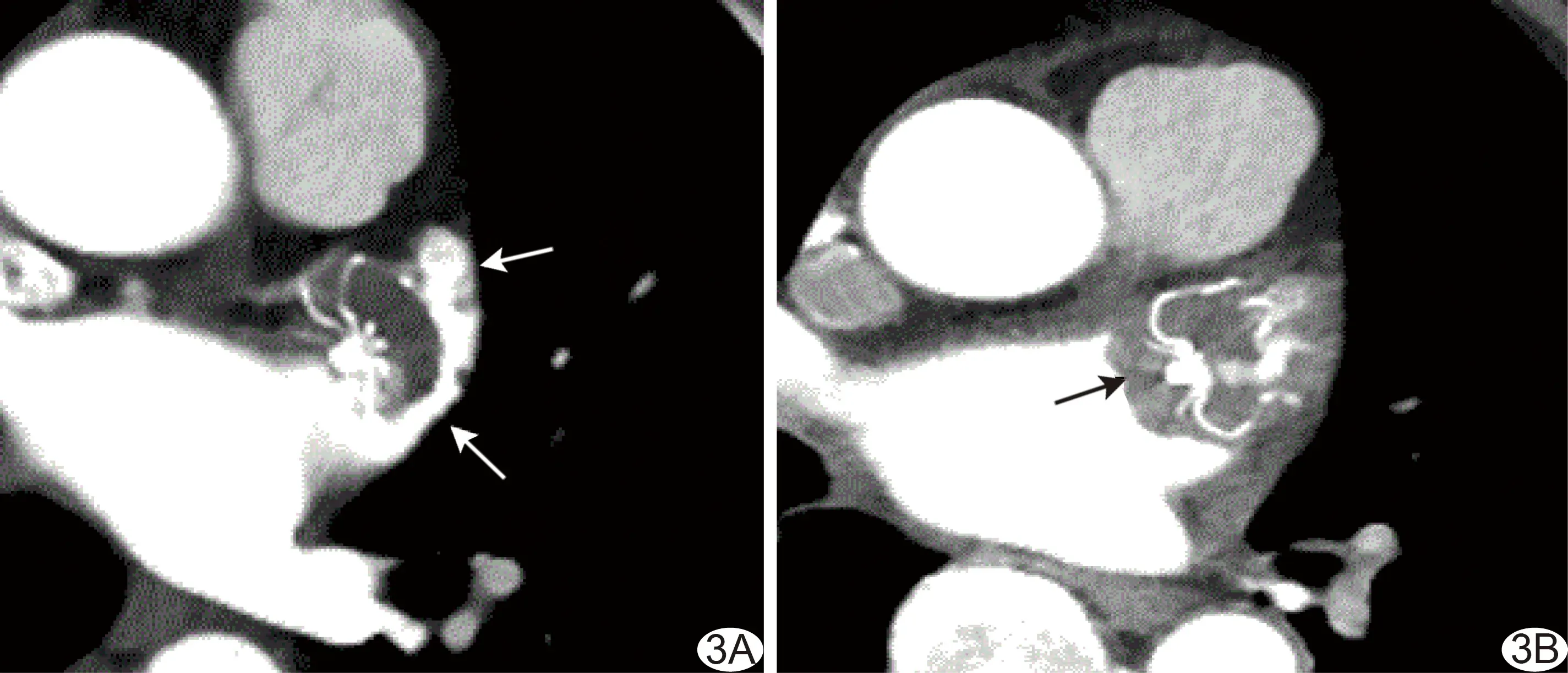
图3 AF患者,男,70岁,LAAO术后3个月,封堵器不完全内皮化 A、B.双源CT MPR图示封堵器与LAA壁之间存在PDL(A,箭),封堵器心房面见低密度充盈缺损,即DRT(B,箭)
1.5 统计学分析 采用SPSS 26.0统计分析软件。以±s表示符合正态分布的计量资料,组间比较采用独立样本t检验;以中位数(上下四分位数)表示不符合正态分布的计量资料,组间比较采用Mann-WhitneyU检验。以χ2检验或Fisher精确概率检验比较组间计数资料。采用二元logistic回归分析检验独立危险因素。P<0.05为差异有统计学意义。
2 结果
术后随访77~134天,中位随访时间100天。术后3个月,CT评估不完全内皮化32例(不完全组),其中16例PDL≤5 mm,无PDL>5 mm者,2例见DRT;21例完全内皮化(完全组)。组间患者性别、年龄、体质量指数(body mass index, BMI)、AF房颤类型、AF栓塞风险CHA2DS2-VASc评分、AF出血风险HAS-BLED评分等指标差异均无统计学意义(P均>0.05),LVEF及MR差异有统计学意义(P均<0.05),见表1。
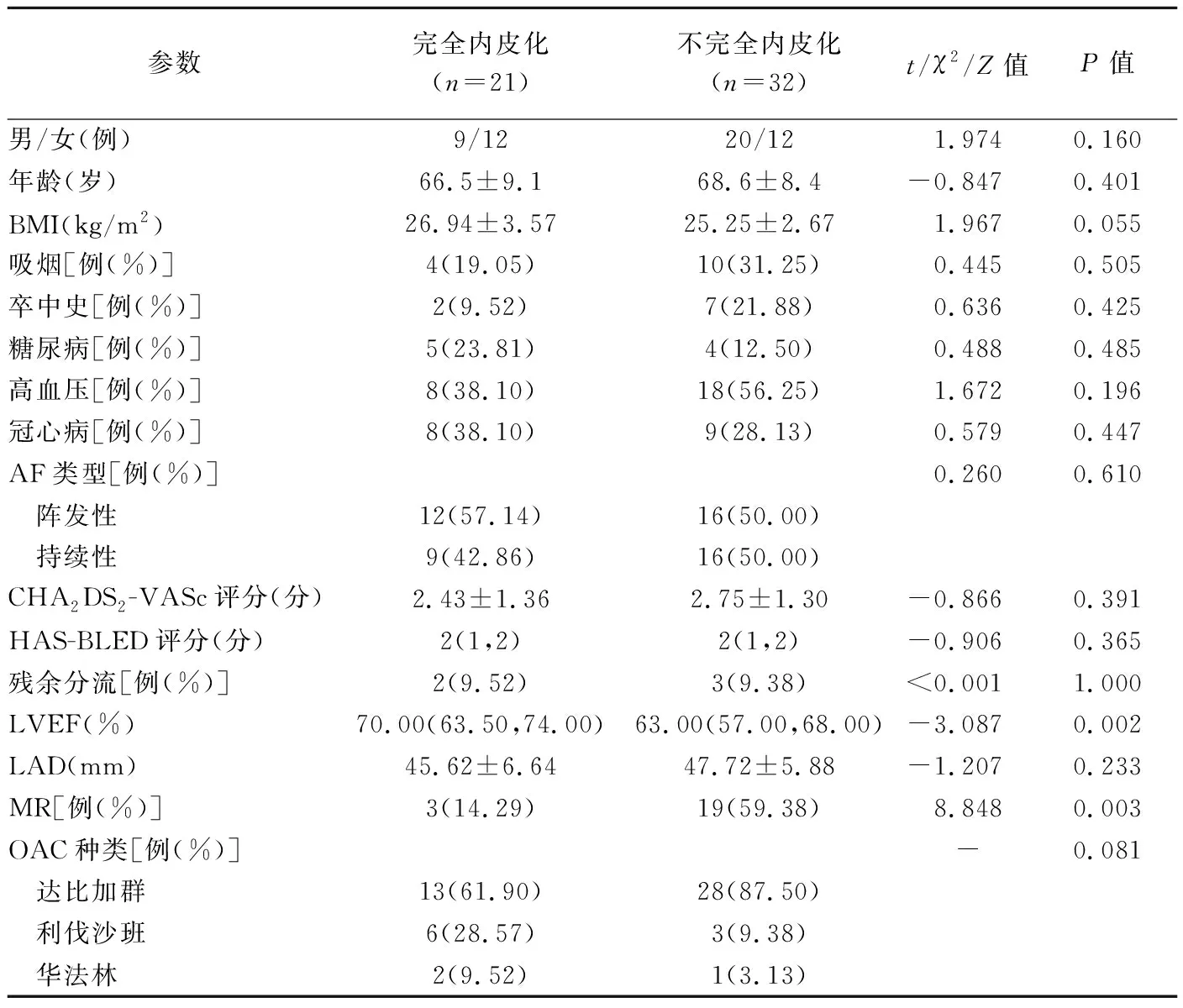
表1 LAAO术后3个月封堵器完全内皮化与不完全内皮化AF患者相关资料比较
以LVEF及MR为自变量、完全内皮化与否为因变量行logistic回归分析,结果显示LVEF和MR为影响封堵器不完全内皮化的独立影响因素(P均<0.05),见表2。
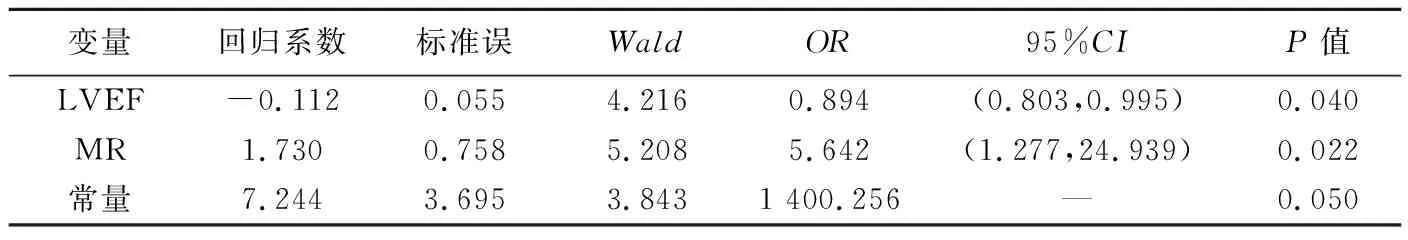
表2 LAAO术后影响封堵器不完全内皮化因素的logistic回归分析
3 讨论
AF患者LAAO术后DRT发生率为3%~7%[8-10]。既往研究[5,8,11]认为年龄、脑卒中病史及低射血分数均与DRT形成有关,封堵器不完全内皮化亦与DRT形成有关。SINANIS等[12]报道1例接受LAAO的AF患者随访发现因内皮化不全而出现DRT。动物实验[13]结果表明,植入封堵器后45天~3个月,内皮组织可完全覆盖封堵器表面;故对LAAO术后AF患者常规予OAC至少45天,以使封堵器完成内皮化。
Watchman封堵器是一种伞状“瓶塞式”植入装置,具有自膨式镍铬合金框架结构,配备10个固定锚和1个由聚乙烯对苯二酸盐材料合成的帽状膜样结构[14]。上皮细胞通过黏附、移行及增殖而在封堵器表面生长,覆盖封堵器而实现内皮化。封堵器完全内皮化具有以下功能:①避免封堵器与血流直接接触,使血流平稳,减少不良刺激,有效防止血栓形成;②血流无法穿过封堵器帽状膜样结构;③减少封堵器与室壁相互摩擦而引起的纤维组织增生;④提高封堵器稳定性,避免金属耐疲劳性减弱而发生移位。本研究中16例术后随访发现存在PDL(均≤5 mm),其中13例术中释放封堵器后即时TEE未见明显残余分流,术后随访发现PDL,可能原因在于封堵器未完全内皮化而在释放后发生移位。
本研究结果显示,MR是封堵器不完全内皮化的独立危险因素,轻度及以上MR导致内皮化不完全。高速反流使封堵器附近血流加速有助于减少血栓形成,但不完全内皮化致封堵器外露可能是停用OAC后DRT的主要原因。维持植入装置附近低剪切力环境有益于促进内皮化[15]。研究[16]表明,植入冠状动脉支架后,支架附近高速血流产生的剪切力影响细胞黏附且损伤血管内皮细胞,使术后支架内皮化不完全而致再狭窄。MR引起的湍流和冲击力亦可阻碍内皮细胞覆盖,造成内皮化不全;轻度以下MR的反流束对封堵器周围血流状态的影响较小,故对内皮化无明显影响,而轻度以上MR可阻碍封堵器正常内皮化过程。
此外,本研究发现LVEF影响封堵器不完全内皮化,低LVEF可能抑制完全内皮化。VITTORIO等[17]的研究结果表明,LVEF与血管内皮功能高度相关,且左心室功能不全可能对内皮功能产生负面影响;可能原因在于LVEF影响血管内皮生长因子水平,低LVEF使外周血管壁剪切力下降,从而降低一氧化氮的生物利用度,导致血清中血管内皮生长因子水平降低、内皮功能减弱,故低LVEF患者更易出现不完全内皮化。
本研究的不足之处:目前尚无明确标准用于判断Watchman内皮化程度,本研究仅依据影像学表现评估内皮化程度,缺乏病理学证据的支持;采用经胸超声心动图评估心功能可能与实际情况存在一定误差;样本量小,且均来自单中心,有待进一步完善。
综上,AF患者LAAO后封堵器内皮化与MR程度及LVEF有关;对轻度及以上MR及低LVEF患者应谨慎选择诊治方案。

