脑卒中患者早期肠内营养喂养不耐受风险预测模型的构建及验证
刘桂英 张艳艳 郭红 杨冬梅
(北京中医药大学东方医院脑外科,北京 100078)
脑卒中患者因昏迷或吞咽困难不能进食,肠内营养(Enteral nutrition,EN)为患者提供早期合理营养支持[1-2],肠内营养过程中会出现喂养不耐受(Feeding intolerance,FI)症状,尤其在EN早期发生率最高,严重影响神经疾病患者的营养供应,导致喂养困难和能量摄入不足。现今,临床预测模型是一种通过预测结果风险,制定医疗决策和改善健康结果的研究方法[3],已在当代临床护理中发挥着越来越重要的作用。因此,本研究按照全面、易测、可干预的原则,分析与之最相关的危险因素,进而构建脑卒中患者EN早期FI风险预测模型,以便早期筛查有最大风险的患者,为及时改变治疗、护理策略保障患者的营养,从而为降低FI受发生率提供依据。
1 对象与方法
1.1研究对象 选取我院脑病科2017年1月—2019年12月收治的206例脑卒中患者。纳入标准:(1)诊断标准符合全国第四届脑血管学术会议修订版,并经头颅 CT 及 MRI证实的脑出血、脑梗死、蛛网膜下腔出血患者。(2)首次置入鼻胃管并成功实施肠内喂养的患者。排除标准:(1)重复住院病例。(2)住院时间<5 d。(3)鼻饲时间<3 d。(4)既往有胃肠道疾病或胃肠道手术者。
1.2方法
1.2.1调查工具 使用文献回顾和Meta分析设计的病历资料报告表,包括:(1)高龄。(2)疾病因素:高APACHEⅡ评分、低格拉斯哥昏迷指数(Glasgow coma scale,GCS)评分、高NIHSS评分、肠鸣音减弱、体温高。(3)治疗因素:口服钾制剂、抗生素种类、儿茶酚胺药物、抑酸剂、镇静镇痛药、机械通气、是否手术、亚低温治疗。(4)生化指标:高血糖、血清白蛋白、低血钾。(5)营养液因素:营养液类型、日用总量、开始喂养时间、喂养方式。
1.2.2资料收集方法 经本科室人员同意,通过电子病历系统回顾性收集患者临床资料,包括医嘱单、检查化验单、病程记录、护理记录、体温单等文件,记录患者肠内营养开始7d内胃肠道情况、疾病、治疗、化验检查指标、生命体征、营养状况等数据,所有数据都记录在病例报告表中并得到了2名研究人员的确认和记录。
喂养不耐受的评定标准:根据2012年欧洲重症医学学会建议在FI的定义并结合临床实际情况,本研究确定FI的评定标准[4]:(1)胃肠道症状和体征,包括呕吐,腹胀,腹泻,便秘,肠鸣音减弱或消失。(2)肠内营养因各种原因如消化性溃疡而中断。(3)每6h抽取胃残余量(Gastric residual volume,GRV),GRV≥500 ml/24 h。本研究确定凡出现以上任何一项者即判定为发生FI。
胃肠道症状判断标准[4-5],(1)腹泻:每天3次以上稀水样便,数量>200~250 g/d(或>250 mL/d)。(2)腹胀:患者有腹部膨隆,腹肌紧张表现,叩诊为鼓音,X线显示肠道内气体或液体积聚迹象。(3)呕吐/返流:是指任何可见的胃内容物反流的发生,而不管其数量如何。(4)肠鸣音减弱或消失:医生听诊,肠鸣音≤3次/min。(5)消化道出血:任何出血到胃肠道,并通过呕吐物,胃液或粪便等,由胃液潜血实验确认。(6)便秘:无便秘史,肠内营养后出现≥3d未行大便,需人工或药物辅助排便。
1.3质量控制方法 成立课题研究小组,由课题负责人1人、学校教授1人、研究生2人,小组成员统一培训,所有数据都记录在病例资料报告表中并得到2名研究人员的确认,每周进行例会汇报收集资料情况进行汇报总结,对存在的问题进行讨论分析,针对原因提出改进措施,不断调整使病例资料数据全面、客观、准确。
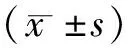
2 结果
2.1病例资料基本信息 本次研究共收集206例患者,其中男108例,女98例,平均年龄(76.22 ± 11.94)岁。喂养耐受患者76例,男35例,女41例,平均年龄(73.0 ± 13.9)岁;发生FI患者130例,男73例,女57例,平均年龄(78.1±10.2)岁,发生率为63.1%。脑出血患者77例,其中包括蛛网膜下腔出血12例。脑梗死患者129例,其中急性脑梗死124例。出现FI的患者中消化性溃疡53例、呕吐33例、腹胀11例、便秘72例、腹泻14例、高GRV 6例。
2.2脑卒中患者早期肠内营养喂养不耐受危险因素分析
2.2.1患者肠内营养耐受情况的单因素比较 经分析发现:年龄≥75岁、GCS评分3~5分、体温≥38.5°C、NIHSS评分≥5分、亚低温治疗、机械通气、使用抑酸剂、抗生素种类≥2类在喂养耐受与不耐受组存在明显差异(P<0.05),见表1。
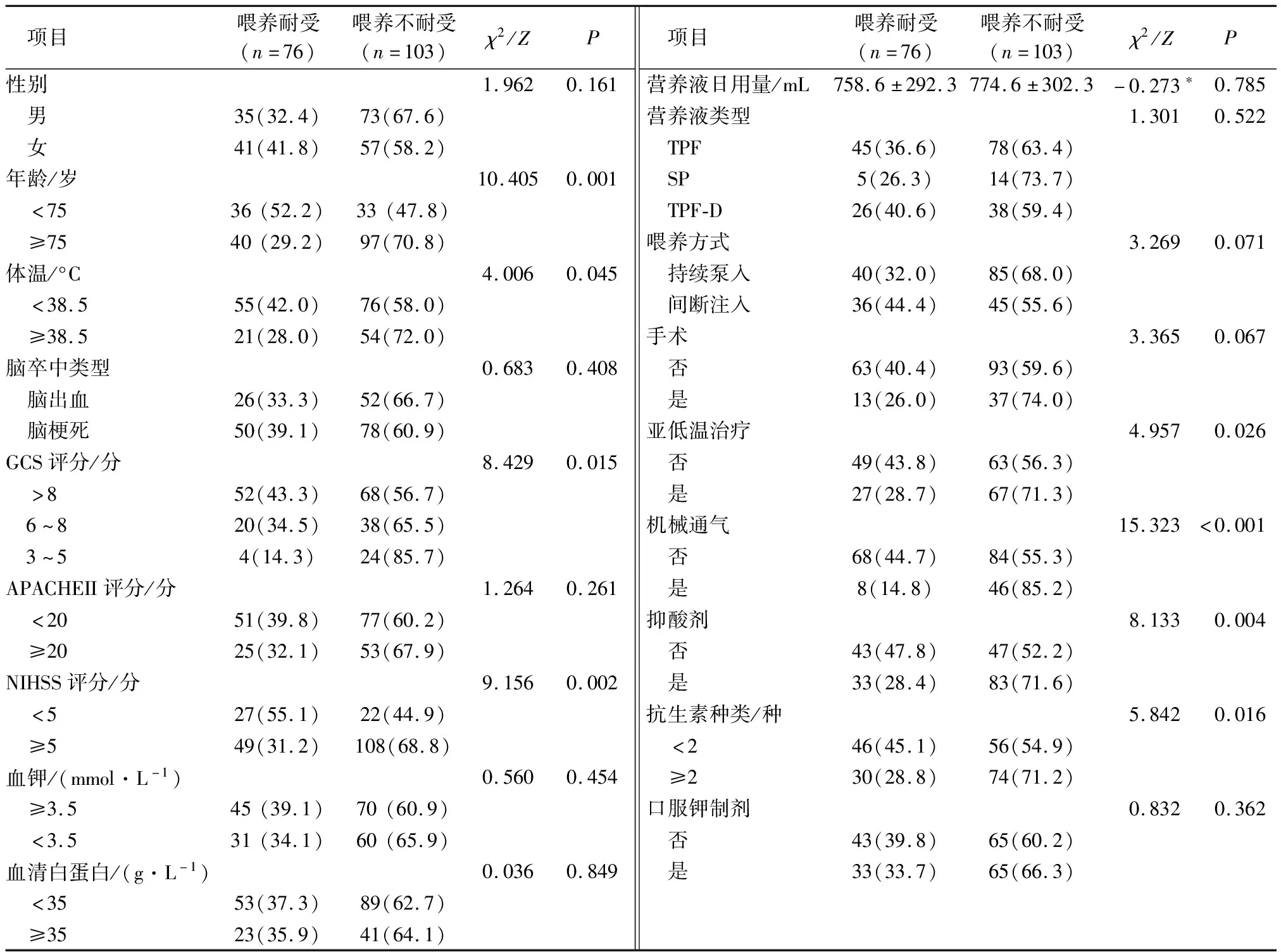
表1 患者肠内营养耐受情况的单因素比较 例(%)
2.2.2logistic回归分析 将以上单因素分析中有统计学差异的项目作为自变量纳入多因素分析,采用二元logistic回归(向前LR法),赋值情况见表2,分析结果见表3。

表2 自变量赋值
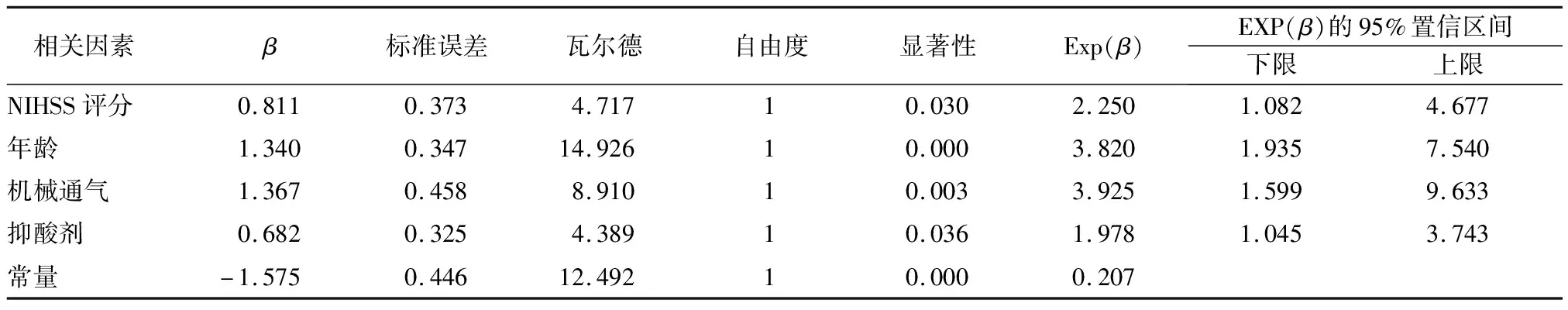
表3 喂养不耐受的logistic回归分析
3 FI风险预测模型的构建及验证
3.1FI风险预测模型的构建 logistic回归分析确定抑酸剂(X1),机械通气(X2),年龄(X3),NIHSS评分(X4),以logistic回归模型为基础,建立脑卒中EN早期FI风险预测模型:
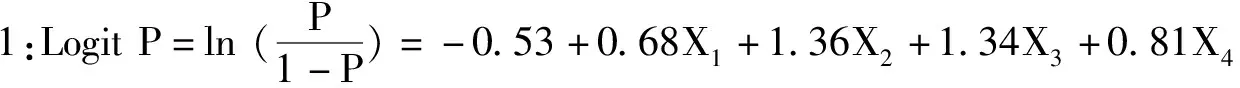
由此,得出预测概率方程:
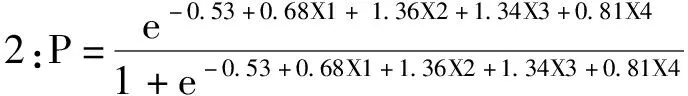
3.2FI风险预测模型的验证 因本研究为回顾性研究且研究时间有限,故预测模型的预测效能验证采用内部验证技术。即开发样本(如原始数据集的2/3)和验证样本[6]。通过2020年1-8月收集的94例脑卒中患者进行模型验证,男53例,女41例,年龄32~96岁,平均年龄(76.13±12.77)岁。按照评分系统算得的联合预测因子P,现对预测模型预测效能进行ROC受试者曲线内部验证,结果:AUC=77.3 %,P<0.001,说明诊断价值较高,具有显著的意义,且临界值为≤0分,此时敏感度为79.31%,特异性为64.29 %,见表4和图1。不同诊断区间的灵敏度和特异度的分界点为预测因子>0.88时,敏感度为79.31,特异度为64.29,见表5。

表4 联合预测因子的ROC曲线
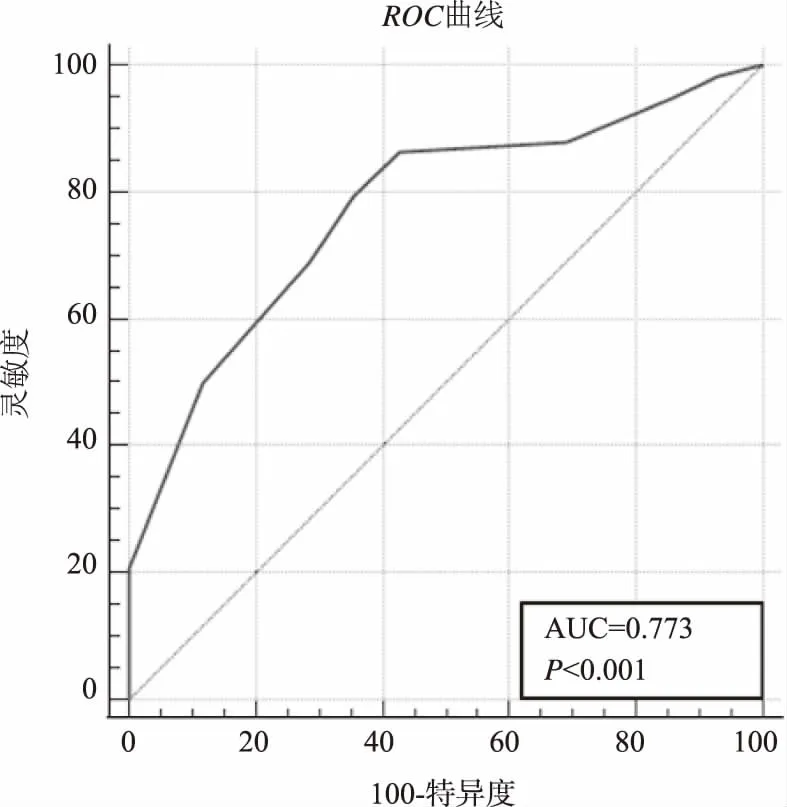
图1 脑卒中EN患者FI风险预测值ROC曲线
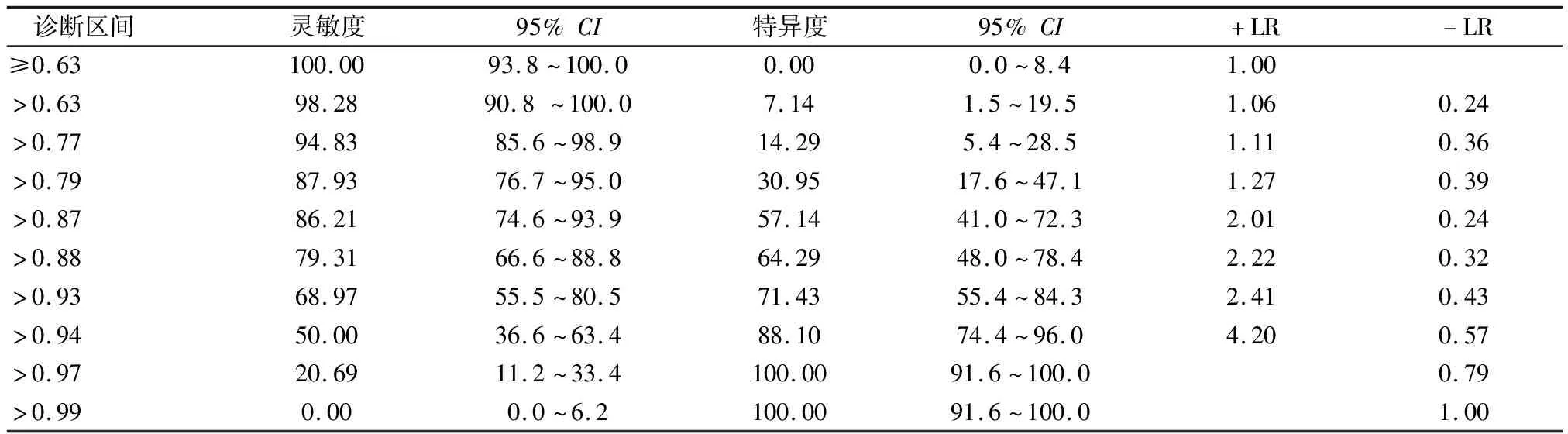
表5 不同诊断区间的灵敏度和特异度
4 讨论
4.1脑卒中患者EN早期FI风险预测模型具有较高的实用价值 本研究结果显示:此预测模型灵敏度、特异度均>60%,AUC>0.7,说明此预测模型预测效能较好,可有效预测脑卒中EN早期FI的风险。适用于脑卒中EN早期FI风险预测,筛选高危患者方面具有较高的敏感度与特异性,可提高高危患者的诊出率。且此模型为临床护士用来筛选脑卒中患者EN早期FI的高危人群,各指标客观且较容易监测,为护士的下一步预防干预提供参考依据,同时模型简单,易掌握,方便护士临床使用不增加工作量,较易在临床实施并推广。
4.2脑卒中患者EN早期FI风险预测模型的危险因素分析
4.2.1高龄 本研究显示:年龄≥75对于FI的发生有统计学意义(P<0.05),FI的症状表现以便秘居多,这可能跟患者的年龄有关,因为随着年龄的增长,肠道功能出现老化现象,生理功能处于逐渐衰退状态,表现为排便不畅,便秘、腹泻、胃肠道消化及吸收能力下降等[7]。
4.2.2机械通气 机械通气被认为是导致腹内压升高的一个易感因素[8]。腹内高压可引起黏膜萎缩和消化液分泌减少,进而导致胃肠腔内营养缺乏,消化吸收功能障碍,加重全身各脏器、系统功能障碍,造成胃肠内营养难以顺利实施。本研究中有54例机械通气患者,46例发生了FI,其中消化性溃疡25例(46.3%),呕吐18例(36.7%),便秘28例(51.9%)。这可能与使用呼吸机PEEP的设置引起腹内压增高有关,同时使用机械通气患者的疾病严重程度也相对较高。
4.2.3抑酸剂 本研究结果显示:喂养不耐受组使用抑酸剂的患者有83例(63.8%),耐受组中使用抑酸剂的患者为33例(43.8%)。在临床中广泛应用的抑酸药有质子泵抑制剂(Proton pump inhibitors,PPI)和H2受体阻滞剂(Histamine-2-receptor antagonists,H2RA),其中PPI的使用率是70%[9]。抑酸剂的使用虽然能够减少应激性溃疡的发生,但也会带有一系列的副作用,如感染相关的并发症,这与抑酸治疗可能会导致细菌过度生长、胃排空延迟、细菌易位、黏液黏度降低以及正常胃肠道菌群的变化有关[10]。临床中急性脑出血、急性脑梗死患者常使用抑酸剂来预防应激性溃疡的发生,一项纳入50项临床研究的Meta分析[11]显示:应用抑酸剂可显著增加住院病人发生艰难梭菌感染风险,继而引起腹泻。近期相关综述[12]表明,抑酸剂的应用还可能增加患者发生肺炎及胃肠道感染等概率。
4.2.4NIHSS评分 美国国立卫生研究院卒中量表(NIH stroke scale,NIHSS)是脑卒中患者专业评估工具,NIHSS评分能够反映患者神经功能缺损的程度,能够综合评估患者吞咽功能、语言功能和活动功能,从而判断患者的生活自理能力,0~4分为轻度神经受损,≥5分为中到重度受损,最高为42分。在一项针对肠管喂养与非肠管喂养的脑卒中患者的研究[13]显示,肠管喂养组和非肠管喂养组的NIHSS评分分别为(10.78 ± 6.75)分和(2.39 ± 2.56)分,且意识水平反应性是与使用肠内管喂食最密切相关的因素。如果重症脑卒中致使丘脑、脑干结构受累,不但意识障碍程度深,中枢植物神经受到抑制,胃肠运动受抑制,胃肠蠕动及排空减慢,从而FI的发生率明显增加[14]。
4.3不足 本研究构建危重症患者EN早期FI风险预测模型,通过内部验证结果表明该模型的预测效能较高。但本研究样本的局限性在于仅选取北京市某三甲医院神经内科和神经外科,推广性不够,且还可能存在遗漏未包含的的FI危险因素,今后还需囊括更多的危重症患者FI危险因素开展多中心、大样本研究。

