氧和血红蛋白诱导的神经元毒性及机制
陈 琪 陈 鑫 柴建薇 张 伟 黄 煜 付晓艳
1.山东第一医科大学(山东省医学科学院)公共卫生学院,山东 泰安 271016;2.山东第一医科大学(山东省医学科学院)基础医学院,山东 泰安 271000
脑出血是以脑动脉瘤为主要诱因的脑血管病,其发病率仅次于脑梗死,存活患者往往伴随神经功能缺损、再出血、脑积水、认知障碍等并发症,严重降低患者的生活质量,给社会和家庭带来沉重负担[1-3]。因此,脑出血的防治一直是基础医学和临床医学研究的世界性难题。脑出血后神经元凋亡的机制复杂,其中氧合血红蛋白(oxyhemoglobin,Oxy-Hb)的释放对神经元有潜在的神经毒性,可诱导神经元死亡,但机制仍不清楚。因此,评价Oxy-Hb 对神经元的毒性机制对脑出血后神经功能的恢复具有重要的研究意义。
1 材料与方法
1.1 材料
氧合血红蛋白、MTT 等化学试剂均购自Sigma公司;BCA 蛋白定量试剂盒、线粒体膜电位检测探针(JC-1)、超氧阴离子检测探针(DHE)、活性氧检测探针(DCFH-DA)均购自上海碧云天生物技术研究所;所有抗体均购自美国CST公司。
1.2 方法
1.2.1 原代神经元的分离和培养
选取SD 大鼠孕鼠,无菌条件下分离海马和皮层组织,经剪碎、胰酶消化和离心,以Neurobasal 培养基+B27 培养于多聚赖氨酸预包被的6 孔板;待神经元生长到第7天,显微镜观察形貌;tubulin免疫荧光染色,鉴定神经元的纯度。
1.2.2 神经元活性和形貌检测
神经元生长到第7 天,选生长状态良好的神经元接种96 孔板,预培养24 h;待神经元贴壁后,经2.5 ~ 80 μg/mL 的 Oxy-Hb 处 理 72 h;每 孔 加入20 μL浓度是5 mg/mL的MTT溶液,避光孵育5 h;去掉上清,加入每孔150 μL 的二甲基亚砜(dimethyl sulfoxide,DMSO),室温轻微震荡 30 min;酶标仪571 nm读取光吸收值。以对照组为100%计算神经元活性比例。Tubulin免疫荧光染色后,相差显微镜和荧光显微镜观察神经元的形貌变化。
1.2.3 神经元自由基检测
原代神经元培养7 天后,装载终浓度10 μM DCFH-DA探针,避光孵育30 min。神经元经PBS清洗 3 次,40 μg/mL 的 Oxy-Hb 处理 0 ~ 120 min,荧光显微镜观察神经元实时ROS产生情况(绿色荧光)。原代神经元培养7天后,装载终浓度10 μM DHE 探针,避光孵育30 min。神经元经PBS 清洗3 次,5 ~ 40 μg/mL的Oxy-Hb处理120 min,荧光显微镜观察神经元超氧阴离子的产生情况(红色荧光)。每个实验设置3个重复。
1.2.4 线粒体膜电位(MMP)检测
原代神经元培养7天后,装载终浓度10 μM JC-1探针,避光孵育30 min。神经元经PBS 清洗3 次,40 μg/mL的Oxy-Hb处理0 ~ 120 min,荧光显微镜观察神经元MMP 的变化。红色荧光向绿色荧光的转变可反映MMP的变化。每个实验设置3个重复。
1.3 统计学处理
所有实验至少重复3次,所有数据均以平均值±标准差表示,数据以SPSS 22.0 进行统计学分析。组间比较采用单因素方差分析(ANOVA),检验水准α=0.05。
2 结 果
2.1 Oxy-Hb剂量依赖性的诱导了神经元毒性
首先以MTT法检测神经元活性的变化。分离大鼠孕鼠海马神经元,体外培养3天,以2.5 ~80 μg/mL的Oxy-Hb处理神经元72 h,结果如图1所示,Oxy-Hb剂量依赖性的抑制了神经元的活性,表现为神经元活性的降低。例如,终浓度 20,40 和 80 μg/mL 的Oxy-Hb 处理神经元72 h,分别抑制了神经元活性34.4%,43.8%和68.7%。为进一步评价Oxy-Hb 诱导的神经元毒性,我们进一步观察了神经元形貌的变化。如图2所示,相差显微镜下正常神经元表现出明显的轴突和树突,神经纤维相互缠结成网络结构。Oxy-Hb处理后神经元轴突和树突明显减少,神经纤维变短,甚至消失。神经元标志物tubulin染色结果进一步证实了神经元形貌的变化。以上结果表明,Oxy-Hb体外具有显著的神经元毒性。

图1 Oxy-Hb剂量依赖性的抑制神经元的活性(“*”表示P <0.05 VS正常对照组,“**”表示P < 0.01 VS正常对照组)

图2 Oxy-Hb对神经元形貌的影响(Tubulin抗体标记,免疫荧光染色观察神经元形貌的变化)
2.2 Oxy-Hb剂量依赖性的诱导了神经元自由基的产生
过多的自由基可导致神经元损伤,是诱导神经元毒性的重要机制之一。因此,本研究以DCFH-DA和DHE两个探针检测了Oxy-Hb诱导的自由基的产生情况。如图 3A 所示,40 μg/mL 的 Oxy-Hb 处理神经元时间依赖性的诱导了总的活性氧自由基的产生,表现为绿色荧光的增强。而且,这种早在10 min 就检测到了自由基的产生,荧光信号逐渐从胞体向轴突延伸。此外,Oxy-Hb处理还诱导了超氧阴离子的产生。如图3B所示,5 ~ 40 μg/mL 的Oxy-Hb处理神经元120 min剂量依赖性的诱导了超氧阴离子的产生,表现为红色荧光的显著增强。以上结果表明,Oxy-Hb体外可时间依赖性和剂量依赖性的诱导神经元自由基的产生。
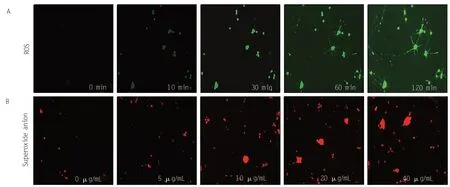
图3 Oxy-Hb时间依赖性诱导了自由基的产生(绿色荧光:神经元实时ROS;红色荧光:超氧阴离子)
2.3 Oxy-Hb剂量依赖性的诱导了线粒体膜电位的降低
线粒体膜电位的降低与自由基的产生和神经元凋亡密切相关,因此本研究以JC-1 探针检测了Oxy-Hb 处理后神经元膜电位的变化。JC-1 探针在正常线粒体基质中以聚合物形式存在发红色荧光;应激刺激下,线粒体膜电位降低,JC-1 探针以单体的形式存在细胞质中发绿色荧光。因此,红色荧光向绿色荧光的转变可用于反映线粒体膜电位的耗散。如图4所示,40 μg/mL的Oxy-Hb处理神经元时间依赖性的诱导了线粒体膜电位的降低,表现为红色荧光的降低和绿色荧光的升高,而且绿色荧光逐渐由胞体向轴突延伸。结果表明,Oxy-Hb体外可诱导线粒体膜电位的耗散。
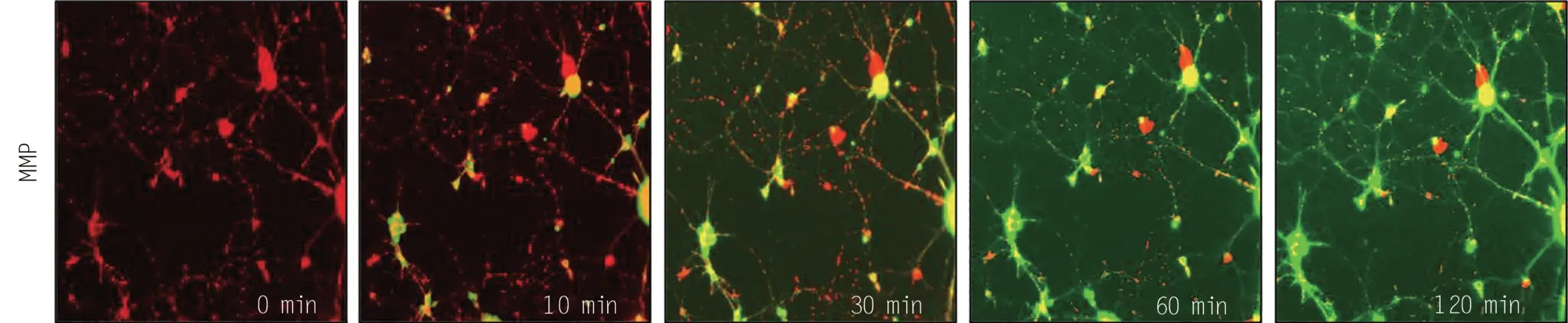
图4 Oxy-Hb时间依赖性降低了线粒体膜电位(MMP)(红色荧光向绿色荧光的转变可反映MMP的变化)
2.4 Oxy-Hb 时间依赖性的诱导了DNA 损伤和神经元凋亡
自由基的产生和线粒体功能的紊乱会导致DNA损伤和神经元凋亡。因此,本研究分别检测了DNA损伤和凋亡的标志物active-caspase-3 和Ser139-histone。如图5所示,40 μg/mL的Oxy-Hb处理神经元时间依赖性的诱导了caspase-3的活化和histone的磷酸化激活,说明Oxy-Hb通过诱导自由基产生,引起DNA损伤,进而诱导了神经元凋亡。以上结果均表明,Oxy-Hb体外可通过启动自由基产生和神经元凋亡,诱导神经元毒性,是脑出血后神经元损伤的重要机制。

图5 Oxy-Hb时间依赖性诱导了caspas-3的激活和组蛋白的磷酸化(Western blotting)
3 讨 论
脑出血作为常见的急发脑血管病常伴随神经功能障碍,具有较高的致死率和致残率[1-3]。脑出血后神经元的异常凋亡是造成神经功能丧失的主要原因之一[1-3]。探索脑出血后神经元的凋亡机制,有望为脑出血的防治提供实验依据,具有重要的研究意义和临床价值。
脑出血后神经元凋亡的机制仍不清楚,大体主要涉及[4-8]:颅内压升高,脑血流降低,钙离子释放,诱导神经元凋亡;神经元线粒体功能紊乱,启动线粒体介导的内源性凋亡通路;兴奋性谷氨酸水平的升高,导致神经元兴奋性神经毒性;自由基大量释放,导致氧化应激损伤等。证据表明,蛛网膜下腔出血后神经元凋亡性减少是导致不良预后的主要原因之一,临床上根据这一机制应用了一些神经元保护药物,如钙离子拮抗剂尼莫地平可抑制钙离子释放,防止血管痉挛,减弱神经元凋亡,但收效甚微。脑出血后血红细胞破裂释放出Oxy-Hb,对神经元有潜在的毒性,但是机制仍不清楚。评价Oxy-Hb造成神经元毒性的机制,具有重要的研究意义。本项目以Oxy-Hb 处理神经元构建体外脑出血损伤模型,评价了Oxy-Hb 处理后神经元活性、形貌、自由基、线粒体功能和凋亡等指标的变化。结果表明,Oxy-Hb 可通过诱导自由基产生和线粒体功能紊乱启动神经元凋亡,对神经元有潜在的毒性,可能是脑出血造成脑损伤的重要机制之一。
大脑是高耗氧部位,氧代谢伴随大量自由基的产生。研究证实SAH 伴随自由基的过量产生和释放,进而氧化和损伤DNA、蛋白等生物大分子,启动氧化应激损伤,破坏血脑屏障和诱导神经元凋亡[6-9]。大量基础研究表明,抑制氧化应激损伤可有效抑制神经元凋亡,减弱脑损伤和改善神经功能恢复。Zhang 等[10]研究表明,半胱胺在体内可通过抑制氧化应激反应,有效减弱早期脑损伤和抑制神经元凋亡;Wang 等[11]研究报道,硒代胱氨酸的衍生物在体外可有效清除高浓度葡萄糖诱导的自由基,减弱DNA损伤,抑制高浓度葡萄糖诱导的神经元毒性和神经元凋亡;Zhang 等[12-13]研究证实,姜黄素及纳米姜黄素可在体内外通过抑制氧化应激和炎症反应,有效抑制血脑屏障的塌陷,减弱脑损伤和神经元凋亡,并显著改善神经功能恢复;Aminzadeh等[14]研究证实,锂元素可在体外抑制细胞活性氧自由基导致的氧化应激损伤,减弱MAPKs 和AKT 信号通路的异常调控,进而抑制高糖诱导的神经元细胞凋亡。Liu 等[15]研究显示,天然产物白藜芦醇可在体外显著抑制高糖介导的细胞毒性和细胞凋亡,其拮抗机制主要是通过调控氧化应激和PI3K/AKT 通路来实现的。和本研究结果一致,Oxy-Hb体外处理时间和剂量依赖性的诱导了自由基和超氧阴离子的产生,进而导致histone 磷酸化激活,表明Oxy-Hb 体外造成了神经元氧化应激损伤。
线粒体是细胞内的能量工厂,能量代谢势必伴随自由基的产生。细胞内自由基的产生和清除维持在一个平衡状态,一旦打破平衡就会造成氧化应激紊乱,进而造成细胞损伤,甚至死亡。因此,线粒体是产生自由基最主要的一个细胞器,是自由基最主要的来源。其中,线粒体膜电位是调控自由基释放的主要屏障。本研究证实,Oxy-Hb处理诱导了明显的线粒体膜电位的降低,提示Oxy-Hb通过引起线粒体膜电位的降低,导致自由基的释放,进而导致氧化应激损伤。氧化应激损伤到一定程度,细胞会启动凋亡程序诱导细胞死亡,从而进一步清除受损细胞。结果证实,Oxy-Hb 处理可时间依赖性的诱导caspase-3的激活,表明Oxy-Hb诱导了神经元凋亡。
总之,Oxy-Hb 体外可抑制神经元的活性,造成其形态的改变;机制上通过诱导自由基产生和线粒体功能紊乱启动神经元凋亡,对神经元有潜在的毒性,可能是脑出血造成脑损伤的重要机制之一。
利益冲突所有作者均声明不存在利益冲突

