马尾松PmFPP和PmGGPP基因分子特征与表达分析
陈 虎,谢俊康,陆晶宇,谭健晖,李 鹏,杨章旗
(1.广西壮族自治区林业科学研究院 国家林业和草原局马尾松工程技术研究中心 广西马尾松工程技术研究中心 广西优良用材林资源培育重点实验室,广西南宁 530002;2.广西师范大学,广西桂林 541001)
萜类化合物是植物次生代谢物中最丰富的一类,在植物防御中起重要作用。萜类合成途径中,法尼基焦磷酸(FPP)和牻牛儿牻牛儿基二磷酸(GGPP)等前体直接影响萜类合酶(Terpene syn⁃thase, TPS)形成萜类化合物的种类[1]。萜类已成为植物与环境互作中的重要信号分子,是参与植物防御反应的植保素及调控植物部分激素的物质[1-2]。激素信号转导途径有利于增加植物萜类物质,从而提高植物抗性。茉莉酸(Jasmonic acid,JA)和茉莉酸甲酯(Methyl jasmonate,MeJA)途径可调控萜类物质代谢,提高植物抗虫能力[1,3-4]。水杨酸(Salicylic acid,SA)途径有利于植物萜类物质积累;赤霉素(Gibberellin,GA)代谢途径中,GAOsCPS1基因参与萜类物质的合成[5]。在针叶树中,JA 途径增加了冷杉(Abies fabri)根部萜类物质合成能力,提高白云杉(Picea glauca)萜类物质合成能力和相关表达量[6-7];MeJA 途径能明显提高西加云杉(Picea sitchensis)茎中萜类物质合成能力[8];SA 途径可明显提高拟南芥(Arabidopsis thaliana)的抗虫能力[9],超量表达萜类合成酶基因,提高亚麻萜类物质含量,并参与亚麻荠(Camelina sativa)GA途径提高抗虫性[10]。
马尾松(Pinus massoniana)是我国重要的速生用材树种。在有关马尾松的相关研究中,马尾松萜类化合物响应干旱胁迫,马尾松体内多种萜类物质与松材线虫胁迫表达呈正相关,萜类物质不同抗虫性材料差异显著[11-14]。课题组前期研究表明,外源激素处理对马尾松挥发性萜类物质含量产生影响,但马尾松PmFPP和PmGGPP基因是否受到激素和钙离子信号结合调控还不清楚。本研究在已获得的PmFPP和PmGGPP基因基础上,开展生物信息学分析和外源信号物质处理对基因表达调控的研究,以期为探索马尾松萜类合成途径基因功能提供参考。
1 材料与方法
1.1 试验材料
植物材料为马尾松0.5年生全同胞幼苗,苗木参照DB 45∕T 2384-2021[15]培育。选择苗高、地径基本一致,无损伤和病虫害的苗木作为试验材料。
1.2 试验处理
设置11 个处理,配置75 mg∕L 脱落酸(Abscisic acid,ABA)、50 mg∕L 水杨酸、100 mg∕L MeJA 和150 mg∕L GA,5个处理为单独激素溶液,5个处理为在激素溶液中分别加入100 mg∕LCaCl2溶液,1 个处理为100 mg∕LCaCl2溶液,以蒸馏水为对照(CK),每处理喷施200 mL 溶液。喷施前在溶液中加入3 滴1%吐温-20。每天上午9 点喷施1 次,均匀喷施于苗木;连续处理5 天;停止处理后第1、3 和5 天采集同部位成熟针叶,每个处理采集6株,等量混合后放入液氮保存。
1.3 试验方法
1.3.1 基因序列获得
PmFPP和PmGGPP基因序列来自课题组前期开展马尾松抗虫[14]、花发育、侧枝发育[16]和逆境胁迫获得的转录组数据。收集相关基因序列和信息,通过NCBI 比对,确定基因cDNA 开放阅读框核酸序列。
1.3.2 RNA提取,逆转录
采用天根公司(北京,中国)生产的多酚多糖植物RNA提取试剂盒提取所有材料的RNA;采用宝生物公司(大连,中国)M-MLV 逆转录酶,具体步骤参照说明书。RNA 提取和cDNA 逆转录完成后,进行琼脂糖凝胶电泳检测,采用紫外分光光度计检测浓度,再将所有样品浓度稀释至50 μg∕μL。
1.3.3 生物信息学分析
采用Expasy(https:∕∕www.expasy.org∕)在线软件分析基因的亚细胞定位、等电点、蛋白分子量和二级结构,采用Geneious(https:∕∕www.geneious.com∕)软件进行进化树聚类,采用T-Coffee 软件进行基因氨基酸序列比对,采用NCBI、Motif Scan 软件对结构域进行分析,采用String(https:∕∕string-db.org∕cgi)进行蛋白互作预测,采用MEME(https:∕∕meme-suite.org∕meme∕)分析序列保守基序。
1.3.4 基因表达分析
采用Primer 5 软件设计荧光定量引物,以PmC⁃YP基因作为内参[17]。PmCYPF:CAAGGGTTCGTC⁃GTTCCAC,PmCYPR:GGCAAACTTCTCGCCGTA;Pm⁃GGPPF:GCCAATGCCATCAATGAAGCTCTG,PmGG⁃PPR:AGCCAGAAGCGAATACCTCATTGC;PmFPPF:GTGCTTGGCTGGTGTATTGAATGG,PmFPPR:AAC⁃AAGGTTGTCCACGCCTA GTG。采用荧光定量PCR技术,对PmFPP和PmGGPP基因在MeJA、GA、ABA和SA等激素处理和激素与Ca2+共同处理下的表达进行分析。根据SYBR Premix Ex Taq II(Prefect real-time)TaKaRa试剂盒说明书进行荧光定量PCR体系构建和扩增(Light Cycle 480II PCR仪),3次生物学重复,根据2-ΔΔCt法计算相对表达量。
1.4 数据处理
采用Excel 软件作图,采用SPSS 软件进行方差分析并对基因表达量进行差异性检验。
2 结果与分析
2.1 生物信息学分析
PmFPP和PmGGPP基因分别编码347和385个氨基酸,分子量分别为39.85 和42.18 kDa,等电点分别为5.08 和5.86,跨膜结构分别有2 和4 个,亚细胞分别定位于线粒体和叶绿体、质体。两个基因均存在Ser、Thr 和Tyr 磷酸化位点,PmFPP 的Tyr 磷酸化位点较多,PmGGPP 只有1 个;两个基因有共同的cdc2、CKII、DNAPK、PKA、PKC 和unsp 磷酸化酶结合位点,PmFPP 具有特有的EGFR,PmGGPP 具有特有的ATM、cdk5、CKI 和P38mapk 磷酸化酶结合位点。二级结构预测中,α-螺旋占比最高,其次为随机卷曲,β-转角占比最小。
PmFPP 和PmGGPP 基因结构域均含有聚戊烯合成酶特征1(95 ~ 109 和170 ~ 186 aa)、聚戊烯合成酶特征2(229 ~ 241 和303 ~ 315 aa)和十聚异戊二烯二磷酸合成酶(39~310和121~381 aa);PmFPP具有细胞因子受体1 类家族特异性结构域(236 ~291 aa)和Pseudomurein-binding(假细胞质)重复结构域(181~191 aa);PmGGPP 具有细菌胞外溶质结合蛋白(71 ~ 105 aa)和Big-1(bacterial Ig-like do⁃main 1)结构域(1~6 aa)。
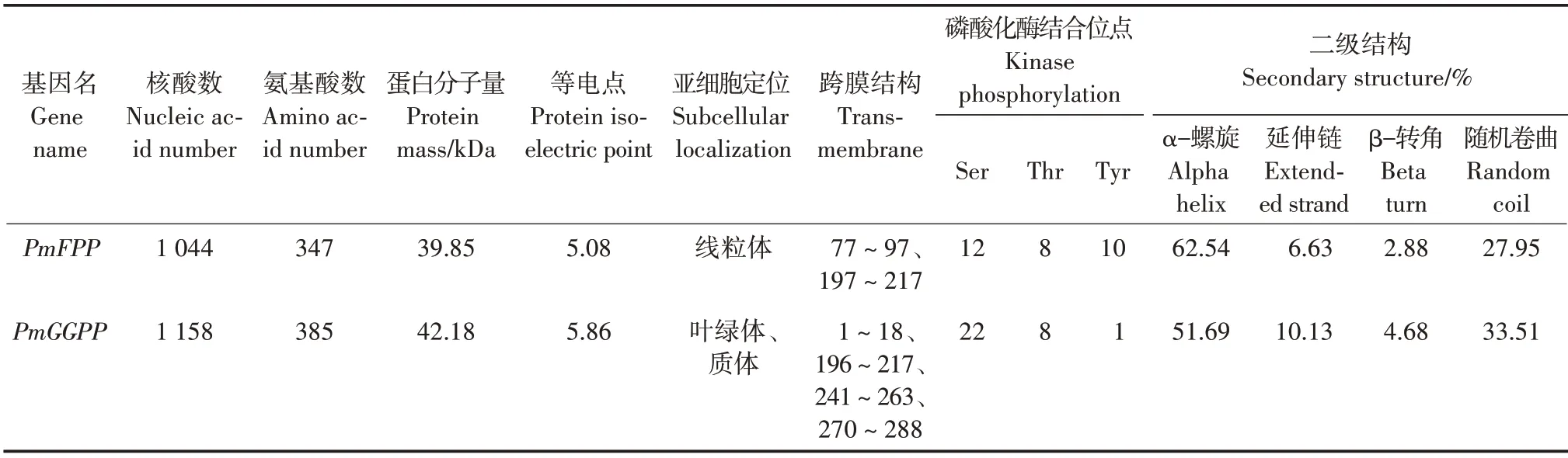
表1 PmFPP和PmGGPP蛋白生物信息学分析Tab.1 Bioinformatics analysis of PmFPP and PmGGPP protein
2.2 聚类分析
通过NCBI 分别比对PmFPP和PmGGPP基因的同源基因,选取19 个物种构建进化树(图1)。结果表明,PmFPP基因核酸序列和氨基酸序列与火炬松(P. taeda)相似性最高,分别为98.37%和99%;PmGGPP基因核酸序列和氨基酸序列与挪威云杉相似性最高,分别为93.52%和100%。通过对PmFPP 和PmGGPP 序列进行保守基序分析,PmFPP的motif 4 含有保守区RXXS,motif 1 含有保守区FARM(DDxxD),motif 2 含有保守区SARM(DDxxD);PmGGPP 的motif 1 含有保守区FARM(DDxxxxD)和CxxxC,motif 2含有保守区SARM(DDxxD)(图2)。
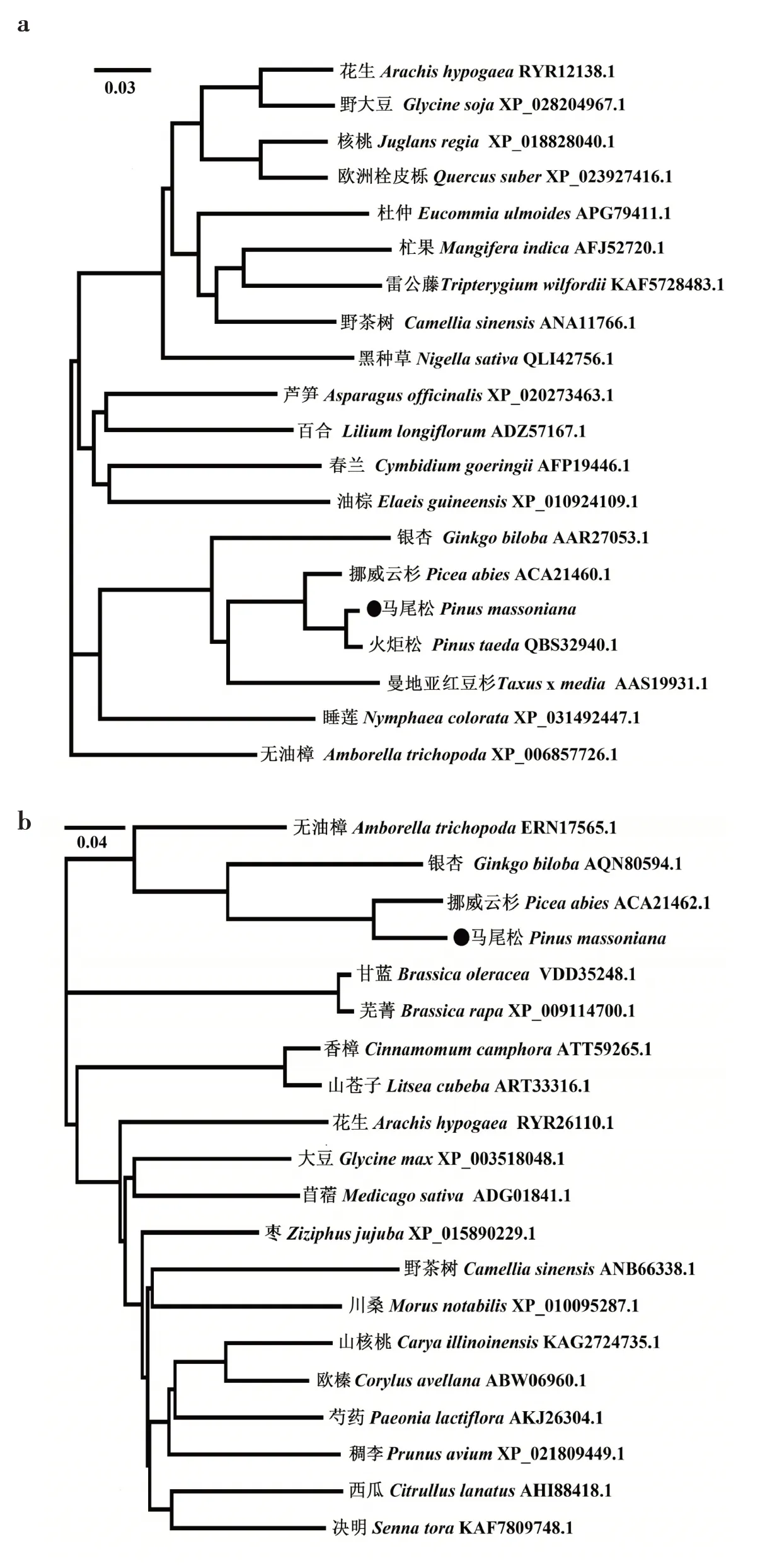
图1 马尾松与其他物种FPP和GGPP基因进化树分析Fig.1 Phylogenetic analysis of FPP and GGPP of P.massoniana and other plants

图2 氨基酸序列比对Fig.2 Alignment of amino acid sequences
2.3 功能预测
将 PmFPP 与拟南芥同源蛋白 SQS1(AT4G34640.1)、AT1G77580(AT1G77580.2)和AT1G21810(AT1G21810.1),PmGGPP与拟南芥同源蛋白G4(AT3G51820.1)、GA1(AT4G02780.1)、GA2(AT1G79460.1)和TPS03(AT4G16740.1)进行蛋白互作网络分析。结果表明,PmFPP 和PmGGPP 通过1个吡啶核苷酸二硫键氧化还原酶(AT1G74470.1)作为连接蛋白完成互作(图3)。
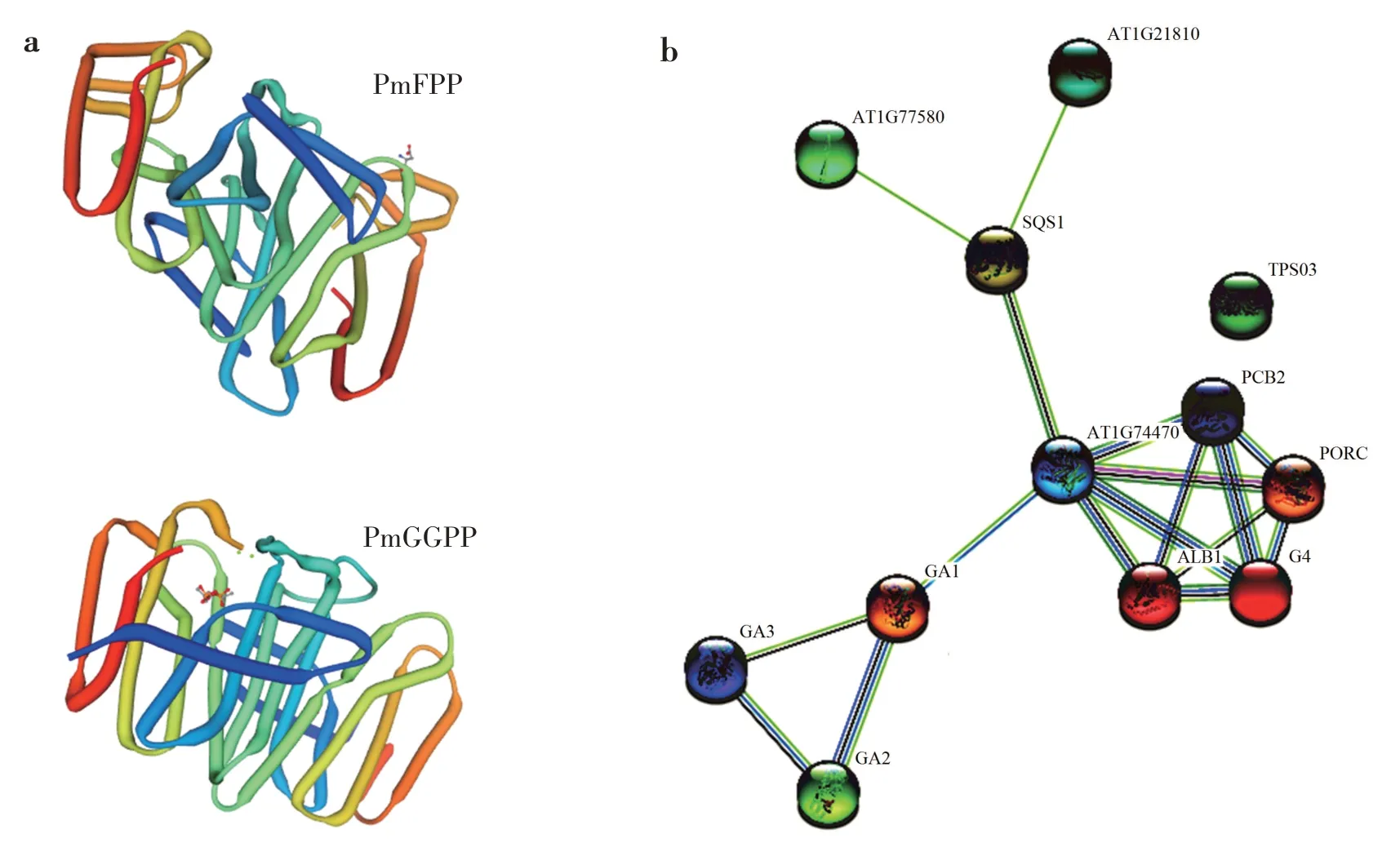
图3 PmFPP和PmGGPP蛋白三维结构和基因互作网络分析Fig.3 Three-dimensional structures of PmFPP and PmGGPP protein and interaction network of genes
在互作网络中,PmFPP(SQS1)能将presqualene diphosphate(PSPP)前体磷酸化转化为2 个FPP,是甾醇生物合成的关键酶之一。PmGGPP(TPS03)是三环萜合酶,该基因转录水平增加对JA处理或胁迫的响应。GA1 在GA 途径中催化GGPP 到二萜;GA2在GA 途径将GGPP 转化为copalyl pyrophosphate(CPP);G4 具有叶绿素合酶活性,可执行叶绿素(a和b)的酯化反应,这是叶绿素生物合成最后一步,可使GGPP 作为底物;GA3 是贝壳杉烯氧化酶,在GA合成中起关键作用。
PmGGPP(TPS03)未与其他蛋白直接互作,而是和编码3-羟基-3-甲基戊二酰辅酶A 还原酶HMG1(AT1G76490.1)互作,在类异戊二烯生物合成的第一步中发挥作用,在叶片黑暗处理中表达被激活。
PmFPP 和PmGGPP 蛋白三级结构预测表明,PmFPP 与杜仲(Eucommia ulmoides)的FPS(7bux.1.
A)结构为模板,PmFPP 与模板的一致性为73.68%,GMQE 分值为0.80;以Mint heterotetrameric GPP(3krp.3)结构为模板,PmGGPP 与模板的一致性为70.07%,GMQE 分值为0.68,说明同源建模构建的蛋白三维结构是可靠的。PmFPP 具有中心疏水通道的二聚体结构,是萜类生物合成的关键,参与种子发育和成熟过程。薄荷(Mentha canadensis)GPPS的LSU 和SSU 分别负责催化和调控,与PmGGPP同源,共同作用形成香叶酰焦磷酸,是单萜类物质合成的前提。
2.4 基因表达分析
Ca2+处理的第1天和第5 天,PmFPP基因表达量显著高于CK(P<0.05),第3 天显著低于CK(P<0.05),总体提高了基因的表达量(图4)。MeJA、GA和SA 处理从第3 天开始和ABA 处理的第5 天,PmFPP基因表达量显著高于CK(P<0.05);激素+Ca2+处理后,MeJA 和GA 在第5 天、ABA 从第1 天开始及SA 从第3 天开始基因表达量显著高于CK(P<0.05)。激素和激素+Ca2+的处理在第3天和第5 天基因表达量显著高于Ca2+处理(P<0.05)。Ca2+和激素ABA能正向调控目的基因。
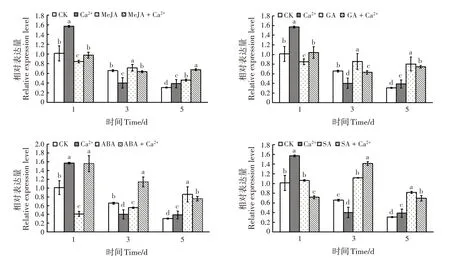
图4 PmFPP基因在不同处理下的表达模式Fig.4 Expression of PmFPP gene under different treatments
Ca2+处理的PmGGPP基因表达量与CK 相比显著下调(P<0.05)(图5)。在第5天,MeJA、GA、ABA和SA 处理的PmGGPP基因表达量均显著高于CK(P<0.05);从第1天开始,所有激素处理的PmGGPP基因表达量均显著高于Ca2+处理(P<0.05)。除Me⁃JA+Ca2+处理在第5天PmGGPP基因表达量高于Me⁃JA 处理外,其他激素+ Ca2+处理的PmGGPP基因表达量均显著低于激素处理(P<0.05)。Ca2+可以降低目的基因表达;MeJA、GA、ABA 和SA 激素可以缓解Ca2+对目的基因的抑制,能正调控目的基因表达。
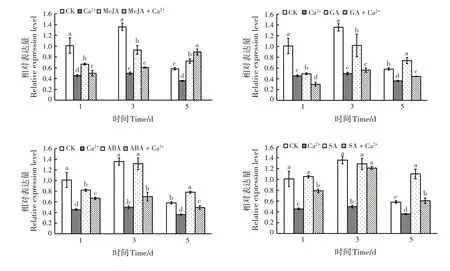
图5 PmGGPP基因在不同处理下的表达模式Fig.5 Expression of PmGGPP gene under different treatments
3 讨论与结论
本研究获得编码347 和385 个氨基酸的马尾松萜类合成途径关键酶PmFPP和PmGGPP基因,序列分析发现这两个基因与其他物种,尤其是与针叶树种具有高度相似性。PmFPP 具有2 个DDxxD 典型结构域,PmGGPP 具有DDxxxxD、CxxxC 和DDxxD 典型结构域,不同物种FPP和GGPP的典型结构域均高度保守,说明这两个基因在进化过程中较为稳定。DDxxD 结构域被认为是酶与底物的结合位点,是一类酶催化活性中心,在协调二价金属离子和酶底物基团结合时起关键作用[18]。但PmFPP 两个DDxxD 在结构上相互依赖,不能作为完全独立的活性中心,萜类代谢途径中的酶在转录水平上常呈相关性,这些酶的表达可能受同一个转录因子的调控,因此萜类代谢途径中可能有转录因子存在[19-20]。
大部分FPP基因亚细胞定位于叶绿体,而PmF⁃PP定位于线粒体,可能是由于PmFPP 存在1 个62个氨基酸的RXXS 保守区,参与萜类化合物生物合成;PmGGPP 定位于质体,主要合成胡萝卜素、赤霉素、ABA 和叶绿素等物质[21-24]。橡胶草(Taraxacumkoksaghyz)和人参(Panax ginseng)等FPP基因无跨膜结构[25-26]。本研究中,PmFPP 和PmGGPP 基因分别有2 和4 个跨膜结构,大多数裸子植物中的萜类合成酶家族不同于被子植物[22,27]。序列比较和系统发育构建也揭示裸子植物萜类合成酶起源关联性比被子植物更为密切,裸子植物控制树脂合成的萜类合成酶系统发育树是一个独立分支,本研究聚类和同源序列比对结果也进一步说明针叶树在长期演化过程中形成了独特的防御系统[26]。
本研究中,与CK 相比,PmFPP和PmGGPP分别在MeJA 处理的第3天和第5天表达量上升,MeJA能诱导植物中单萜和二萜合成酶转录水平表达增加,提高萜类合成酶活性,促进萜烯化合物积累[22]。MeJA 诱导2 天后FPP 基因才表达增加,诱导三萜含量增加[28],并与萜烯类物质作为信号分子防御外界伤害[29],与本研究对PmFPP功能预测相同。
SA 处理下,PmFPP和PmGGPP基因与对照相比,第1 天和第5 天表现出较高表达量;GA 处理提高了PmFPP和PmGGPP的表达量。GA处理对黄花蒿中倍半萜含量无显著影响[30],MYC2通过与JA 和GA 信号途径的因子互作来整合外源和内源生长发育信号协调花中单萜和倍半萜的合成与挥发[31],结合功能预测结果,推测GA 途径调控PmGGPP影响二萜类物质的合成[32]。与对照和激素处理相比,Ca2+处理、激素与Ca2+处理的两个基因表达量均下降。细胞外Ca2+螯合剂可以抑制萜类物质诱导下防御基因的表达[33],Ca2+是否通过负调控激素信号途径参与萜类合成途径,还有待进一步研究。

