海马高级糖基化终末产物受体和β-淀粉样前体蛋白裂解酶表达增加与自发性高血压大鼠认知功能损害相关性研究
黄 冬,苗 锐,李 阳,郭 涛,张晓梅,杨荣军,赵凯涛,梁军丽,王 磊
(1.陕西省第二人民医院神经内科,陕西 西安710005;2.陕西省第二人民医院急诊科,陕西 西安710005)
高血压,也称为动脉血压升高,表现为收缩压大于140 mm Hg,舒张压大于90 mm Hg,是一类广泛的公共健康问题。在中国,其发病率逐年上升,在35~75岁的成年人中,将近一半的人均患有高血压,其中只有不到三分之一的人接受了治疗,不到十二分之一的人有效地控制了血压数值[1]。目前,高血压已经成为首位导致人早逝的疾病,因为它常常会伴随其他疾病产生,比如脑卒中、心衰等[2]。近些年发现高血压与阿尔茨海默病(Alzheimer’s disease,AD)的发生相关[3]。由于高血压引起血管重构,会导致一些心脑血管疾病和血管性痴呆,但是其中的机制尚不明确。
AD是痴呆最常见的一种类型,在全世界患病人数超过3.39千万[4]。AD的最主要病变为细胞外海马β淀粉样蛋白(Amyloid-β,Aβ)斑块形成和细胞内τ蛋白过度磷酸化导致的神经纤维缠结[5]。痴呆引起的认知功能障碍一般是认为与海马密切相关[6]。近些年海马高级糖基化终末产物受体(Receptor for advanced glycation end-products,RAGE)被报道可以诱导高血压动物脑中Aβ蛋白的沉积,造成认知损害[7]。过量Aβ聚集是由Aβ前体蛋白(Amyloid-β precursor protein,APP)代谢异常而引起,在体内,APP主要通过β-淀粉样前体蛋白裂解酶1(β-site APP cleaving enzyme 1,BACE1)清除,从循环血液中进入脑内主要是通过RAGE介导[8],因此RAGE与BACE1很有可能与自发性高血压大鼠(Spontaneous hypertension rats,SHR)认知功能损害密切相关,本研究将通过在SHR模型上,探究海马区RAGE与BACE表达变化与SHR认知功能损害之间的关系。
1 材料与方法
1.1 实验动物 本研究所用动物为SHR与正常血压大鼠(Normotensive wistar rats,NWR)。动物饲养在环境温度与湿度均可控的实验动物中心,环境照明为12 h明/暗。所有实验均符合本院实验动物管理条例。
1.2 实验方法
1.2.1 NWR与SHR的增强型磁共振成像(MEMRI)[9]:用双蒸水作为溶剂配置MnCl2溶液(Sigma Aldrich,USA)。在成像之前22 h,所有动物腹腔注射MnCl2溶液(70 mg/kg),注射完后放回原笼子中饲养。在成像当天,用3%~4%的异氟烷麻醉动物。采用4.7T的Magnex Scientific MR scanner进行成像拍摄,使用软件为Agilent Technologies Vnmr J 3.1。
1.2.2 Morris水迷宫[10]:在圆形池加入添加有白粉的水,水温保持在22~23 ℃。在第1~3天时,在水面有一略高出水面的平台,将大鼠面向池壁,分别从四个入水点放入水中,重复3轮,记录大鼠找到平台的时间。在第4天时,隐藏平台的位置,重复之前的操作,记录大鼠在看不见平台位置时,寻找到平台的时间,考察大鼠对原平台的记忆。
1.2.3 新事物识别:在进行新事物识别实验前,每天抚摸实验大鼠1 min,避免刺激大鼠。在进行实验前24 h,将动物放在测试房间内,适应环境。在训练阶段,将两个相同的物体放在同一侧箱壁的左右两端,将大鼠背朝两物体且处于两物体中线位置,靠近箱壁放入箱子中,放入后立即开启录像设备,实验者离开测试房间。记录时间持续5 min,记录每一只大鼠与两个相同物体分别接触的时间。在测试阶段,将其中一个物体换为另外一个新物体,同样的方式,记录每只大鼠在测试阶段对旧物体与新物体分别的接触时间。每只大鼠训练阶段与测试阶段间隔2 h。每换下一只大鼠前,将箱子与物体用酒精擦去气味。测试结束后,将大鼠放回原来的饲养笼子中。
1.2.4 Western blot:将匀浆机置于冰上,预冷离心机,取出大鼠的全脑,在冰上分离海马组织,用剪刀剪成小块,称取0.1 g组织,置于干净的离心管中,加入1 ml RIPA裂解液(Beyotime,上海)裂解,电动匀浆机充分匀浆2~3 min,用离心机在4 ℃,12000 r/min离心15 min,取上清置于新的离心管中,进行超声破碎。取5 μl样品,用BCA试剂盒(Beyotime,上海)进行蛋白浓度测定。
将蛋白样品直接上样到SDS-PAGE胶加样孔内,电压设置100 V,时间90 min。湿法转移至PVDF膜上,进行封闭、一抗孵育、二抗孵育、显影和曝光等过程。
一抗包括:rabbit polyclonal anti-BACE1 (1∶1000;B0681,Sigma-Aldrich) ;mouse monoclonal anti-β-actin (1∶5000;A5316,Sigma-Aldrich);rabbit polyclonal anti-RAGE antibody (1∶800;ab3611,Abcam)。
1.2.5 免疫蛋白反应:采用标准的ABC(Avidin-Biotin Complex)法对Aβ斑块进行染色。所用一抗为mouse monoclonal anti-Aβ6E10(1∶1000;SIG-39300,Covance)。ABC法处理完成后,用DAB试剂盒按照标准实验步骤进行后续染色。
1.3 统计学方法 MEMRI数据处理按照已经发表的实验方法进行成像数据处理[11]。Morris水迷宫实验和新事物识别实验以及Western blot采用SPSS软件(Version 20),计量资料用均值±标准差表示,采用t检验分析,P<0.05为差异有统计学意义。
2 结 果
2.1 SHR大鼠海马在MEMRI中活动降低 在MEMRI的图片中(图1),我们统计了NWR与SHR两组大鼠海马位置的信号强度(Signal intensity,SI),发现SHR比NWR表现出较弱的核磁信号强度(0.698与1.499,P<0.01),提示在SHR中,海马脑区神经元活动较低,海马功能异常。
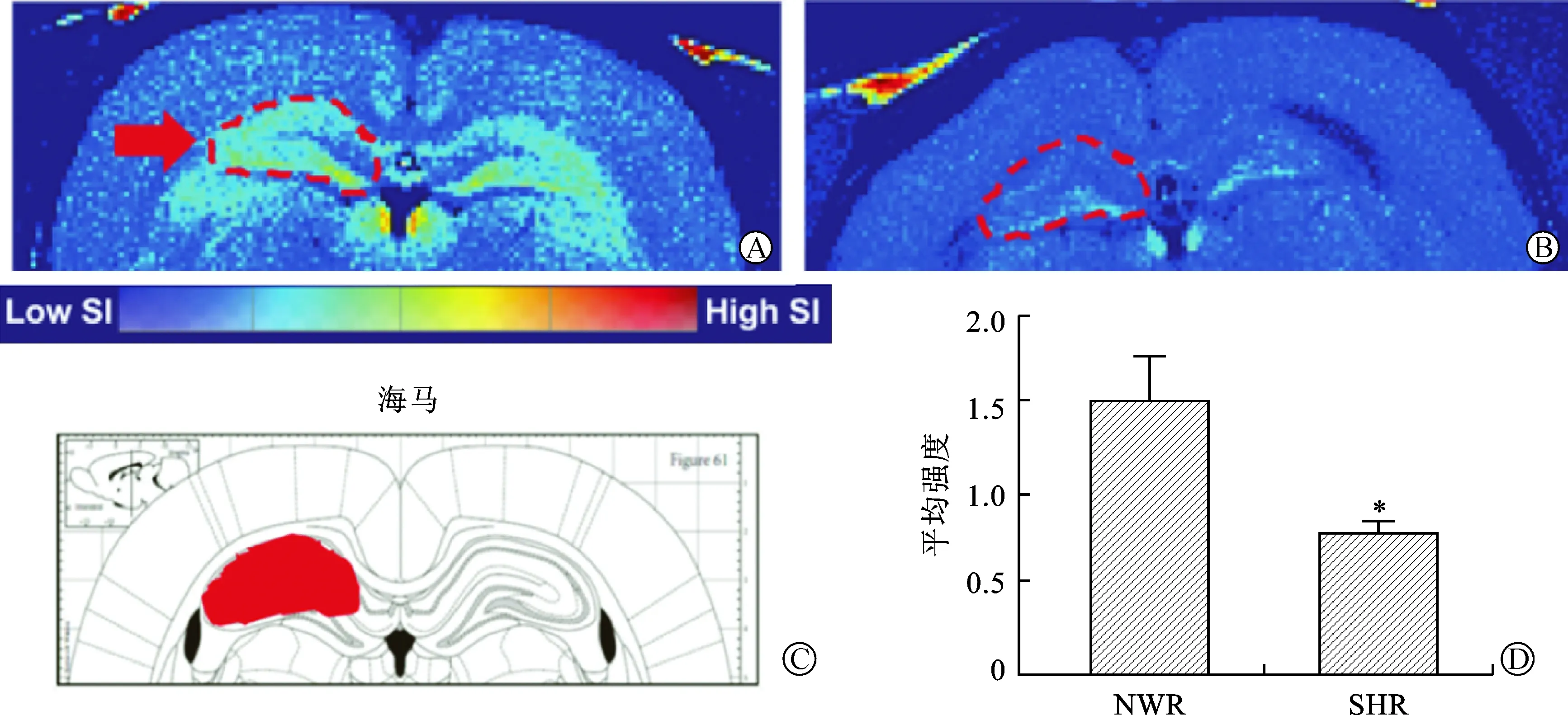
A、B:NWR与SHR大鼠MEMRI,红线和箭头指示位置为海马脑区;C:A、B图对应脑图谱位置;D:NWR与SHR大鼠海马MEMRI核磁信号平均强度。*与NWR比较,P<0.01
2.2 SHR空间记忆能力下降 通过Morris水迷宫实验,我们训练了SHR与NWR,在训练的第1天到第3天,SHR找到平台的时间与NWR相比,没有统计学差异。在第4天的测试阶段,SHR找到隐藏在水面下平台的时间,比NWR要长(35.3与12.2,P<0.01),提示SHR的空间记忆能力受损。见图2。
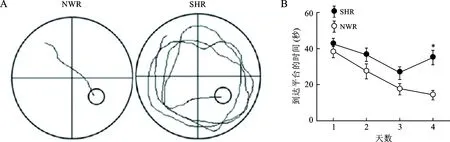
A:NWR与SHR在迷宫中运动轨迹图;B:NWR与SHR从入水点到达平台所用的时间。*与NWR比较,P<0.01
2.3 SHR短期记忆能力受损 在新事物识别实验的训练阶段,SHR与NWR对两个相同物体表现出类似的探索行为:对两个物体的探索时间一样,表明大鼠对左右没有偏好性,同时NWR与SHR对两个物体的探索时间长短没有统计学差异。当测试阶段将其中一个旧物体更换为一个大鼠没有见过的新物体,记录每只大鼠对旧物体与新物体的探索时间,发现NWR与SHR对旧物体的探索时间相似,但是SHR对新物体的探索时间比NWR显著降低(13.7与31.5,P<0.01),提示SHR的短期记忆能力受损。见图3。
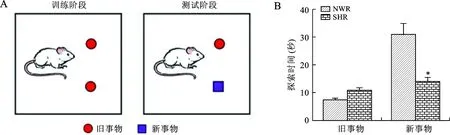
A:训练阶段以及测试阶段示意图;B:测试阶段,NWR与SHR对旧事物与新事物的探索时间。*与NWR比较,P<0.01
2.4 RAGE在SHR海马部位蛋白表达水平显著升高 我们分离了大鼠的海马脑区,并用Western blot 检测了RAGE蛋白的变化。通过灰度对比检测,我们发现SHR海马部位的RAGE蛋白表达量相比NWR组显著升高(0.407 与0.789,P<0.05)。见图4。
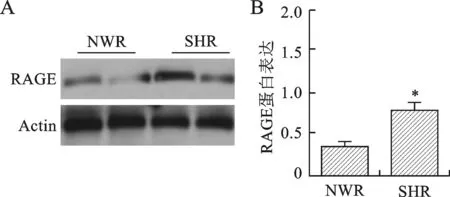
A:RAGE蛋白与内参Actin在海马部位的Western blot条带;B:RAGE的灰度值统计。*与NWR比较,P<0.05
2.5 BACE在SHR海马部位蛋白表达水平显著升高 我们还检测了在海马部位的BACE蛋白表达水平,在SHR的海马脑区中,BACE蛋白的表达量相比NWR显著增加(0.733 与 1.502,P<0.01)。见图5。
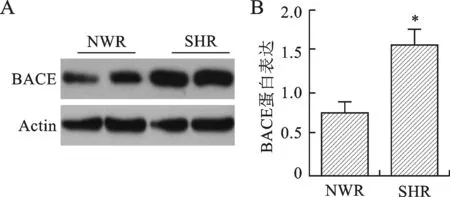
A:BACE蛋白与内参Actin在海马部位的Western blot条带;B:RAGE的灰度值统计。*与NWR比较,P<0.01
2.6 淀粉样斑块Aβ 在SHR海马脑区中表达显著增加 通过免疫蛋白反应,我们对NWR与SHR的海马切片进行染色,观察到在NWR中,海马脑区未观察到Aβ阳性信号,而在SHR中,观察到大量的淀粉样棕色斑块沉积,即为Aβ。见图6。

A、B:NWR与SHR海马脑区Aβ染色图;C、D:分别对应A、B中海马脑区放大图。A-B:标尺=1 mm;C-D:标尺=200 μm
3 讨 论
目前全世界有三分之一的成年人都患有高血压,在年龄超过65岁的人群中,其患病率可以达到三分之二[12-13]。未来2025年,患高血压人数将可能增长到15.6亿人。痴呆(Dementia)的患病率会随着年龄的增长呈指数增加,65岁以上的人群,每5年,患病概率会加倍[14]。目前已有明确证据表明,高血压会造成一系列脑疾病,包括认知能力下降、阿尔兹海默病和血管性痴呆等[15-17]。在患有认知功能障碍的人群中,大部分都患有高血压[18]。但是目前对于高血压中认知功能是如何发生变化的,机制还没有完全明确。因此亟须明确高血压中,造成认知功能改变的因素。
RAGE是一个多配体受体,其主要配体为糖化反应终端产物(Glycation end products),除此外,还能介导外周Aβ向脑内的转运过程[19]。Aβ 的过量产生与沉积,是引起AD的主要原因之一,因此RAGE可能是通过影响Aβ 在脑内的沉积过程,从而引起认知功能的变化。BACE是一类跨膜蛋白,它可以通过水解APP蛋白而产生Aβ,在AD患者脑中已经发现BACE的表达上调,临床在研药物包括BACE的抑制剂,可以通过抑制BACE活性,从而抑制Aβ的产生,对AD的发病进程产生影响[20]。BACE和RAGE均可以通过促进Aβ的产生,造成认知功能损害。
我们通过自发性高血压大鼠(SHR)与正常血压大鼠(NWR),对高血压中认知功能发生改变的这一现象,进行了相关研究。通过MEMRI,我们观察到SHR相比NWR,海马区域脑活动降低,提示SHR的海马功能受到抑制;通过水迷宫与新事物识别等行为学实验,也观察到SHR的空间记忆以及短期记忆能力降低,即认知功能受损。进一步我们分别检测了海马区域RAGE与BACE的蛋白表达水平,在SHR中,两种蛋白的表达水平均显著升高,提示海马区域功能降低、认知功能受损可能是由于RAGE与BACE的表达量增加有关。我们又通过免疫蛋白反应检测了NWR与SHR的Aβ蛋白表达情况,在NWR中,我们几乎没有观察到Aβ的表达,而在SHR中,海马区域有大量淀粉样的蛋白表达,即为Aβ的沉积。
本研究将为SHR中认知功能变化的基础研究与临床研究提供理论基础,但是在SHR中,海马脑区的RAGE与BACE是如何增加的,还需要进行深入研究。

