戊巴比妥钠诱导心力衰竭心肌细胞损伤模型的构建及鉴定
刘云璐,王承龙,王 强,杨 静
(1.中国中医科学院西苑医院,北京 100089;2.国家中医心血管临床医学研究中心,北京 100089;3.中国中医科学院望京医院,北京 100102;4.中国中医科学院医学实验中心,北京 100010)
心力衰竭(心衰)是威胁全球人类健康最主要的疾病之一[1-3]。心衰可由任何导致的心内压升高或心输出量减少的心脏疾病引起[3]。心肌梗死被认为是导致心衰的主要原因。心肌细胞的缓慢持续的损伤和死亡,是导致进行性心功能不全的主要病理生理机制[4]。因此,了解心肌细胞损伤死亡的机制,对预防心衰具有重要性。目前,心衰的机制研究包括心肌细胞死亡、线粒体功能异常[5]、钙调控失调、心肌纤维化和心肌肥大等方面[6-8]。明确心肌细胞损伤模型形成的机制,对心衰的基础研究进展,具有重要意义[7]。
戊巴比妥钠对中枢神经系统存在广泛的抑制作用,故研究中常作为动物基础麻醉药[8]。然其对心脏也具有较大的副作用,可严重抑制心肌收缩功能导致心衰。其损伤机制除线粒体功能障碍、氧化应激之外,还与细胞凋亡、细胞自噬等环节密切相关[3,9],因此戊巴比妥钠可作为制作体外心力衰竭模型的药物[10]。目前,戊巴比妥钠诱导心肌细胞损伤死亡的机制尚不十分明确,本实验通过电镜下直观地观察心肌细胞、亚细胞、凋亡状态的改变,明确戊巴比妥钠诱导大鼠心肌细胞株H9c2(2-1)(H9c2细胞)细胞损伤死亡的机制。
1 材料与方法
1.1 实验材料 戊巴比妥钠粉末(美国SIGMA公司,货号57-33-0),国产DMEM基础培养基(Gibco公司,货号C11995500BT),胎牛血清(Gibco公司,货号10100147),0.25%胰蛋白酶(Gibco公司,货号25200272),青链霉素混合液(Gibco公司,货号15140122),PBS缓冲液(索莱宝科技有限公司,货号P1020),活性氧(ROS)试剂盒(美国SIGMA公司,货号MAK114),三磷酸腺苷(ATP)检测试剂盒(南京建成生物工程研究所,货号A095-2-1),戊二醛溶液(美国SIGMA公司,货号G5882),RIPA组织/细胞裂解液(北京索莱宝科技有限公司,货号S3568)。
1.2 实验方法
1.2.1 细胞培养:H9c2细胞(购于中国医学科学院细胞资源中心),培养于10%胎牛血清、1%青链霉素的DMEM高糖完全培养基中(37 ℃、5%CO2)。待细胞生长成熟,状态稳定后,进行实验。
1.2.2 构建心肌细胞损伤模型:无血清DMEM高糖培养基溶解戊巴比妥钠粉末,混匀后配置成0.4%、0.8%、1.6%戊巴比妥钠溶液。加至生长H9c2心肌细胞的六孔板中,分别作用0、7、10 min。实验最终确定,0.8%戊巴比妥钠处理H9c2细胞7 min,为心肌细胞损伤模型最佳条件。
1.2.3 透射电镜观察H9c2细胞线粒体、自噬小体形态结构变化:低倍镜下(德国Leica倒置显微镜)观察H9c2细胞形态学改变。透射电镜(日本HITACHI投射电子显微镜)观察H9c2细胞线粒体超微结构改变。0.25%EDTA的胰蛋白酶消化、收集细胞,PBS润洗2次,离心,加入2%戊二醛,4 ℃固定过夜。PBS漂洗,1%锇酸固定,1%醋酸铀块染,梯度丙酮脱水,包埋液包埋固化,半薄切片及甲苯胺蓝染色,LKB-V超薄切片机超薄切片。透射电镜下观察H9c2细胞线粒体自噬小体形态及数量改变。
1.2.4 CCK-8法检测H9c2细胞增殖活力: H9c2心肌细胞1×104个/孔接种于96孔板中,100 μl/孔完全培养基,每组6复孔。隔夜培养后,戊巴比妥钠干预7 min,24 h后检测细胞增殖活力。每孔10 μl CCK-8,90 μl完全培养基,避光37 ℃、5%CO2培养2~4 h。酶标仪450 nm检测OD值,计算H9c2细胞增殖活力。
1.2.5 H9c2细胞ATP、ROS含量变化:ATP试剂盒通过虫荧光素酶法,检测H9c2细胞ATP浓度。弃去6孔板原有培养基,加入200 μl/孔裂解液,移液枪反复吹打,晃动6孔板,使裂解液充分接触并裂解细胞。4 ℃、12000 g离心5 min,取上清。加100 μl酶工作液至检测管,室温放置3~5 min,消耗掉本底全部ATP。细胞上清20 μl/检测管孔,微量移液枪迅速混匀,间隔2 s以上,液闪仪测定RLU值。
ROS荧光探针标记H9c2细胞中ROS。H9c2细胞1×104/cm2于10 cm培养皿中培养12 h后,0.8%戊巴比妥钠处理7 min,加入完全培养基培养24 h。弃去培养基,PBS润洗细胞2次,0.25%胰蛋白酶消化,吹打。1000 r/min离心5 min,弃上清。无血清培养基稀释10 μmol/L活性氧荧光探针(DCFH-DA,1∶1000),重悬H9c2细胞团;37 ℃、5%CO2培养箱中孵育30 min,每隔5 min混匀1次。基础培养基重悬细胞3次,每次1000 r/min离心5 min,荧光显微镜检测强荧光产物2’,7’-二氯荧光素(2’,7’-Dichlorofluorescein,DCF)。
1.2.6 流式细胞术检测H9c2细胞凋亡改变:不含EDTA胰蛋白酶消化H9c2细胞,1000 r/min离心5 min,4 ℃预冷的PBS润洗细胞2次,250 μl结合缓冲液(去离子水1∶10稀释)重悬细胞,调节H9c2细胞浓度为1×106/ml。5 ml流式管100 μl细胞悬液中,加入Annexin V-FITC和10 μl碘化丙锭溶液各5 μl,混匀,室温避光孵育15 min,反应管中加400 μl PBS,1 h内流式细胞仪检测。
2 结 果
2.1 0.8%戊巴比妥钠处理H9c2细胞7 min为构建心肌细胞损伤模型最佳条件 低倍镜下,H9c2细胞形态如图1所示,0%(对照组),0.4%、0.8%、1.6%戊巴比妥钠分别处理H9c2细胞0、7、10 min。倒置显微镜下观察H9c2细胞,原本梭形的细胞两端变细中部变圆,有脱壁倾向,心肌细胞搏动停止,则为造模成功。0.8%戊巴比妥钠处理7 min的H9c2细胞符合模型条件。
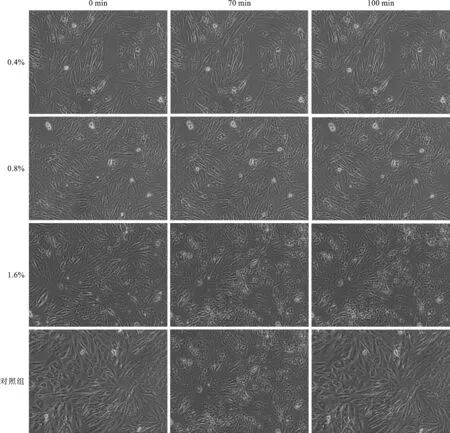
图1 光镜比较不同条件下,戊巴比妥钠作用于H9c2心肌细胞的形态学变化(甲苯胺蓝染色,×100)
2.2 透射电镜下观察H9c2细胞线粒体、自噬小体等超微结构改变 见图2,对照组(无戊巴比妥钠处理),H9c2细胞线粒体边界清楚,基质均匀,线粒体嵴致密,形态正常。模型组(0.8%戊巴比妥钠处理H9c2细胞7 min),H9c2细胞线粒体边界模糊不清,体积明显肿胀,基质密度降低,部分线粒体内膜破裂、嵴疏松溶解,少数出现嵴断裂现象,可见空泡样变。与对照组H9c2细胞相比,模型组H9c2细胞线粒体肿胀,自噬小体的数量明显增多,形成大量空泡,线粒体膜的完整性受到破坏(图3)。
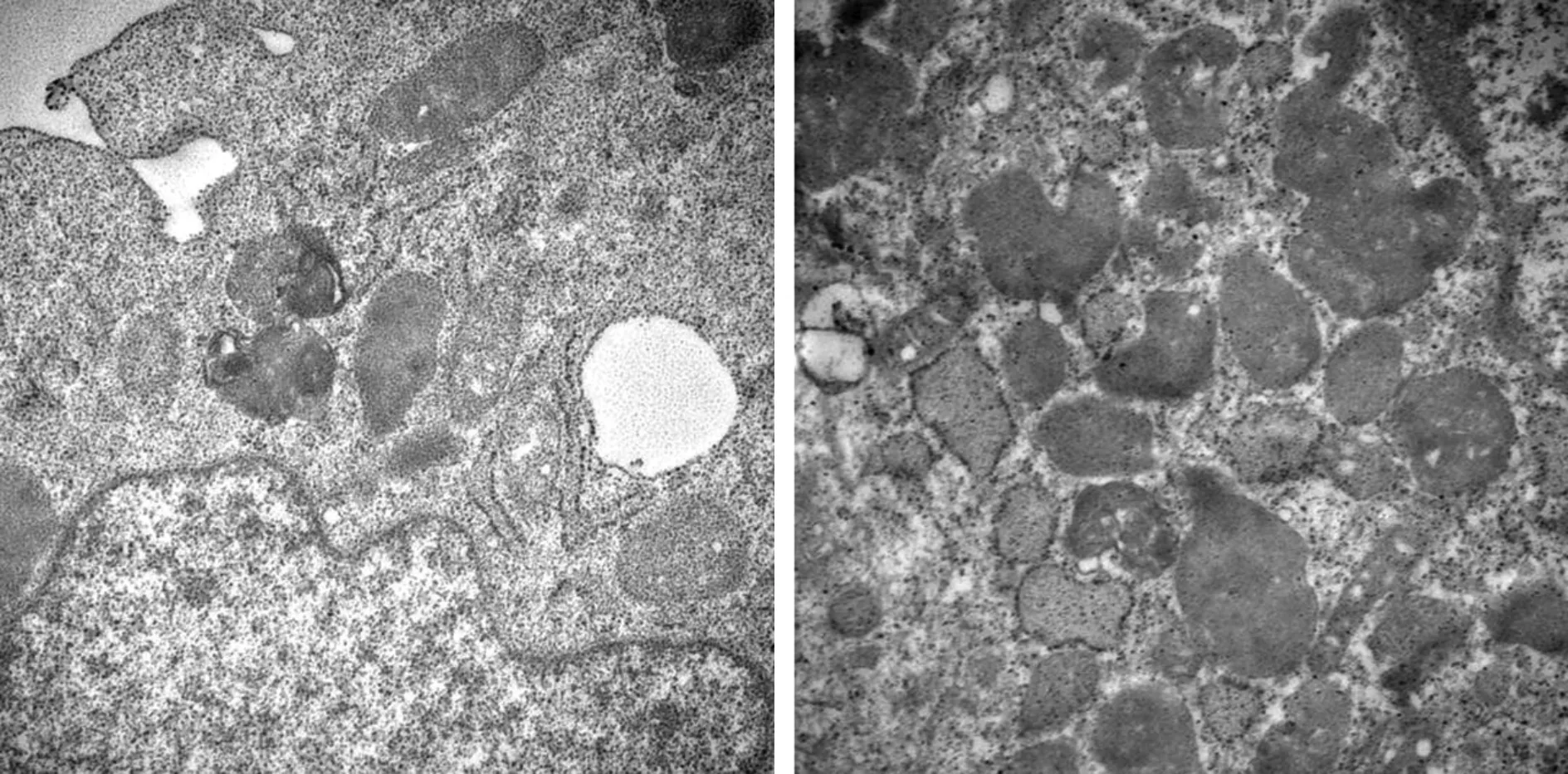
图2 透射电镜比较对照组和模型组H9c2心肌细胞中线粒体结构变化(甲苯胺蓝染色,×30000)
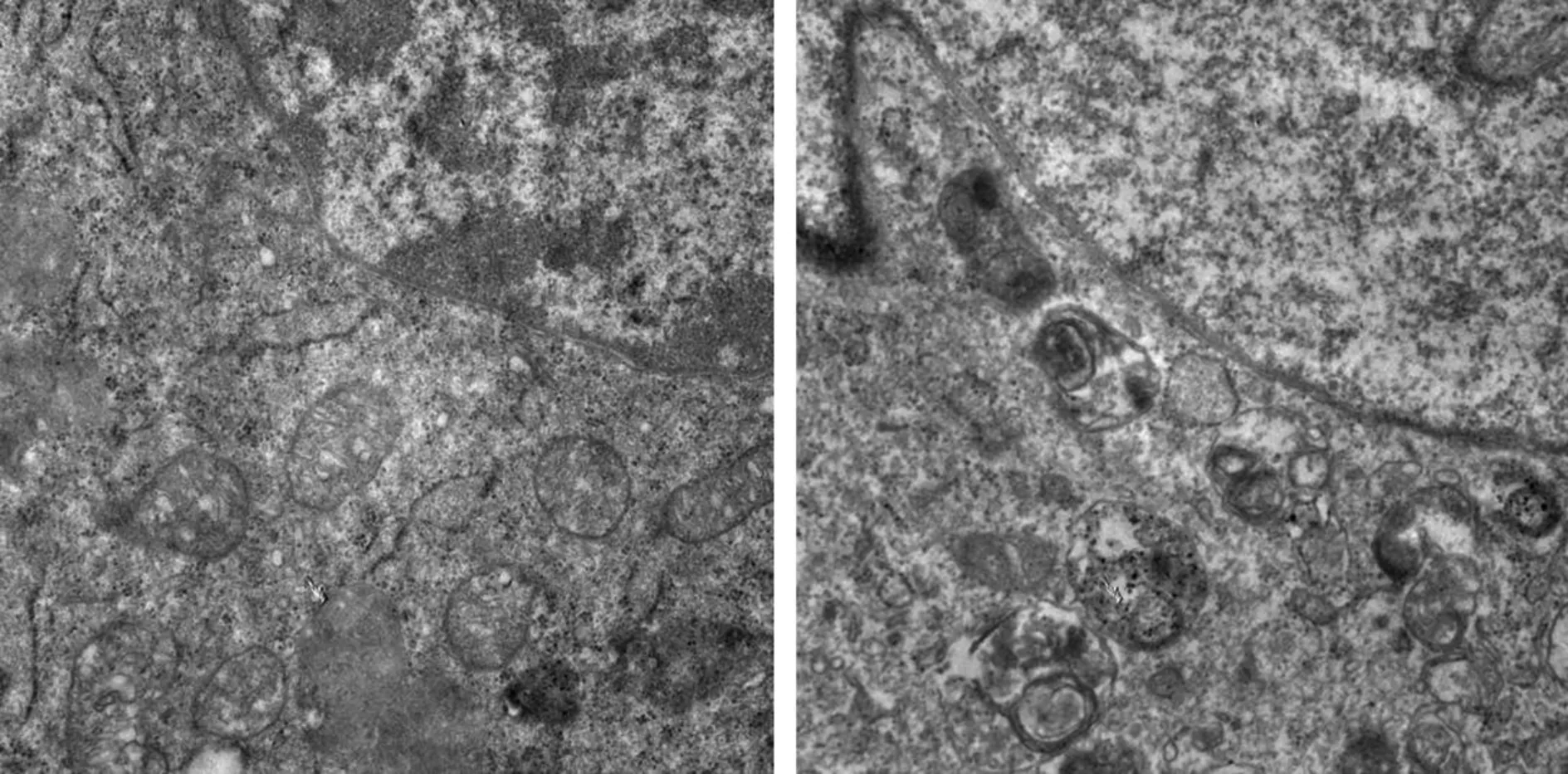
图3 透射电镜比较对照组和模型组H9c2心肌细胞中自噬小体的生成(甲苯胺蓝染色,×3000)
2.3 H9c2细胞中ATP、ROS的改变 与对照组[(1.707±0.022)nmol/mg ATP]相比,模型组[(0.044±0.003)nmol/mg]ATP含量显著减少(P<0.01)。ROS荧光探针标记实验显示,相比对照组,模型组DCF荧光明显增强(图4)。DCF荧光强弱与线粒体ROS活性成正相关,实验显示,模型组ROS水平明显增加。
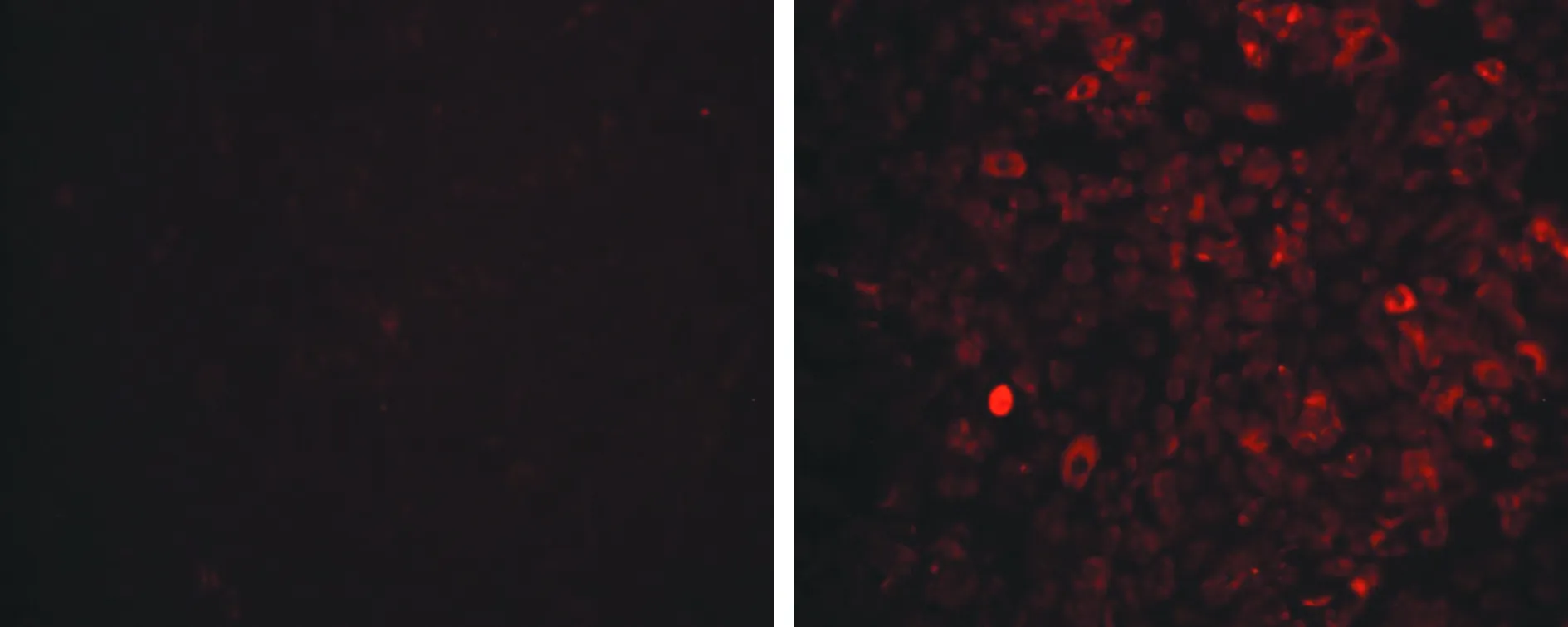
图4 荧光显微镜下,对照组与模型组H9c2细胞中ROS(红色荧光)表达水平(甲苯胺蓝染色,×200)
2.4 H9c2心肌细胞凋亡的改变 对照组凋亡H9c2细胞(4.8%±1.04%)比模型组(7.1%±2.43%)H9c2细胞凋亡率有增加趋势,比较无统计学差异(P>0.05)。如图5所示,相比对照组,模型组凋亡H9c2细胞增加,死亡H9c2细胞明显增加。
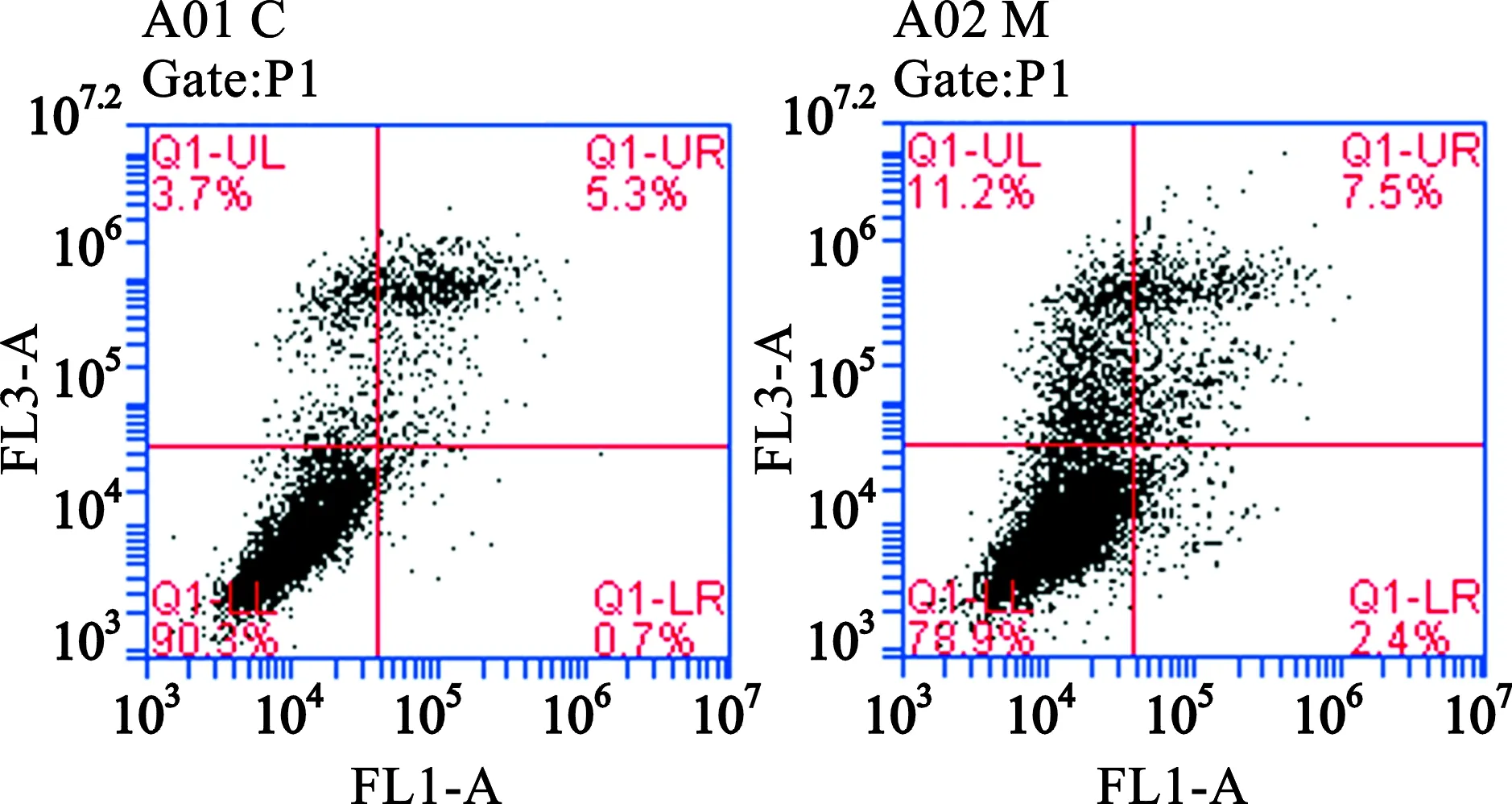
图5 流式细胞术比较对照组和模型组H9c2细胞凋亡细胞数量
3 讨 论
我们的实验探索了戊巴比妥钠在不同药物浓度及作用时间下,对大鼠H9c2心肌细胞形态、亚细胞形态、超微结构、ATP、ROS、凋亡等方面的影响,从而诱导心衰的机制[11]。实验结果表明,戊巴比妥钠使H9c2细胞线粒体结构及功能受损,下降ATP、ROS水平,使自噬小体及凋亡细胞增加。从而使H9c2心肌细胞存活率降低,细胞形态出现较大变化,继而心肌细胞搏动停止,从而导致心衰。
心衰的机制被认为与线粒体能量代谢相关,心脏仅约占体重的5%,却占ATP消耗量的18%[12-13],戊巴比妥钠被报道明显抑制心肌细胞线粒体钾通道[4,13],从而损伤心肌细胞。我们的实验由电镜直接观察戊巴比妥钠对心肌细胞线粒体的损伤,并定量证明戊巴比妥钠降低心肌细胞的ATP含量[14]。同样,戊巴比妥钠曾被报道降低心脏的左心室压和左室收缩压,减慢心率,抑制心肌细胞缩短幅度,降低心肌细胞的存活率[15],抑制心脏肌层的线粒体ATP酶活性[16]。这些发现与我们的ATP实验结果一致。
戊巴比妥钠对凋亡的作用已被报道[8,17-19],但对心肌细胞的凋亡作用尚未报导。我们实验表明,戊巴比妥钠诱导H9c2细胞凋亡。戊巴比妥钠对自噬作用尚未报道,我们从电镜下观察到戊巴比妥钠促进H9c2细胞自噬小体生成,为戊巴比妥钠在凋亡方面的作用提供证据。
综上所述,本实验成功构建了戊巴比妥钠诱导心衰相关的大鼠H9c2心肌细胞损伤模型,并明确了戊巴比妥钠对H9c2细胞形态、线粒体形态、ATP能量消耗、ROS氧化应激、凋亡、自噬方面的作用。但为得到更确切的研究结论,尚需更进一步详细的实验。

