三七通舒胶囊通过增加TRPC6表达减轻大鼠脑缺血再灌注损伤
王菁 王博 江斌 郑坤木 肖乃安
脑卒中目前排在人类致死病因的第二位[1],缺血性脑卒中是其主要组成部分,不断探索其治疗方案意义重大。TRPC6是一种非选择性阳离子通道蛋白,广泛存在于中枢神经系统中[2]。有研究表明在神经元中活化的TRPC6可以磷酸化环磷腺苷效应元件结合蛋白(cAMP-response element binding protein,CREB),从而起到神经元保护作用[3-4]。然而,当脑缺血性卒中引起的脑缺血再灌注损伤发生时,异常激活的钙蛋白酶(calpain)大量降解TRPC6,加重脑缺血再灌注损伤[5]。而增加TRPC6的表达可以保护缺血神经元[6-11]。三七通舒胶囊的主要活性成分三七三醇皂苷(panaxtriol saponins,PTS)临床上具有改善脑缺血功能障碍的作用,然而,其中机制尚未明确[12-14]。在本研究中,我们假设三七通舒胶囊可以抑制TRPC6降解,减轻脑缺血再灌注损伤,并在大鼠模型中得到验证。
1 材料与方法
1.1 一般材料
三七通舒胶囊是由黑龙江中医药大学提供的,基于药品生产质量管理规范(good manufacture practice of medical products,GMP)生产的一种胶囊形式中成药。在本研究中,我们使用胶囊内黄棕色粉末,以方便大鼠灌胃给药。三七通舒胶囊是五加科人参属植物三七[Panax notoginseng(Burk.)F.H.Chen]的根及根茎精制加工而成的干燥提取物,已收载入《欧洲药典》和《德国药典》,制备方案编入新版《德国药品法典/新处方规范》(Deutscher Arzneimittel-Codex/ Neues Rezeptur-Formulation,DAC/NRF)中 的“精制三七干燥提取物”专论(方案编号:N-185)。制备方法:以三七为原料,经过60%的乙醇提取,再经适宜的离子交换树脂(注:即指《中国药典》三七三醇皂苷标准中所述的大孔吸附树脂)精制而成。鉴别方法及结果:我们采用薄层色谱法(thin-layer chromatography,TLC)分析提取物,结果显示与标准PTS相比,纯度达0.997(图1)。主要成分为:人参皂苷Rg1(C42H72O14;Mr:837),约占60%;人参皂苷Re(C48H82O18;Mr:947),约占6%;三七皂苷R1(C47H81O18;Mr:934),约占15%,总量按干品计算不低于54.0%。
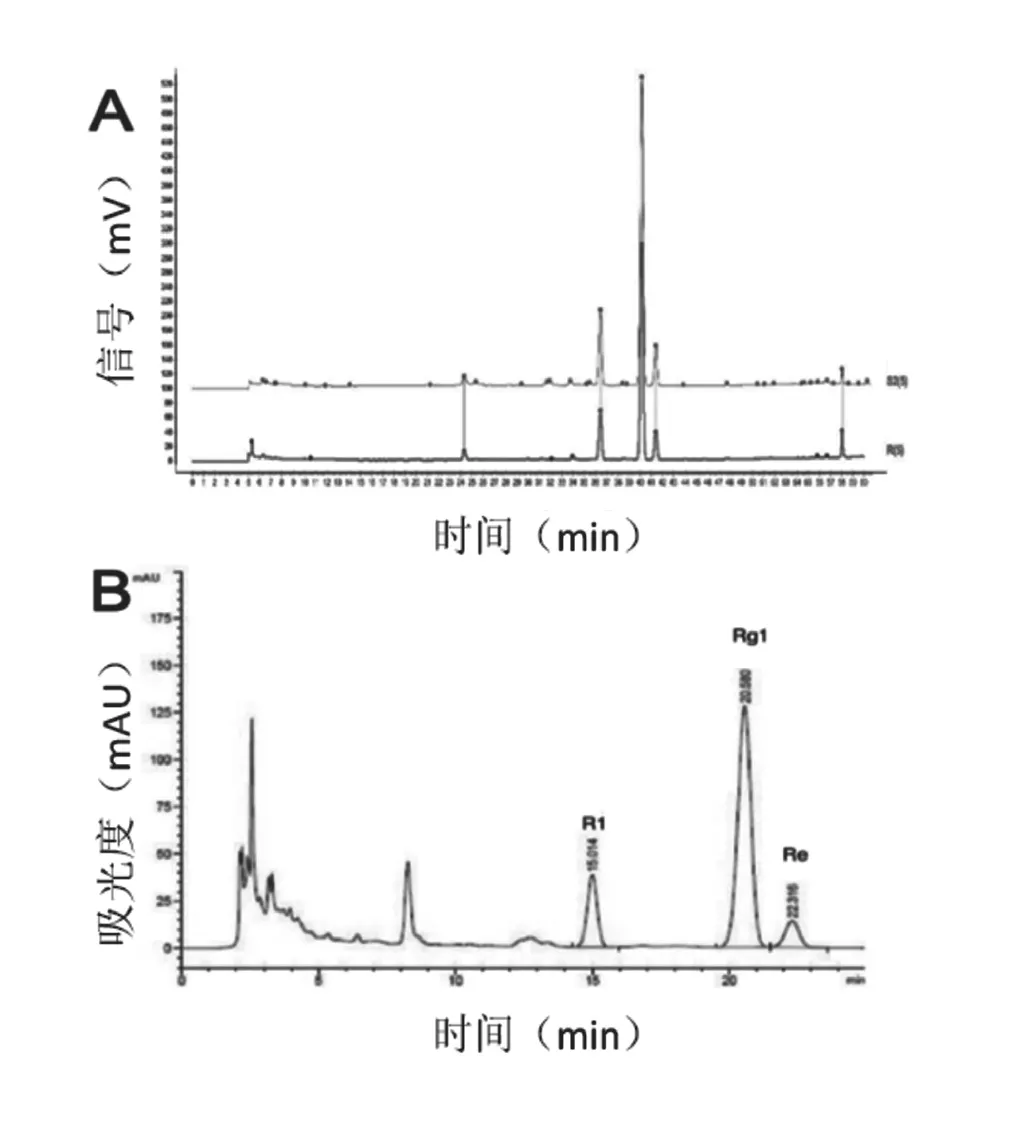
图1 三七通舒胶囊的指纹图谱(A)和高液相色谱法分析(B)注:(A)三七通舒胶囊与标准PTS的指纹图谱,S2(5)代表三七通舒胶囊,R(5)代表标准PTS;(B)人参皂苷Rg1(保留时间=20.580 min),人参皂苷Re(保留时间=22.315 min),三七皂苷R1(保留时间=15.014 min)。
1.2 动物处理
所有动物实验均严格遵守哈尔滨医科大学动物伦理委员会的伦理标准安全有效进行。健康清洁级Wistar雄性大鼠由哈尔滨医科大学附属第二临床医学院动物实验中心提供。分组:将54只大鼠(250~300 g)随机分成两组(手术后3 d组及7 d组),每一组再分成三个亚组(n=9):(1)假手术组(Sham 3和Sham 7);(2)脑缺血再灌注损伤组(I/R injury 3和I/R injury 7);(3)三七通舒胶囊治疗组(PTS+I/R injury 3和PTS+I/R injury 7)。给药:将三七通舒胶囊与生理盐水混合成悬浊液,配比为166 mg∶1 mL,新鲜配置。三七通舒胶囊治疗组大鼠术后每天灌胃给药剂量为4 mL/kg。同时相同体积的生理盐水作为空白对照给予假手术组和脑缺血再灌注损伤组大鼠。第一次给药时间为造模成功后即刻,最后一次给药时间为实验终止(处死)前6 h[15]。
1.3 局部脑缺血再灌注损伤造模
大鼠局部脑缺血模型采用线栓法阻断大鼠大脑中动脉(MCAO)。方法:将大鼠用3%戊巴比妥钠腹膜下注射麻醉(40 mg/kg)后,经大鼠颈中间切口,依次钝性分离右颈总动脉,颈外动脉及颈内动脉。离断颈外动脉远端。将线栓(生产厂家:广州佳灵生物技术有限公司;批号:L3600)从离断的颈外动脉远端缓慢插入颈内动脉,直至感到阻力停止插入(此时预示线栓已抵达大脑中动脉近端)。放置线栓2 h,完成脑缺血造模。2 h后移除大鼠脑内线栓。假手术组大鼠需完成除线栓插入外以上所有步骤。大鼠麻醉苏醒后需立即采用Zea-Longa法评估神经功能[16]。大鼠神经功能缺损评分在2~3分时,被认为造模成功,可以用于后续实验。
1.4 神经功能评分
使用大鼠改良的神经功能评分(modified neurological severity score,mNSS)法对各组大鼠造模前及造模后每天同一时间(0~7 d)进行双盲评分[17],且评分人员不参与本研究其他部分。神经功能缺损程度从0~18分进行标识(0分为正常,18分为最严重)。每增加一分代表实验不成功或实验中神经功能的低反应性。
1.5 相对脑梗死体积检测
每组大鼠终止实验(处死)后,即刻取出大脑并迅速置于-80℃冰箱冰冻15分钟。随后将新鲜冷冻大脑冠状位切成6片约2 mm厚的薄片。将切片至于1% 2,3,5-三苯基氯化四氮唑(2,3,5-triphenylterazolium chloride,TTC)(生产厂家:Sigma-Aldrich;批号:T8877)中37℃孵育20分钟染色,取出后至于4%多聚甲醛(生产厂家:上海生工生物工程股份有限公司;批号:A500684-0500)中固定过夜。第2天将切片取出排序并拍照。梗死部分的脑组织因无法染色呈现白色。使用Image J(美国国立卫生研究院)软件对切片照片进行分析。为了规避梗死组织脑水肿对于脑体积的影响,我们采用相对脑梗死体积百分比(I%)来表示梗死范围。计算公式为:I%=(左侧脑切片体积-右侧脑切片正常部分体积)/左侧脑切片体积×100%。
1.6 免疫荧光
每组大鼠终止实验(处死)前进行深度麻醉后经心脏依次灌注150 mL生理盐水和4%多聚甲醛60 mL。灌注成功后迅速断头取脑,将大鼠脑组织至于4%多聚甲醛中固定过夜。将固定后的脑组织置于梯度蔗糖溶液中脱水处理。之后用O.C.T(opti-mum cutting temperature compound,OCT)包埋剂(生产厂家:SAKURA Tissue-Tek;批号:4583)将脱水脑组织进行包埋处理。将包埋后的脑组织置于冰冻切片机(美国Leica公司)中冠状位切片(8 μm),用5% BSA(生产厂家:上海生工生物工程股份有限公司;批号:E661003)封闭10分钟,PBS(生产厂家:上海生工生物工程股份有限公司,批号:E607008)冲洗1遍,滴加一抗:TRPC6多克隆抗体(生产厂家:Millipore;批号:AB5574)1:100和NeuN单克隆抗体(生产厂家:Millipore;批号:MAB377)1:200放入湿盒内4℃封闭过夜,PBS冲洗后滴加二抗:Alexa Fluor 488山羊抗兔IgG(生产厂家:ThermoFisher Scientific;批号:A-10680)1:500和Texas Red-X 山羊抗鼠IgG(生产厂家:ThermoFisher Scientific;批号:T-862)1:500,室温孵育1小时。待脑片干燥后加入荧光抗淬灭封片液封片。使用倒置荧光显微镜(美国ZEISS公司)观察,Nikon E800相机拍片。
1.7 Western Blot检测脑组织中TRPC6蛋白水平
按照Ashwal方法准备待测大鼠脑组织[18]。将大鼠病变侧脑皮质置于RIPA裂解液(按1:100加入蛋白酶抑制剂混合物)(生产厂家:上海碧云天生物技术有限公司;批号:P0013B)中裂解后放入高速组织研磨仪(雷蒙生物科技)匀浆1分钟。样本放置于水平摇床(美国VWR公司)上在4℃条件下充分裂解过夜后置于离心机(美国Beckman Coulter公司)内,1 3500 r/分钟,4℃离心15分钟。小心留取上清液,并使用BCA蛋白浓度测定试剂盒(生产厂家:上海碧云天生物技术有限公司;批号:P0012S)测定蛋白浓度。蛋白样本经聚丙烯凝胶电泳后用PVDF膜(生产厂家:Millipore)进行转膜。将膜置于TRPC6抗体(生产厂家:美国Signalway Antibody公司;批号:24445)1:1000及α-tubulin(生产厂家:上海碧云天生物技术有限公司;批号:AT819)1:1 000抗体中4℃孵育过夜后分别置于事先配好的辣根过氧化物酶标记山羊抗兔IgG抗体(生产厂家:上海碧云天生物技术有限公司;批号:A0208)1:5 000及辣根过氧化物酶标记山羊抗大鼠IgG抗体(生产厂家:上海碧云天生物技术有限公司;批号:A0192)1:10 000中。最后使用ChemiDocXRS+Chemiluminescence图像系统(Bio-Rad)检测样本中标记的蛋白,并使用Image Labimage Acquisition and Analysis软件分析各条带的灰度值。
1.8 统计学分析
所有数据都用GraphPad Prism 5(美国)进行统计分析,并以(±s)表示。mNSS使用双因素方差分析和Bonferroni correction进行后处理。其余组间比较均使用单因素方差分析和Tukey's post hoc test进行后处理。P<0.05则差异有统计学意义。
2 结果
2.1 三七通舒胶囊治疗对脑缺血再灌注损伤大鼠神经功能缺损程度的作用
首先使用mNSS评分系统评估大鼠术前(0 d)及术后每天(1~7 d)的神经功能,如图2所示。随着术后时间延长,与脑缺血再灌注损伤组(I/R injury)相比,三七通舒胶囊治疗组(PTS+I/R injury)的神经功能评分下降幅度更大,二者评分在术后第4天开始呈现显著差异,第7天最为显著。说明三七通舒胶囊治疗组的大鼠神经功能缺损程度降低,且距离术后时间越长相较越显著。
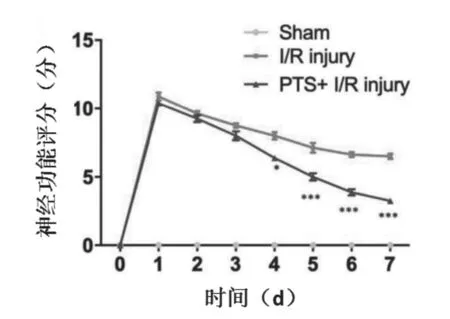
图2 模型大鼠的mNSS评分结果(n=9)
2.2 三七通舒胶囊治疗对脑缺血再灌注损伤大鼠相对脑梗死体积的影响
术后3 d和术后7 d模型大鼠的大脑切片TTC染色结果如图3 A和B所示。与假手术组相比,脑缺血再灌注损伤组和三七通舒胶囊治疗组的相对脑梗死体积均显著增加。而无论术后3 d还是7 d,三七通舒胶囊治疗组大鼠的相对脑梗死体积均较脑缺血再灌注损伤组显著减少。
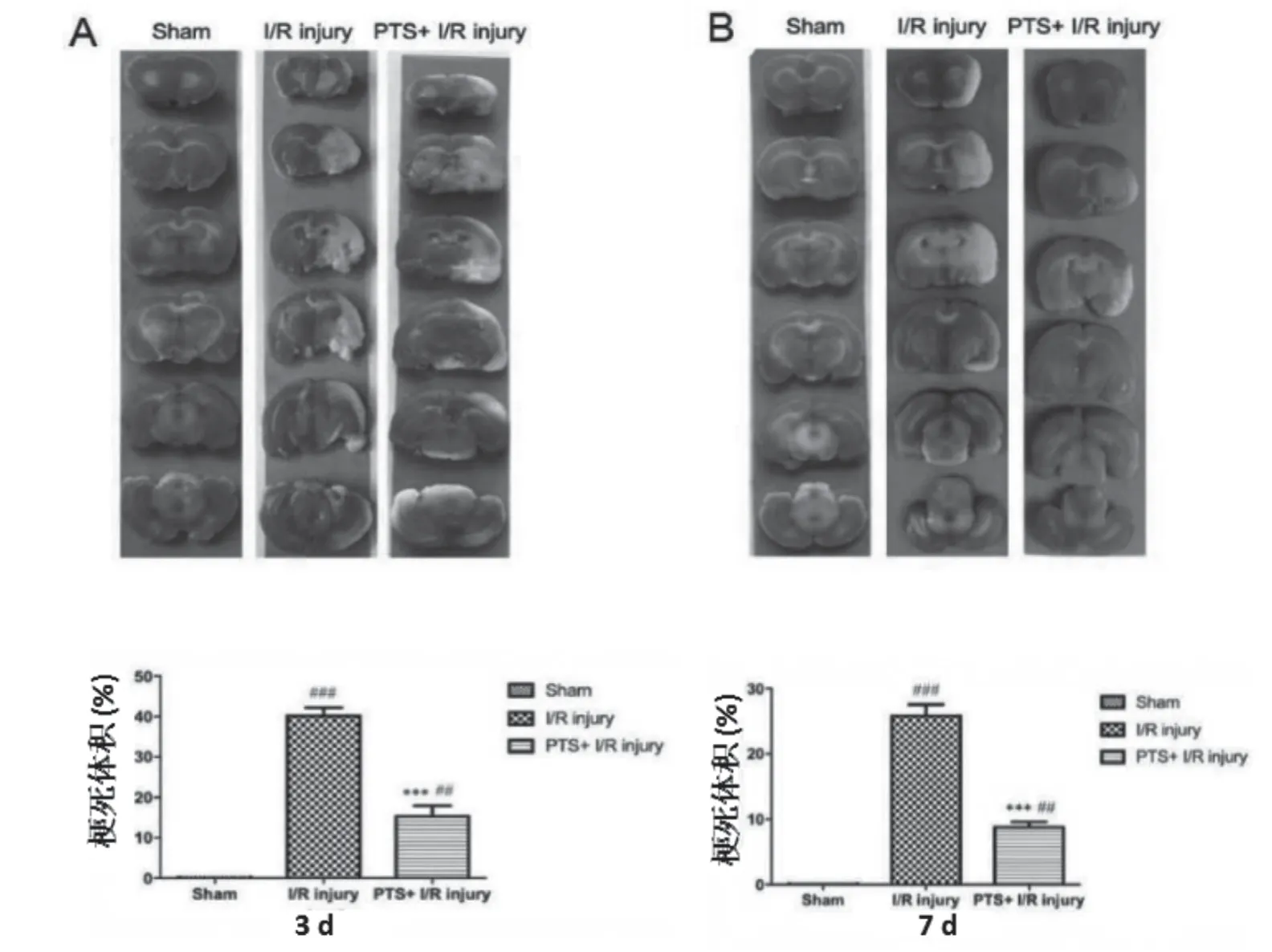
图3 术后3 d(A)和7 d(B)模型大鼠的相对脑梗死体积(n=3)
2.3 三七通舒胶囊治疗对脑缺血再灌注损伤大鼠皮层神经元中TRPC6的表达水平的调控
术后3 d和7 d大鼠病变区域神经元中TRPC6表达的免疫荧光检测结果见图4A和B:与假手术组相比,脑缺血再灌注损伤组及三七通舒胶囊治疗组的病变区域神经元中TRPC6的表达均显著减少;术后第7天时三七通舒胶囊治疗组的神经元中TRPC6的表达量较脑缺血再灌注损伤组显著增加(图4B),而术后第3天时二者并无显著差异(图4A)。免疫印迹检测结果如图4C和D所示:在术后第7天,三七通舒胶囊治疗组病变侧脑组织中的TRPC6蛋白水平较脑缺血再灌注损伤组显著增加(图4D),而术后第3天二者并无显著差异(图4C)。因此,我们认为三七通舒胶囊治疗可以提高脑缺血再灌注损伤大鼠皮层神经元中TRPC6的表达。
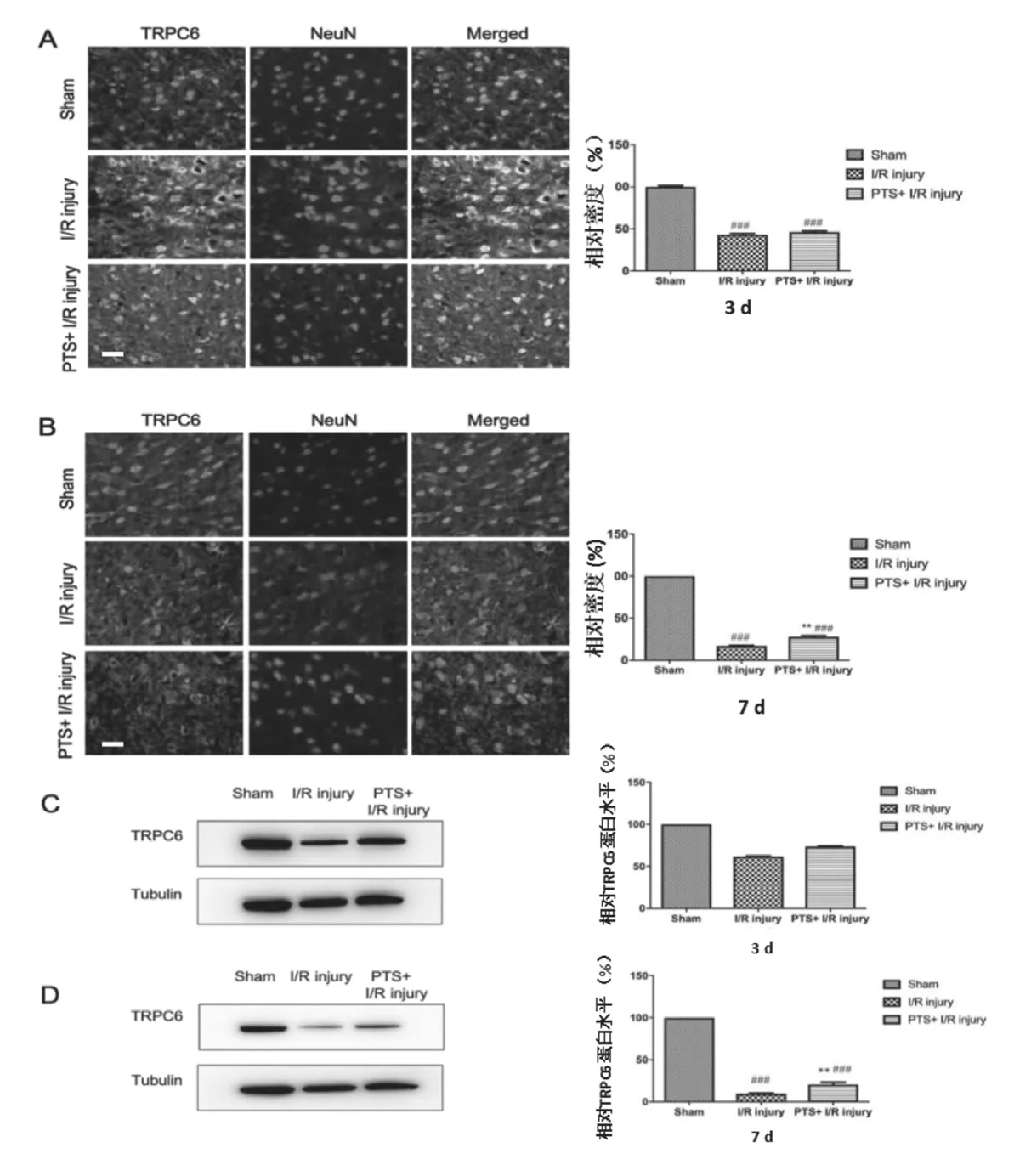
图4 模型大鼠皮层神经元中TRPC6的表达水平
3 讨论
缺血再灌注损伤是缺血性脑卒中病理生理过程的关键环节,针对这一过程是缺血性脑卒中治疗措施研究中的焦点。我们的动物实验研究表明三七通舒胶囊治疗大鼠脑缺血再灌注损伤可以显著改善神经功能,特别是缺血再灌注损伤3 d以后。相对应的,我们同时也发现三七通舒胶囊治疗的大鼠在脑缺血再灌注损伤3 d和7 d后,相对梗死体积均较脑缺血再灌注损伤组减少,这与神经功能评分结果相互印证,说明三七通舒胶囊治疗可以降低大鼠脑缺再灌注引起的神经功能损伤。随后,我们通过实验进一步探讨了其作用的可能机制。在大鼠脑切片的免疫荧光实验中,我们发现在缺血再灌注损伤7 d后,三七通舒胶囊治疗组大鼠脑梗死区神经元的TRPC6蛋白表达较脑缺血再灌注损伤组明显增加,而Western Blot结果也表明,在术后第7天,三七通舒胶囊治疗组梗死区脑组织中的TRPC6蛋白水平较脑缺血再灌注损伤组显著增加。因此,我们认为三七通舒胶囊可能的作用机制之一是通过提高脑缺血再灌注损伤神经元中TRPC6的表达,从而提高机体对脑缺血的耐受程度。
综上所述,我们的结果证明了三七通舒胶囊可以降低大鼠脑缺再灌注损伤,并探究了其中可能的机制之一是三七通舒胶囊可以通过提高缺血再灌注损伤神经元中的TRPC6表达水平,从而起到保护神经元的作用。这将为三七通舒胶囊在临床治疗缺血性脑卒中提供坚实的理论基础。

