利用重组大肠杆菌和马克斯克鲁维酵母高效催化合成D-阿洛酮糖
袁堂国,李益民,杜聪,冯延宾,范超,洪皓,袁文杰*
1(大连理工大学 生物工程学院,辽宁 大连,116024)2(大连医诺生物股份有限公司,辽宁 大连,116600)
D-阿洛酮糖(D-核糖-2-己酮糖)是D-果糖的碳-3差向异构体,是一种稀有的单糖,在自然界中天然存在[1]。D-阿洛酮糖因其特殊的营养价值受到了国内外的广泛关注。在医药领域,其降血脂、降血糖和抗氧化的功能引起了重视[2-4];在食品领域,其甜度相当于蔗糖的70%,热量相当于蔗糖的0.3%,可做为一种健康、安全的甜味剂使用[5]。但D-阿洛酮糖在自然界中含量很低,采用化学法合成D-阿洛酮糖,萃取分离步骤比较复杂[6]。而生物转化策略,是一种前景广阔、环境友好的D-阿洛酮糖生产方法[7-8]。
目前,生物法生产D-阿洛酮糖主要是通过D-阿洛酮糖3-差向异构酶(D-allulose 3-epimerase,DAEase)家族酶转化D-果糖生成。在重组大肠杆菌表达体系中,不同来源的DAEase转化D-果糖生成D-阿洛酮糖的得率均不超过33%,D-阿洛酮糖与D-果糖的平衡参数从20∶80到33∶67[9]。此外,DAEase家族酶热稳定性较差,虽然大多数酶在低于50 ℃的条件下具有较好的热稳定性,但在超过50 ℃的条件下迅速失活,Clostridiumsp.来源的DAEase的半衰期仅有15 min。酶的长时间稳定使用是阿洛酮糖生产中需要解决的重要问题之一。文献中报道,金属离子可以有效稳定DAEase的构象,且最适离子通常是Mn2+或Co2+[9-10]。
以全细胞作为生物催化剂,可以避免酶的分离纯化步骤,如细胞裂解、沉淀,而且酶的热稳定性和对环境的抗干扰能力比自由酶更优[11-12],适于D-阿洛酮糖的生物合成。例如,来源于Agrobacteriumtumefaciens的DAEase重组大肠杆菌表达体系在50 ℃、pH 8.0、底物质量浓度为700 g/L的催化条件下,阿洛酮糖的转化率可以达到32.9%。还有研究者将葡萄糖异构酶和DAEase构建到同一个表达载体中,利用重组大肠杆菌将D-葡萄糖异构化为D-果糖,然后再将产物D-果糖异构化为D-阿洛酮糖[13]。但是D-阿洛酮糖转化率偏低,导致该工艺生产成本仍居高不下。
底物和产物的纯化成本较高,也是限制D-阿洛酮糖在市场上广泛应用的原因。从D-果糖中分离D-阿洛酮糖是一个复杂的过程,目前文献报道的主要有3种方法:利用模拟移动床层析和阴离子交换树脂基质[14-16],但需要复杂的设备和较高的设备投入;通过葡萄糖异构酶和葡萄糖氧化酶将D-果糖转化为葡萄糖酸[10],通过改变物质的物理和化学特性的差异来进行分离;使用耐高温的重组马克斯克鲁维酵母发酵剩余果糖来降低D-阿洛酮糖的分离难度[17]。
综上,为进一步提高全细胞催化果糖生产D-阿洛酮糖的转化率,并降低分离难度,本文提出了一种低成本的D-阿洛酮糖两阶段生产工艺。在大肠杆菌中表达了来源于Flavonifractorplautii的DAEase,使用该重组菌在添加硼酸的情况下高效转化果糖后,利用马克斯克鲁维酵母菌Y179发酵剩余的D-果糖生产乙醇。本研究为D-阿洛酮糖的高效、低成本生产提供了参考。
1 实验材料和方法
1.1 材料和操作方法
Flavonifractorplautii来源的DAEase的基因序列(GenBank:CP048436.1),根据大肠杆菌中密码子的偏好性进行了优化,由上海生工生物技术有限公司完成,连接至pET29a,构建了表达质粒pET29a-DAEase。
以大肠杆菌DH5α为宿主菌株进行质粒保存,以大肠杆菌BL21(DE3)为宿主菌株进行DAEase目标蛋白表达。发酵阶段利用马克斯克鲁维酵母(Kluyveromycesmarxianus) Y179将剩余的D-果糖转化为乙醇。
大肠杆菌重组菌株在含有50 mg/L卡那霉素的LB培养基中振荡培养,在37 ℃、180 r/min条件下生长12 h。取5 mL菌液接种于含50 mg/L卡那霉素的250 mL三角瓶中,37 ℃,180 r/min条件下扩大培养。当细胞生长状态OD620值达到0.6时,加入终浓度是0.04 mol/L的诱导剂IPTG,18 ℃、180 r/min振荡培养16 h,诱导DAEase的表达。通过离心(12 000 r/min,15 min,4 ℃)的方法收集菌体。
1.2 细胞干重和细胞裂解情况的测定
将诱导的重组大肠杆菌离心回收(12 000 r/min,15 min)获得湿菌体,然后将离心获得的湿菌体放入85 ℃烘箱中烘干,24 h后称量菌体的质量,获得湿重与干重的关系。
本研究是利用重组大肠杆菌全细胞进行催化反应,为了检测重组细胞在反应过程中的裂解情况,通过离心收集65 ℃,60 min反应后的上清液,使用Bradford蛋白浓度测定试剂盒测定上清液中蛋白质的含量。将上清液中蛋白质的含量与利用超声破碎离心获得的上清液蛋白质含量的百分比来计算细胞的裂解率。
1.3 pH、温度、金属离子对重组全细胞催化速率的影响
为了研究重组大肠杆菌的最适反应pH,在含有质量浓度200 g/LD-果糖的Tris-HCl缓冲液中(不同pH)进行反应,65 ℃条件下反应10 min后利用金属浴在99 ℃条件下加热灭活10 min,测定D-阿洛酮糖的生成速率来反映重组全细胞催化活性。
对于重组大肠杆菌的最适反应温度的确定,通过检测在含有200 g/LD-果糖的Tris-HCl缓冲液(pH 7.5)中不同温度(50~75 ℃)条件下的催化速率,确定最佳反应温度,反应10 min后加热灭活,检测样品中产物D-阿洛酮糖的浓度。
在探究金属离子对全细胞催化速率的影响时,将重组大肠杆菌重悬在含有不同金属离子的Tris-HCl缓冲液中,在4 ℃冰箱中孵育2 h,pH 7.5、65 ℃反应10 min后加热灭活,检测产物D-阿洛酮糖的浓度。
为了研究温度对酶稳定性的影响,考察了添加与不添加Co2+条件下全细胞催化活性。将回收的重组细胞重悬在Tris-HCl缓冲液(pH 7.5)中,60 ℃条件下放置2 h,在一定时间间隔下提取样品,加入终质量浓度200 g/LD-果糖,在pH 7.5、65 ℃条件下反应10 min后灭活,检测产物D-阿洛酮糖的浓度,确定剩余的酶催化活性。
D-阿洛酮糖浓度采用HPLC检测,使用Ca2+色谱分离树脂交换柱,柱温80 ℃,超纯水洗脱,流速0.4 mL/min。
1.4 细胞浓度对重组全细胞催化速率的影响
将不同质量浓度(0.3~3 g/L,细胞干重)的重组大肠杆菌细胞加到一定质量浓度(200 g/L)的D-果糖下测定D-阿洛酮糖的转化结果。Tris-HCl体系中65 ℃反应60 min,通过HPLC检测D-阿洛酮糖的生成情况。
1.5 缓冲体系对重组全细胞催化速率的影响
将诱导表达的重组大肠杆菌细胞置于Tris-HCl、超纯水、PBS和Glycine-NaOH缓冲液中,65 ℃反应60 min,采用HPLC检测D-阿洛酮糖的产量。
1.6 硼酸存在对重组全细胞催化速率的影响
将一定量的重组大肠杆菌细胞分别添加到含有D-果糖400 g/L、硼酸68.6 g/L溶液和含有D-果糖600 g/L、硼酸102.9 g/L的溶液中(D-果糖和硼酸的摩尔比是2∶1),用NaOH溶液调节pH到7.5,在65 ℃条件下反应60 min,通过HPLC检测产物D-阿洛酮糖的产量。
1.7 马克斯克鲁维酵母发酵剩余D-果糖
将重组大肠杆菌全细胞催化反应后的溶液离心除去菌体,获得混合糖溶液,在溶液中加入5 g/L的马克斯克鲁维酵母,180 r/min、37 ℃条件下发酵,消耗剩余的D-果糖,生产乙醇,发酵12 h后补充加入5 g/L的马克斯克鲁维酵母。不同时间段采集样品,采用HPLC检测,ROA有机酸柱(300 mm×7.8 mm,Bio-Rad,Aminex,HPX-87H)进行产物分析,柱温50 ℃,流动相为0.005 mol/L H2SO4,流速0.5 mL/min。
2 结果与分析
2.1 目标基因DAEase的表达分析
通过密码子优化和培养条件优化,在大肠杆菌BL21中实现了DAEase的高水平表达。采用SDS-PAGE分析了DAEase的表达量和分子质量(图1)。结果表明,与不含有载体pET29a-DAEase的菌体比较,构建的重组大肠杆菌在33 kDa左右出现了明显的条带,与DAEase理论值一致。诱导条件为37 ℃、16 h时,沉淀中含有大量的不溶性包涵体,上清液中目的蛋白含量较少;诱导条件为18 ℃时,虽然沉淀中仍有少量目标蛋白,但上清液中的可溶目标蛋白明显增多。因此选择的诱导条件是18 ℃、16 h。在之前的报道中,来自F.plautii的DAEase编码基因在Corynebacteriumglutamicum和大肠杆菌中均能成功表达,但在C.glutamicum中的表达量远低于大肠杆菌。在本研究中,经过密码子优化后,DAEase的表达量比之前文献报道的更高,保证了差向异构化反应更快进行。

M-蛋白marker;1-空载的全细胞(pET29a);2-空载的破碎沉淀(pET29a);3-空载的破碎上清液(pET29a);4-含目的基因的全细胞(pET29a-DAEase);5-含目标基因的破碎沉淀(pET29a-DAEase);6-含目的基因的破碎上清液(pET29a-DAEase);7-含目的基因的全细胞(pET29a-DAEase);8-含目标基因的破碎沉淀(pET29a-DAEase);9-含 目的基因的破碎上清液(pET29a-DAEase)图1 重组大肠杆菌中DAEase的SDS-PAGE分析Fig.1 SDS-PAGE analysis of DAEase in recombinant E.coli 注:1~6菌体的诱导条件是18 ℃、16 h;7~9菌体的 诱导条件是37 ℃、16 h
2.2 温度、pH、金属离子对重组大肠杆菌全细胞催化反应的影响
通过图2-a可知,pH 7.0~8.0时,全细胞催化活性保持在90%以上,最适pH是7.5。全细胞反应的最适温度是65 ℃(图2-b),这些结果与文献报道结果相似。DAEase家族的反应条件属于弱碱性,最适反应温度较高。在考察金属离子对全细胞催化活性的影响时,将未添加金属离子的对照组的催化活性设为100%,通过图2-c可知,加入EDTA会完全抑制DAEase的活性,Cu2+和Ca2+等二价金属离子部分抑制DAEase的活性,Co2+和Mn2+增强了催化活性,特别是Co2+对催化活性的提高更加明显。
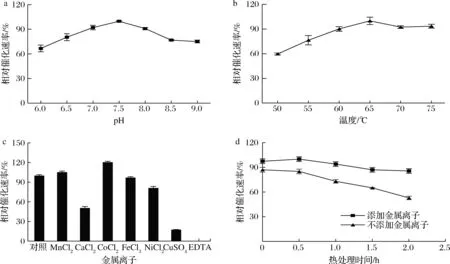
a-pH;b-温度;c-金属离子;d-热稳定性图2 pH、温度、金属离子对重组全细胞催化反应的影响Fig.2 Effects of pH,temperature and metal ions on whole-cell catalytic reactions
在60 ℃下测定了添加和不添加Co2+条件下DAEase的热稳定性。图2-d显示,添加Co2+不仅增强了DAEase的催化活性,而且提高了热稳定性,添加1 mmol/L Co2+,60 ℃下孵育2 h后催化活性仍保持在80%以上。在60 ℃下不添加金属离子,酶的半衰期为2.7 h,比文献报道的其他DAEase半衰期更长,说明来源于F.plautii的DAEase的热稳定性较好,适于高温下的催化反应。
2.3 细胞浓度对重组全细胞催化速率的影响
不同重组细胞浓度对催化效果有明显影响,通过图3可知,反应时间在10、30、60 min,催化反应速率均随着细胞浓度的增加而提高。当添加的细胞质量浓度为2.4或3.0 g/L时,催化速率和转化率几乎一样,反应60 min后,转化率均可达到33%。
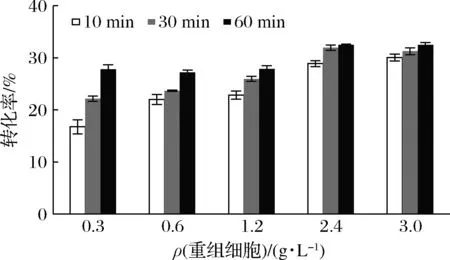
图3 细胞浓度对D-阿洛酮糖生产的影响Fig.3 Effect of cell concentration on the production of D-allulose
为了探究重组细胞(2.4 g/L干重)催化果糖异构化的动力学过程,对阿洛酮糖随反应时间的转化率进行了分析。由图4可知,催化反应60 min后转化率达到33%,随时间的延长,转化率没有明显的提高,说明在60 min时已经达到了反应终点。通过对上清液中存在的蛋白质浓度分析可知,65 ℃下反应60 min后,重组大肠杆菌的裂解率为16%左右。
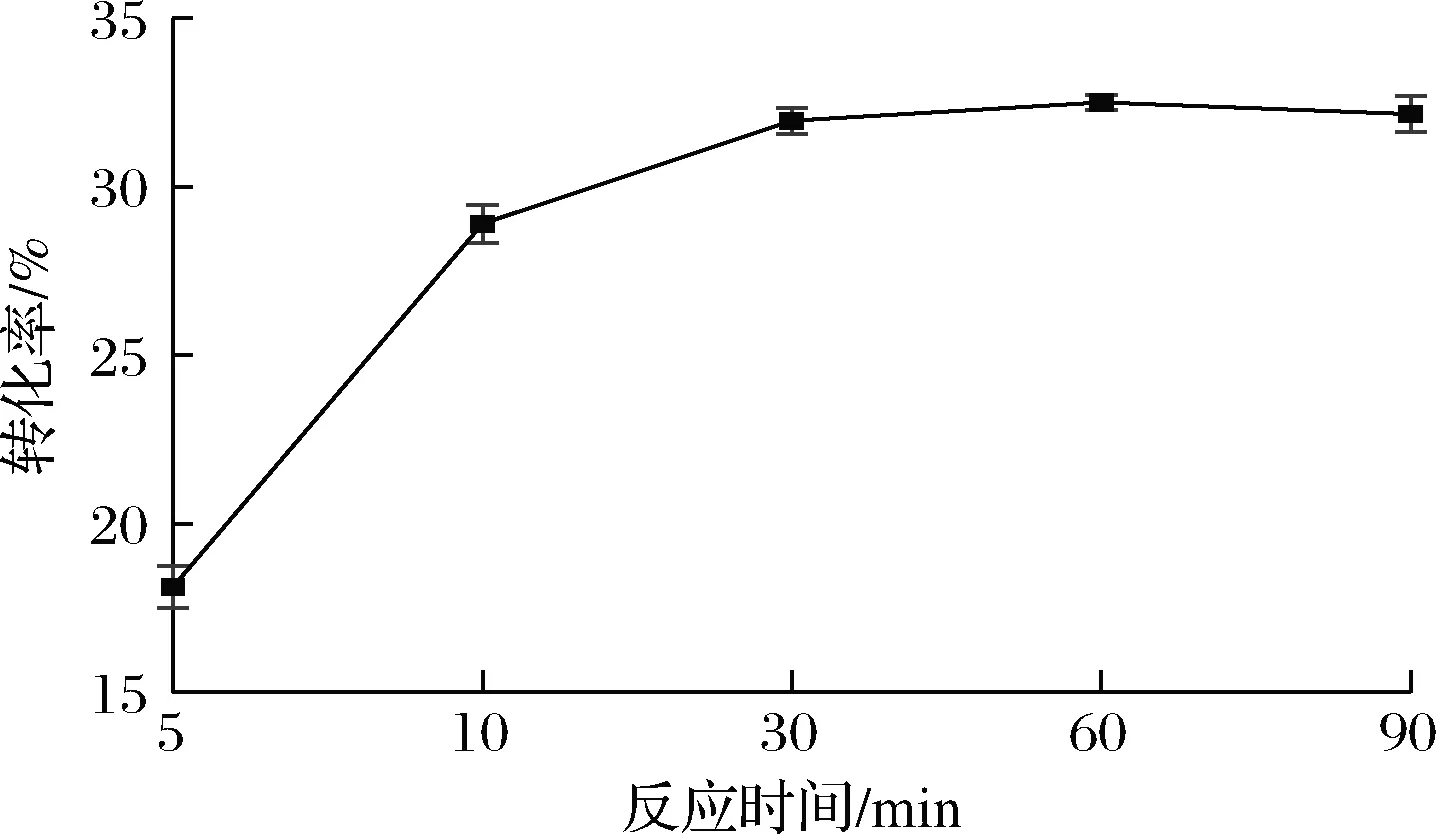
图4 转化率随反应时间的变化Fig.4 Change of conversion rate with reaction time
2.4 缓冲体系对重组全细胞催化速率的影响
不同缓冲体系对催化效果没有明显影响,通过表1可知,在Tris-HCl、PBS、Glycine-NaOH以及超纯水中,阿洛酮糖的最终转化率都可以达到33%,这为接下来的发酵阶段提供了有利的条件。由于重组细胞可以将纯水中的D-果糖有效的转化成D-阿洛酮糖,可以避免额外添加各种离子,简化了生产步骤并降低了分离纯化难度和成本。
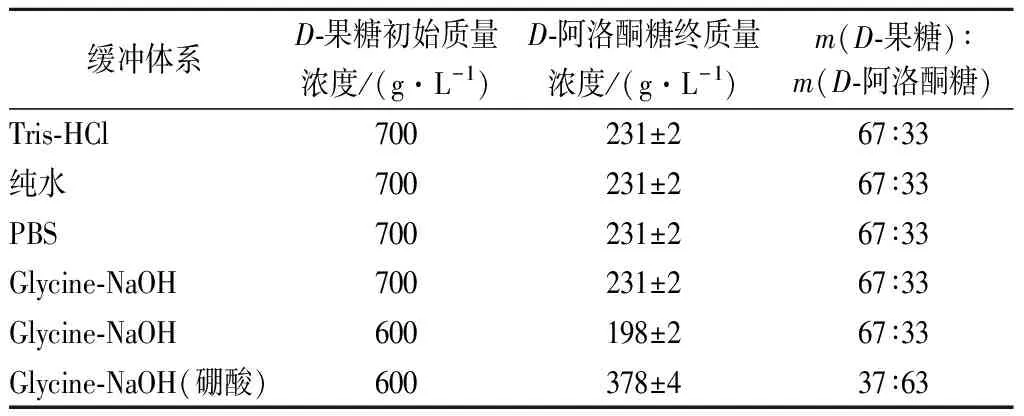
表1 不同缓冲体系下生产D-阿洛酮糖Table 1 Production of D-allulose under different buffer systems
硼酸根可以与多羟基化合物结合形成络合物,其结合能力因糖的种类不同而有所区别。D-阿洛酮糖与硼酸根结合形成的络合物比D-果糖与硼酸根结合形成的络合物更加稳定,所以在催化体系中添加硼酸根有利于反应向生成D-阿洛酮糖的方向移动,从而提高D-果糖的转化率[18-20]。实验结果表明,在含有硼酸根的情况下,当初始底物D-果糖的质量浓度为600 g/L时,产物D-阿洛酮糖的终质量浓度可达到378 g/L(表1),转化率达到了63%。
2.5 马克斯克鲁维酵母发酵剩余D-果糖生产乙醇
由于底物果糖和产物阿洛酮糖是同分异构体,在现有技术条件下分离成本较高[21]。本研究利用马克斯克鲁维酵母将未转化的D-果糖发酵成乙醇,降低D-阿洛酮糖分离纯化难度。实验结果表明,初始200 g/L的D-果糖溶液,在不添加硼酸的条件下,重组大肠杆菌催化完成后,体系中剩余130 g/L的D-果糖,添加5 g/L(干重)的马克斯克鲁维酵母,可以在15 h之内将剩余的D-果糖全部发酵生成乙醇,乙醇质量浓度达到60 g/L,而D-阿洛酮糖的量没有变化(图5-a)。在添加硼酸根的反应体系中,利用重组大肠杆菌完成异构化后,体系中剩余65 g/L左右D-果糖,发酵阶段添加5 g/L马克斯克鲁维酵母,剩余D-果糖也可以全部转化成乙醇,质量浓度为26 g/L。虽然高浓度硼酸会抑制马克斯克鲁维酵母菌的发酵,乙醇发酵速率明显低于不添加硼酸的发酵体系,但异构化阶段剩余的D-果糖也能在18 h内完全发酵生成乙醇(图5-b),发酵前后D-阿洛酮糖的浓度没有明显变化,两种体系的糖醇转化率都在0.4 g/g左右。
本研究中,将硼酸添加到反应体系中促进了阿洛酮糖的生成。由于D-果糖与硼酸的络合能力弱于D-阿洛酮糖与硼酸的络合能力,所以反应向生成D-阿洛酮糖的方向转移[19],D-阿洛酮糖转化率达到了63%(硼酸根与D-果糖的摩尔比1∶2),而不添加硼酸的反应体系转化率仅有33%。添加马克斯克鲁维酵母将剩余果糖用完后,可以将pH调节到酸性条件,解除硼酸根与D-阿洛酮糖的络合,然后通过结晶的方法分离出硼酸根,实现硼酸的重复利用[22]。因此,两阶段生产D-阿洛酮糖的生产工艺,既可以获得高浓度和高转化率的D-阿洛酮糖,又可实现D-果糖的全部利用,降低了D-阿洛酮糖的分离纯化难度和成本。

a-无硼酸根;b-添加硼酸根图5 乙醇、D-果糖和D-阿洛酮糖的浓度随发酵 时间的变化而变化Fig.5 Concentrations of ethanol,D-fructose and D-allulose during fermentation
3 结论与讨论
D-阿洛酮糖因其在食品领域、医药领域特殊的营养价值和生理功能而受到广泛关注。本研究利用不同菌株的全细胞反应,将果糖异构化阶段和发酵阶段分开进行,既提高了阿洛酮糖的转化率,又将剩余的D-果糖全部发酵成乙醇,降低了阿洛酮糖的分离难度。在果糖转化的整个生产过程中,只需要添加重组大肠杆菌和马克斯克鲁维酵母,不需要添加额外的金属离子和氮源。若添加适当浓度硼酸溶液,则有高达63%的D-果糖转化成阿洛酮糖。发酵阶段利用马克斯克鲁维酵母将剩余的D-果糖全部发酵成乙醇,得率为0.4 g/g。本研究可以实现D-果糖的全利用,得到高浓度的不含D-果糖的高纯度D-阿洛酮糖溶液和一定量的乙醇,对阿洛酮糖的低成本工业化生产具有重要的指导意义。

