氧化还原电位调控对Spathaspora passalidarum发酵纤维素水解液的影响
宗晗,杜聪,李益民,袁文杰
(大连理工大学 生物工程学院,辽宁 大连,116023)
传统化石能源面临的问题凸显[1-3],燃料乙醇可作为可再生清洁能源替代化石能源[4]。纤维素乙醇以木质纤维素为原料,来源广泛且充足[5]。《关于扩大生物燃料乙醇生产和推广使用车用乙醇汽油的实施方案》中明确指出,到2025年力争实现纤维素乙醇的规模化生产[6]。
纤维素原料经预处理产生葡萄糖、木糖以及其他单糖[7]。纤维素乙醇目前尚没完成大规模工业化生产,还存在几个挑战。其中,预处理步骤通常会产生各种木质纤维素衍生化合物,如脂肪酸、呋喃衍生物和几种酚类化合物[8]。这些化合物抑制微生物发酵,即使在低浓度时也能抑制细胞的生长[9]。木质纤维素水解液中主要的酸类抑制物有甲酸和乙酸,其中甲酸毒性较大[10]。醛类抑制物有糠醛和五羟甲基糠醛,酚类抑制物主要有香草醛。酸类抑制物导致细胞内酸化[11],进而导致细胞内的ATP含量减少,细胞代谢缓慢甚至死亡[12]。糠醛和5-羟甲基糠醛(5-hydroxymethylfurfural,5-HMF)是水解液中主要的醛类毒性物质,据报道5-HMF可以抑制酵母细胞生长与减少乙醇的产量,有研究表明醛类抑制表现在降低酵母细胞中的蛋白质含量[13]。
能够利用木糖并能有效代谢产生乙醇的微生物,是木质纤维素乙醇工艺成为具有经济竞争力的前提条件[14]。裂殖酵母Pichiastipitis[15],假丝酵母Candidashehatae[16],Kluyveromycesmarxianus[17-18]都可以发酵葡萄糖和木糖,乙醇生产速率和产率远远低于葡萄糖。最近发现的Spathasporapassalidarum是一种存在于木材中的甲虫消化道内的酵母,可以在有氧和无氧条件下发酵木糖,其效率要比P.stipitis的发酵效率更高[19-21]。
研究证明乙醇积累量与通气量呈正相关。S.passalidaram在氧气限制后,比生长速率下降,乙醇生产速率却大幅增加[22]。氧气在酵母发酵过程中并不是越多越好,通入量应该有一个最优值。用氧化还原电位(oxidation-reduction potential,ORP)来表征和控制发酵过程中氧气的通入量,可以找到一个最优设定值使得发酵能力最大。在调控ORP策略下,多种混合抑制物对K.marxianus酵母生长代谢的影响,发现不仅产物浓度显著增加,酵母细胞对玉米秸秆水解液多种抑制物的耐受性也提高了[23-24]。通气量的优化在S.passalidarum发酵不脱毒纤维素水解液中发酵中的作用同样至关重要。
本研究利用天然木糖发酵优势菌株S.passalidarum,以不脱毒纤维素水解液为底物,采用ORP调控和恒定通气2种策略研究微量通气对发酵过程的影响,提高S.passalidarum抑制物耐受性的同时,缩短发酵时间,降低生产成本,为纤维素乙醇的工业化生产提供参考。
1 材料与方法
1.1 材料
1.1.1 实验仪器
酶标仪,Thermo公司;5415R离心机,SIGMA公司;KG-SX-500高压灭菌锅,TOMY公司;Waters 1525高效液相色谱仪,美国Waters公司。
1.1.2 实验试剂
无水葡萄糖、混合糖[m(葡萄糖)∶m(木糖)=1∶1]、酵母浸粉、琼脂粉、木糖醇、蛋白胨、木糖、冰乙酸、无水甲酸、糠醛、丙三醇、5-羟甲基糠醛、无水乙醇。
1.1.3 菌株
(SpathasporapassalidarumATCC MYA-4345),美国菌种保藏中心,实验室保藏编号为1710,由大连理工大学生物工程学院保藏。菌种在40%甘油中于-80 ℃长期保存。
1.1.4 培养基
活化培养基(YPD)(g/L):酵母浸粉10、蛋白胨20、葡萄糖20。121 ℃灭菌 20 min。
种子培养基1:同活化培养基。
种子培养基2(g/L):酵母浸粉10、蛋白胨20、葡萄糖20、木糖10。121 ℃灭菌 20 min。
发酵培养基1(g/L):酵母浸粉5、蛋白胨5、混合糖50[m(葡萄糖)∶m(木糖)=1∶1]。115 ℃灭菌15 min。
发酵培养基2(g/L):酵母浸粉5、蛋白胨5、混合糖50[m(葡萄糖)∶m(木糖)=1∶1]、乙酸1、无水甲酸0.3、糠醛0.4、五羟甲基糠醛0.3、香草醛0.1。115 ℃灭菌15 min。
1.2 实验方法
1.2.1 菌株培养及发酵条件
首先从-80 ℃冰箱中取出菌种1710,经过无菌操作接种到含有约5 mL活化培养基的小瓶中过夜培养12~16 h活化菌体。然后将活化好的菌液取出1 mL接种到装有100 mL种子培养基1的250 mL三角瓶中过夜培养12~16 h进行第一次扩大培养。然后将第一次扩大培养得到的菌液取20 mL接种到装有200 mL种子培养基2的500 mL三角瓶中过夜二次扩大培养。将二次扩大培养得到的菌悬液利用酶标仪测菌体浓度后,收集菌体,然后用生理盐水重悬菌体之后接种到发酵罐,接种后使得装液量2 L的发酵罐(总体积5 L)内菌体浓度OD600约为0.7。然后进行相关发酵实验。
培养条件:温度30 ℃、转速150 r/min。
1.2.2 通气调控
恒定通气策略:发酵罐接种后,打开气泵,通过空气流量计来调节通入发酵罐无菌空气的量,在利用发酵培养基2进行发酵实验时,依次设定通气量分别为0.5、1.0、1.5、2.0 vvm。
ORP调控策略:利用通入无菌空气控制发酵过程ORP稳定在设定值(±2 mV)。探究ORP对无抑制物情况下混合糖(发酵培养基1)发酵的影响时,分别控制ORP为-150、-130、-110 mV;探究ORP对抑制物存在情况下混合糖(发酵培养基2)发酵的影响时,分别设定值为-140、-130、-120、-110、-100、-90 mV;最后探究灭菌及发酵pH的变化对抑制物存在情况下混合糖(发酵培养基2)发酵的影响,设定ORP为最优值。ORP电极(Pt4805-DPAS-SC-K8S/225,Mettler Toledo,Switzerland)监测发酵过程中氧化还原电位变化,并连接至ORP控制仪((pH/ORP Transmitter PC-3100,Suntex,China),当发酵过程中氧化还原电位值低于预设值时,控制仪开启气泵通入无菌空气,直至达到预设值(+2 mV),然后关闭气泵。
1.2.3 发酵底物和产物量的测定
发酵过程中,接种后取样为发酵起始点,测此时生物量,并将样品5 000 r/min离心5 min后留上清液冻存,之后每隔12 h取1次样,重复以上操作,直至发酵结束。
最后通过高效液相色谱检测所存样品中糖以及各种代谢产物浓度的变化。
生物量测定方法:将菌液适当稀释,用酶标仪于波长600 nm 处测定吸光度值记为OD600。
发酵底物和产物量的测定:发酵过程的取样样品在5 000 r/min下离心5 min,取上清液,用孔径为0.22 μm的水膜过滤,利用HPLC测定木糖、葡萄糖、木糖醇、甘油、乙酸和乙醇的含量。色谱柱的型号为 AminexHPX-87H,有机酸分析柱。流动相为稀硫酸(0.005 mol/L),流速为0.4 mL/min,柱温为60 ℃,使用示差检测器。
2 结果与分析
2.1 木质纤维素水解产生的发酵抑制物对S.passalidarum发酵性能的影响
5 L发酵罐装液量2 L,图1-a中所用培养基为发酵培养基1,图1-b中所用培养基为发酵培养基2。1710菌种从-80 ℃冰箱中取出经活化和扩大培养之后接种到已经灭菌后的发酵罐中,考察菌株1710对混合糖发酵的能力和加入木质纤维素预处理产生的主要抑制物,1710在混合糖培养基中发酵能力,结果如图1所示。发酵培养基无水解抑制物添加时,菌株1710可以对葡萄糖和木糖进行共发酵,但是木糖发酵速度要明显慢于葡萄糖,葡萄糖迅速被利用,12 h基本耗尽后木糖被消耗,36 h基本被耗尽,在此期间菌体浓度逐渐增加,到36 h菌体浓度达到最大。
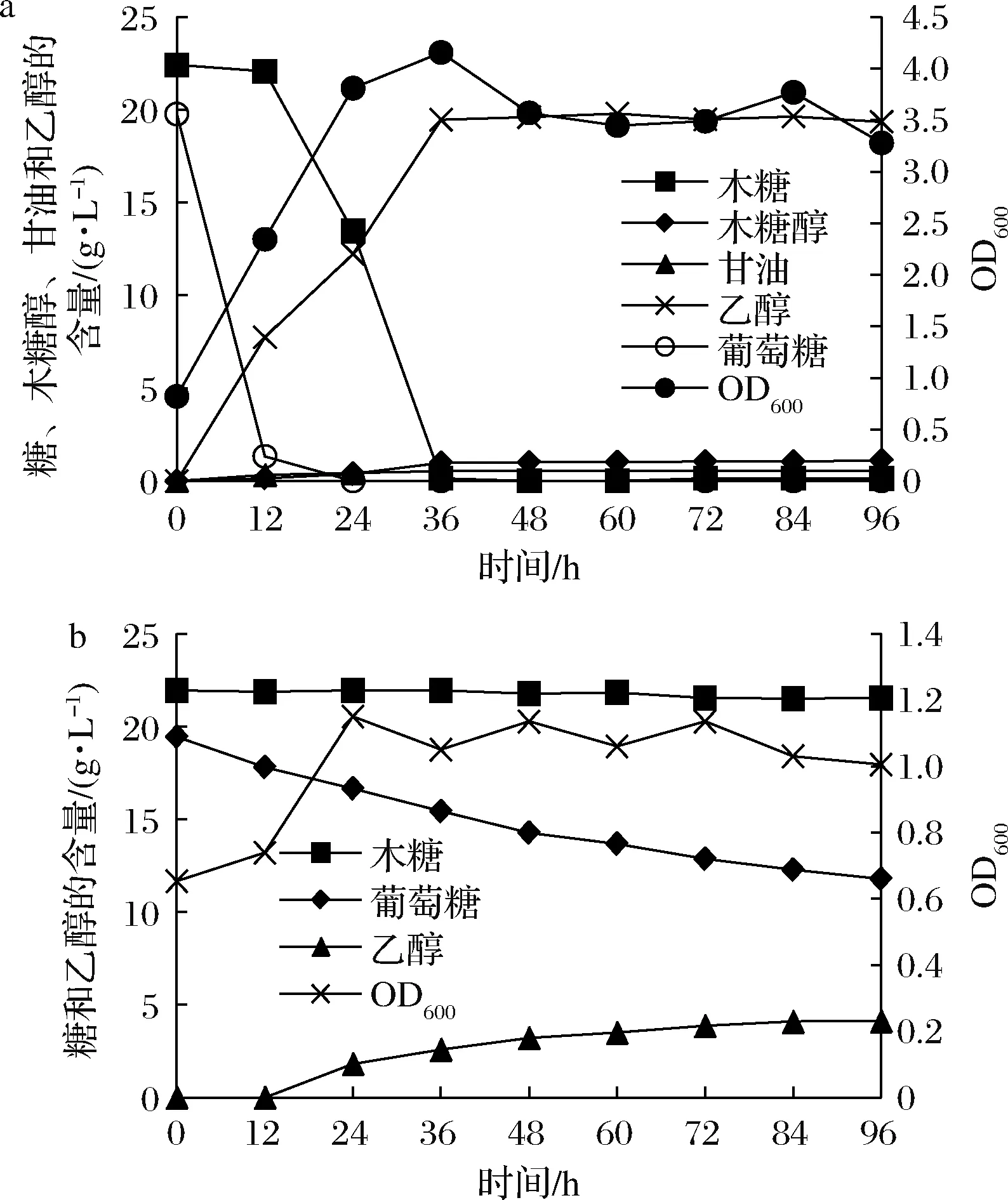
a-不添加水解抑制物;b-添加水解抑制物图1 菌株1710对混合糖的发酵情况Fig.1 Fermentation in the mixture sugar by 1710 strain
OD600≈4,乙醇浓度随着发酵的进行逐渐增加,36 h乙醇产量为19.46 g/L,糖醇转化率为0.46 g/g;当发酵培养基中添加水解产生的抑制物时,葡萄糖消耗变得十分缓慢,而木糖基本不消耗,菌体浓度也很小,最大菌体浓度OD600≈1,12 h才开始有乙醇生成,96 h内共产生乙醇4.13 g/L。
菌株1710作为天然混合糖发酵菌株生产纤维素乙醇具有显著优势,它不仅具有同步发酵葡萄糖木糖的能力,而且发酵时间短,糖醇转化率远高于其他发酵木糖的酵母,但是也可以看出,菌株1710对纤维素抑制物的抗性较弱,加入水解产生的抑制物之后对1710发酵能力产生了巨大影响,因此需要优化发酵条件来克服这个问题。
2.2 无水解抑制物时ORP调控对菌株1710发酵性能的影响
微量通气有利于酵母发酵能力的提高,但不同通气方式对发酵结果的影响很大。本实验首先通过ORP控制通气量,研究其对菌株1710发酵混合糖的作用。1710菌种经活化和扩大培养之后将菌种接种到已经灭菌后的含有发酵培养基1的发酵罐中,设定ORP值分别为-150,-130,-110 mV进行发酵,由图2可以看出,随着ORP设定值的增加,菌株1710葡萄糖效应先减弱又增强,葡萄糖木糖共发酵的能力逐步提高后又降低,在ORP为-130 mV时共发酵能力最强;糖醇转化率也是先升高后降低,分别为0.46 g/g(不调控ORP)、0.47、0.48、0.43 g/g。随着ORP设定值的增加,菌体浓度逐步提高,最高达OD600≈8。尤为重要的是提高ORP能够缩短发酵时间,不调控ORP值时,50 g/L混合糖耗尽需要36 h左右,调控ORP值(-130 mV)发酵时间缩短到24 h,提高了木糖利用速率。但是超出一定范围后,过高的ORP值促进生物量的过量生长,降低了乙醇的得率。因此适当提高氧化还原电位在一定范围内有利于葡萄糖和木糖的发酵。

a-ORP=-150 mV;b-ORP=-130 mV;c-ORP=-110 mV图2 无木质纤维素水解抑制物时1710的发酵情况Fig.2 Fermentation without lignocellulose hydrolysis inhibitor by 1710
2.3 水解抑制物存在时ORP调控对菌株1710发酵性能的影响
将菌株1710菌种接种到已经灭菌后的含有发酵培养基2的发酵罐中。因为水解产生的发酵抑制物的添加会影响发酵体系中的氧化还原水平,因此将ORP值设定为-140、-130、-120、-110、-100、-90 mV。结果如图3所示。在多种抑制物存在的情况下,随着ORP设定值的提高,同样可以减弱葡萄糖效应,有利于葡萄糖木糖的共发酵。ORP值提高到-100 mV时木糖消耗速率最快,继续提高ORP值为-90 mV时,木糖消耗速率反而开始降低。从不调控ORP值到-120 mV时木糖没有明显消耗;当ORP值提高到-110 mV,木糖耗尽需要48 h左右,随着设定值进一步提高木糖耗尽所需要的时间基本维持在36 h左右,见图3-a。随着ORP值的逐步提高,葡萄糖消耗速率也逐步提高,当ORP值提高到-100 mV,葡萄糖消耗速率最大,ORP值进一步提高到-90 mV时,葡萄糖消耗速率也开始减慢。而且随着ORP值的提高,葡萄糖消耗从开始的极慢缩短到24 h。如图3-b所示。
图3-c显示的是发酵产物乙醇的积累情况。ORP值设定为-140 mV时,36 h才开始有乙醇生成,随着ORP值的提高,乙醇的生产效率逐步提高,当ORP值提高到-100 mV,乙醇生成速率最大,ORP值进一步提高到-90 mV时,乙醇生产速率又减慢,与两种糖的消耗呈现相同规律。在ORP值为-110 mV时糖醇转化率最大,48 h时为0.47 g/g。随着ORP值进一步提高,乙醇产量降低,而且乙醇的损耗也随之增加。
随着ORP值的逐步提高,菌体的生长速率先增大后减小,如图3-d所示。ORP值设定为-110 mV时,菌体具有最高生长速率。但是菌体的最终浓度是随着ORP值的增大而增大,当ORP值设定为-90 mV时,发酵最终菌体浓度最大为OD600≈3.2。
总的来说,通过ORP控制发酵液的微量通气,能够显著提高1710在发酵培养基2中的发酵能力,发酵时间显著缩短,糖醇转化率明显提高,而且结合多方面因素考虑,最优ORP调控值为-110 mV。
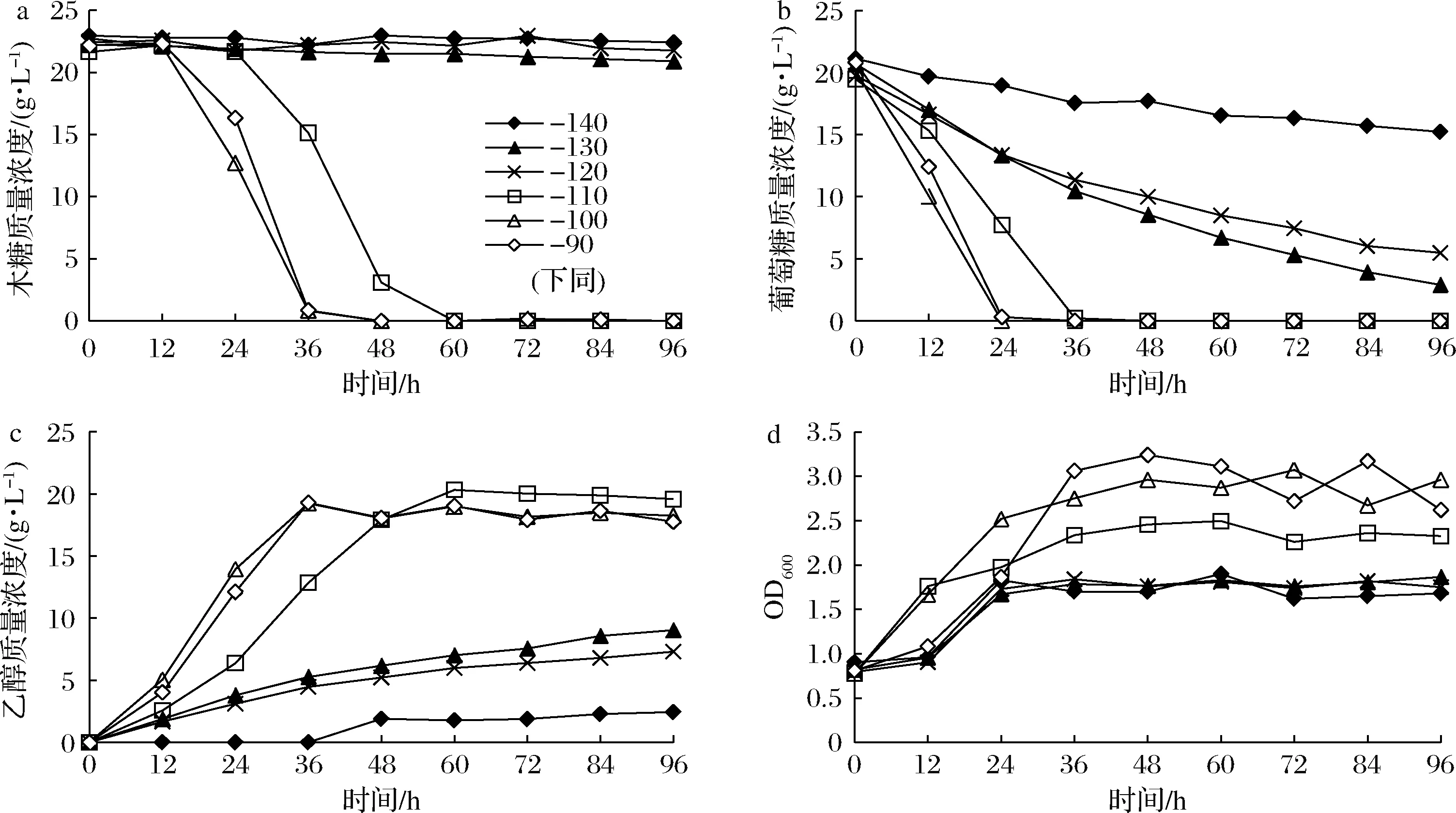
a-木糖浓度;b-葡萄糖浓度;c-乙醇浓度;d-OD600图3 添加水解抑制物后ORP调控对菌株1710发酵的影响Fig.3 Effect of ORP regulation on fermentation of 1710 after adding hydrolysis inhibitor
2.4 水解抑制物存在时恒定通气对菌株1710发酵性能的影响
恒定通气是通过空气流量计调节发酵罐通气量,是实现微量通气的另一种简单易行的方法。我们采用不同的通气量研究添加水解产生的发酵抑制物情况下的混合糖发酵情况,与ORP控制策略进行对比。1710菌种接种到含有发酵培养基2的发酵罐中,分别设定发酵通气量为0.5、1.0、1.5、2.0 vvm。从发酵结果来看,随着通气量的提高,葡萄糖消耗速率基本不变,葡萄糖耗尽需要24 h,木糖耗尽需要36 h。但是随着通气量的提高,糖醇转化率分别为0.39、0.32、0.23、0.19 g/g,且生物量表现出逐步增多的现象。说明随通气量的增加,更多的底物用于细胞生长从而降低了乙醇得率。对比2.3实验结果可知,当ORP值设定为-110 mV时,葡萄糖和木糖发酵时间与0.5 vvm通气量条件下基本一致,但是ORP控制策略下的糖醇转化率0.47 g/g 要远高于恒定通气条件下的0.39 g/g。因此,对于菌株1710发酵,ORP调控策略要优于恒定通气策略。
a-0.5 vvm;b-1.0 vvm;c-1.5 vvm;d-2.0 vvm图4 添加水解抑制物后恒定通气对菌株1710发酵的影响Fig.4 Effect of constant aeration on fermentation of 1710 strain after adding hydrolytic inhibitor
2.5 最优ORP控制时培养基pH对1710发酵性能的影响
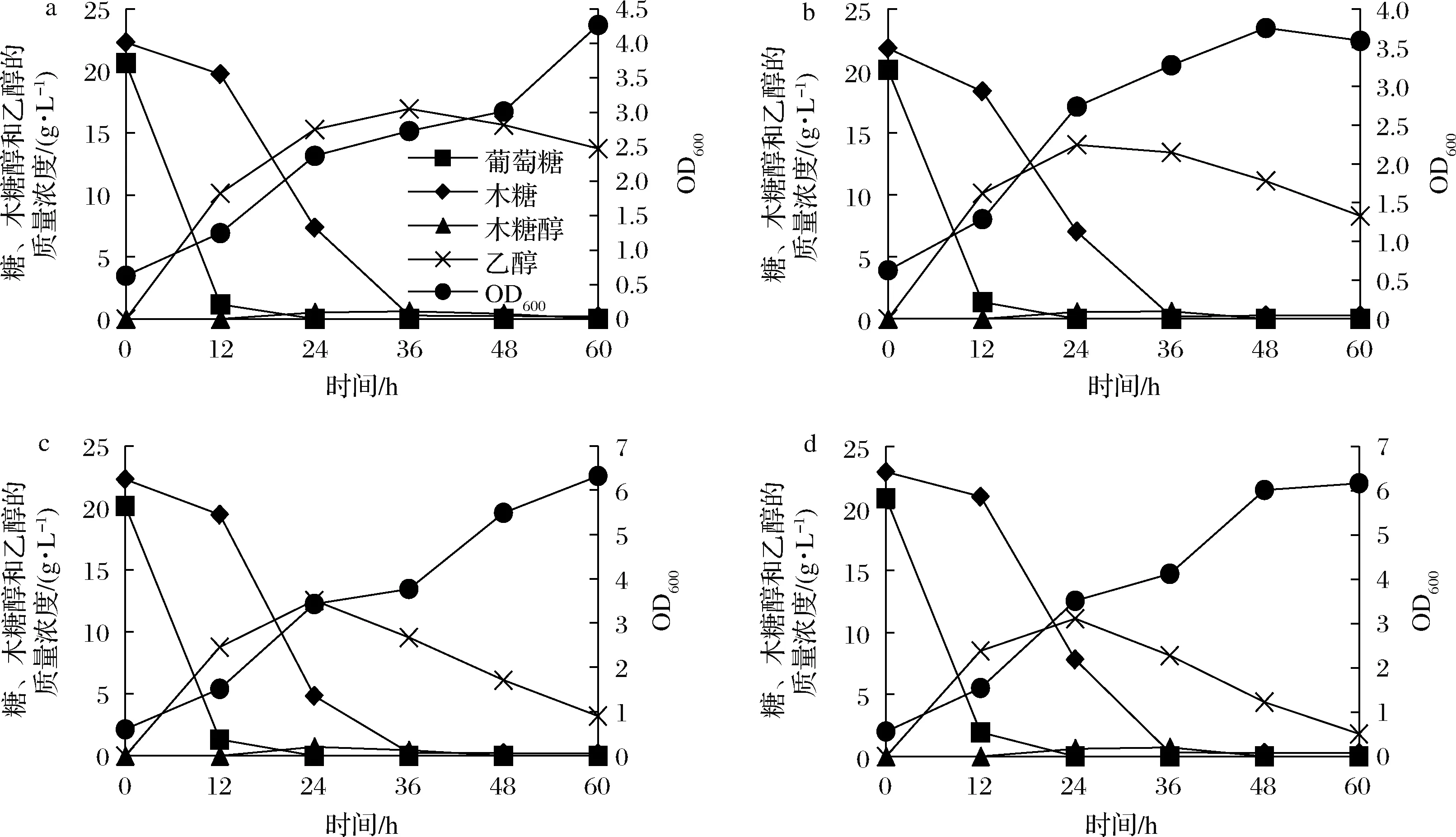
由前述实验可知,采用ORP调控策略并设定ORP值为-110 mV能够显著提高1710在添加木质纤维素水解抑制物时的发酵效果。曾有文献报道,高温灭菌时,会发生美拉德反应抑制发酵过程。因此糖浓度比较高的培养基灭菌时,通常会采用糖溶液单独灭菌后再混合的方法进行,但增加了操作步骤和染菌的可能性。本实验室之前的研究结果发现,灭菌时将pH设定在pH 2.5~3.5,会减弱美拉德反应,可能会进一步提高菌株1710的发酵能力。但酵母发酵的最适pH一般选取5,因此灭菌前调节培养基pH为3,灭菌完成后加NaOH调节pH为5进行发酵,ORP值为-110 mV,结果如图5-a所示。1710对葡萄糖和木糖共发酵,发酵时间由48 h减少到24 h,缩短了一半,而且糖醇转化率仍然保持不变。但如果pH 3灭菌后不再调节pH,直接进行发酵,则基本无法进行(图5-b)。由上结果可见,麦拉德反应产物和pH对酵母的木糖发酵都存在重要的影响,并且可以推测pH对酵母发酵的影响大于麦拉德反应的抑制作用。因此,在纤维素水解液发酵时,如果能进行水解液的不脱毒、不灭菌直接发酵,在降低成本的同时,还能大大提高发酵效率。

a-pH=5;b-pH=3图5 ORP控制时培养基pH对1710发酵混合糖的影响Fig.5 Effect of initial pH under ORP control with mixture sugar and inhabitor
3 结论
本研究考察了2种通气策略下,S.passalidarum对添加有多种木质纤维素水解抑制物的混合糖(葡萄糖和木糖)的发酵能力。结果发现,适当通气可提高S.passalidarum对添加有多种木质纤维素水解抑制物的混合糖发酵能力,并且ORP调控通气策略要优于恒定通气策略。当ORP控制在-110 mv时,发酵速度和糖醇转化率达到最优,发酵时间48 h,糖醇转化率达0.47 g/g。在此基础上,通过调整灭菌前培养基的pH为3,灭菌后调整pH为5时,在保持糖醇转化率不降低的情况下,发酵时间缩短到24 h,生产效率提高1倍,为纤维素水解液的生产燃料乙醇提供了新的解决方案。

