高考中化学平衡常数的考查形式及命题趋势
黑龙江 栾厚福
化学平衡常数是历年高考必考考点之一,而且试题难度有增大的趋势,考查形式越来越复杂,试题情境越来越新颖,深入渗透变化观念与平衡思想的学科核心素养。为了提高备考复习的针对性,本文结合各地高考试题分析归纳概括平衡常数常见的考查形式与应对策略,同时结合高考和各地大型联考的考情,预测今后高考考查的重点或可能的考查形式,希望为广大教师及学生的高三备考复习提供一定的借鉴和指导意义。
一、常见的考查形式及解答
从近5年高考试题来看,化学平衡常数的考查形式,可谓多种多样,概括起来大体有以下几种类型。无论考查形式如何变化,试题都具有较大的难度,学生一定要掌握相关的应对策略。
(一)根据数据直接计算
自新高考实施以来,曾经考查过化学平衡常数表达式的书写,后来频繁出现根据数据和三段式法计算化学平衡常数K的试题,在2014年全国新课标Ⅰ卷中首次出现了分压平衡常数Kp的计算,随着新高考改革的不断深入,几乎交替考查K和Kp的计算,尤其近几年Kp考查的更加频繁。


【解析】根据催化重整反应中CO2的转化率为50%,结合三段式法得

起始(mol·L-1): 1 0.5 0 0
变化(mol·L-1): 0.25 0.25 0.5 0.5
平衡(mol·L-1): 0.75 0.25 0.5 0.5
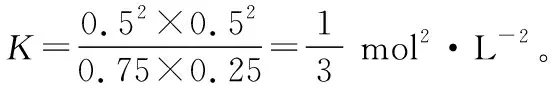
【应对策略】根据数据直接计算平衡常数K,需根据题中数据信息等列出1个或多个可逆反应起始、变化和平衡时的三段式,由可逆反应列出平衡常数K的表达式,代入各物质平衡浓度即可求出K。


【解析】设原气体的物质的量为100 mol,则SO2、O2和N2的物质的量分别为2mmol、mmol和qmol,即2m+m+q=3m+q=100,SO2的平衡转化率为α,则有下列关系:
起始(mol): 2mm0
变化(mol): 2mαmα2mα
平衡(mol): 2m(1-α)m(1-α) 2mα

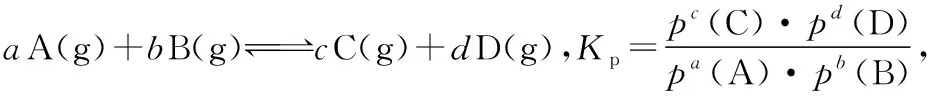
(二)根据图像信息考查
化学反应原理的试题大多都是结合图像等形式给出,部分高考题也结合图像获得信息间接考查某个特殊点平衡常数的计算、平衡常数的比较等。对考生的能力要求相对较高。


图1
可知反应平衡常数K(300℃)________(填“大于”或“小于”)K(400℃)。设HCl初始浓度为c0,根据进料浓度比c(HCl)∶c(O2)=1∶1的数据计算K(400℃)=______________(列出计算式)。

【解析】(1)根据反应方程式知,HCl平衡转化率越大,平衡常数K越大,结合图像可知升高温度HCl的平衡转化率降低,说明升高温度平衡向逆反应方向进行,则K(300℃)>K(400℃)。由图像知,温度相同时,c(HCl)∶c(O2) 越大,则HCl的平衡转化率越低,故在400℃、进料c(HCl)∶c(O2)=1∶1时,HCl平衡转化率为84%,用三段式法对数据进行处理得:

起始浓度:c0c00 0
变化浓度: 0.84c00.21c00.42c00.42c0
平衡浓度: (1-0.84)c0(1-0.21)c00.42c00.42c0

【应对策略】根据图像计算化学平衡常数,一般思路如下:
①明确图像中横坐标、纵坐标所表示的含义,能理解可逆反应随温度、压强、进料比等变化的影响;
②若有多个变量,必要时固定某一变量,可在图像上适当做辅助线,利用控制变量法探究外界条件改变对化学平衡的影响;
③根据图像中转化率(或体积分数、产率等)随温度变化可判断可逆反应的热效应,由此可判断温度改变对平衡常数的影响等。
③选取图像中特殊点,根据对应物质的转化率(或体积分数、产率等),列出三段式求算平衡常数。
(三)根据复杂信息综合考查
化学反应原理的试题是高考中的拉分题,考查时往往给出比较复杂的信息,如给出陌生的反应和比较复杂的对数图像等,实际上这类试题不仅考查学生对化学知识的掌握情况,还考查学生对数学知识的理解等。试题和图像的信息量相对都比较大,这类试题的综合性很强。
【例4】(2021·全国乙卷·28节选)一氯化碘(ICl)是一种卤素互化物,具有强氧化性,可与金属直接反应,也可用作有机合成中的碘化剂。回答下列问题:

(2)McMorris测定和计算了在136~180℃范围内下列反应的平衡常数Kp:


图2
①由图可知,NOCl分解为NO和Cl2反应的ΔH________0(填“大于”或“小于”)。

(2)①大于 ②Kp1·Kp2大于 推理过程详见解析


起始(kPa): 20.0 0
变化(kPa):x2x
平衡(kPa): 20.0-x0.1 2x
根据平衡时总压强为32.5 kPa得(20.0-x)+0.1+2x=32.5。解得x=12.4,则平衡时p(ICl)=12.4 kPa×2=24.8 kPa。
【应对策略】解答这类复杂信息的试题,首先要理解试题中的信息,如根据题意和数据能写出化学方程式并进行简单计算;其次要看明白图像所表示的含义,尤其涉及横纵坐标都是比较复杂的变量时,能准确判断反应的热效应或化学平衡常数等变量的变化情况;最后能根据已有知识将试题信息进行整合,能进行综合分析或计算推理等。
二、命题趋势分析
结合对全国各卷区近几年高考试题和大型联考、模拟试题的研究不难看出,Kp的考查非常频繁,无论是全国卷还是新高考试卷中仍是命题的重点。考查形式会越来越复杂,情境更新颖,侧重解答生产和环保等领域中的实际问题。

各地联考、模拟试题中结合反应速率方程考查化学平衡常数的试题比较多,实际上结合反应速率方程的试题在2020年全国卷Ⅰ28题中也出现过,同时给出v-t图像等分析解释实际问题,在以后的高考中也可能会出现结合速率方程表示或计算化学平衡常数的试题。近几年的试卷中结合数据考查平衡常数K计算的试题很少,但在2020年山东卷中出现了另一种考查形式,在同一体系中含有多个可逆反应,结合数据仅考查某一反应的平衡常数,这种计算相对来说较复杂,多个反应中均含某些相同物质,要根据多个反应计算出某物质的平衡浓度,再去计算某可逆反应的平衡常数。这两个命题角度也可能会是新的高考命题趋势,学生在备考复习时一定要引起注意,或许会在明年的高考试题中呈现。



(2)(2020·山东卷·18节选)以CO2、H2为原料合成CH3OH涉及的主要反应如下:



一定条件下,向体积为VL的恒容密闭容器中通入1 mol CO2和3 mol H2发生上述反应,达到平衡时,容器中CH3OH(g)为amol,CO为bmol,此时H2O(g)的浓度为________mol·L-1(用含a、b、V的代数式表示,下同),反应Ⅲ的平衡常数为________。



变化(mol):x2xx
根据平衡时CH3OH(g)为amol,则反应Ⅰ生成CH3OH为(a-x) mol,再根据平衡时CO为bmol,可知反应Ⅲ生成CO为(b+x)mol,即

变化(mol):a-x3(a-x)a-xa-x

变化(mol):b+xb+xb+xb+x

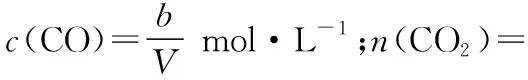

结合以上对化学平衡常数考查形式与命题趋势的分析,无论以哪种形式考查,或试题情境多复杂,在解答化学平衡常数的试题时都要求学生做到:
1.熟悉一种方法


起始(mol·L-1):ab0 0
转化(mol·L-1):mxnxpxqx
平衡(mol·L-1):a-mxb-nxpxqx
2.理解两种表达式

3.明确三个量关系
(1)三个量:即起始量、变化量、平衡量
(2)对应关系:
①同一反应物,起始量-变化量=平衡量;
②同一生成物,起始量+变化量=平衡量;
③反应物、生成物的变化量之比等于各物质的化学计量数之比。
4.掌握四个公式
学生在掌握以上知识的同时,还要能从图像和试题情境中挖掘有效信息,结合变量控制法,利用辅助线等综合分析外界条件的改变对化学平衡的影响,能正确分析或推理条件改变对化学平衡常数的影响,完成化学平衡常数K、Kp相关的计算等。


