数字化实验助力化学概念、原理的深刻理解
——传感器在电离平衡和水解平衡中的应用
北京 王 哲 裴秀焕
一、问题提出
“学好化学应掌握足够的理论和充分的事实”,戴安邦先生指出“化学实验课是实施全面化学教育的一种最有效的教学形式”,可见实验事实在学习化学过程中的重要作用。高中化学课程选择性必修1《化学反应原理》中,阐述了化学平衡及平衡移动等重要的化学理论,而弱电解质的电离平衡、盐类水解平衡、沉淀溶解平衡是化学平衡的延伸和拓展,也是化学平衡理论的重要应用。对这些平衡过程的分析,体现了化学平衡理论的指导作用。由于这些平衡的建立和移动等内容具有一定的抽象性,许多学生在学习过程中难以透彻理解,常常存在死记硬背、生搬硬套等现象。
近年来发展迅速的传感器具有灵敏度高、使用简单、可以检测浓度极低的物质(质量分数为10-6)等优点,在近几年的教学中,借助传感器进行的数字化实验越来越普遍,pH传感器、压力传感器等尤其受老师们青睐。传统的用试管、烧杯难以完成的定量实验,借助传感器采集的数据,能为实验结论提供直观的强有力证据。在弱电解质的电离平衡、盐类水解平衡移动的教学中,借助传感器能将微观反应可视化、抽象理论具体化,数字化实验技术对化学概念、原理的深刻理解提供了强大助力。
二、教学实践
1.电离平衡的构建及平衡移动
人民教育出版社2020年版选择性必修1《化学反应原理》中,强、弱电解质及弱电解质的电离平衡内容与以往教材不同,新教材引入了数字化实验,证据更充分,更有利于学生理解和构建弱电解质及电离平衡概念,具体内容呈现见表1。
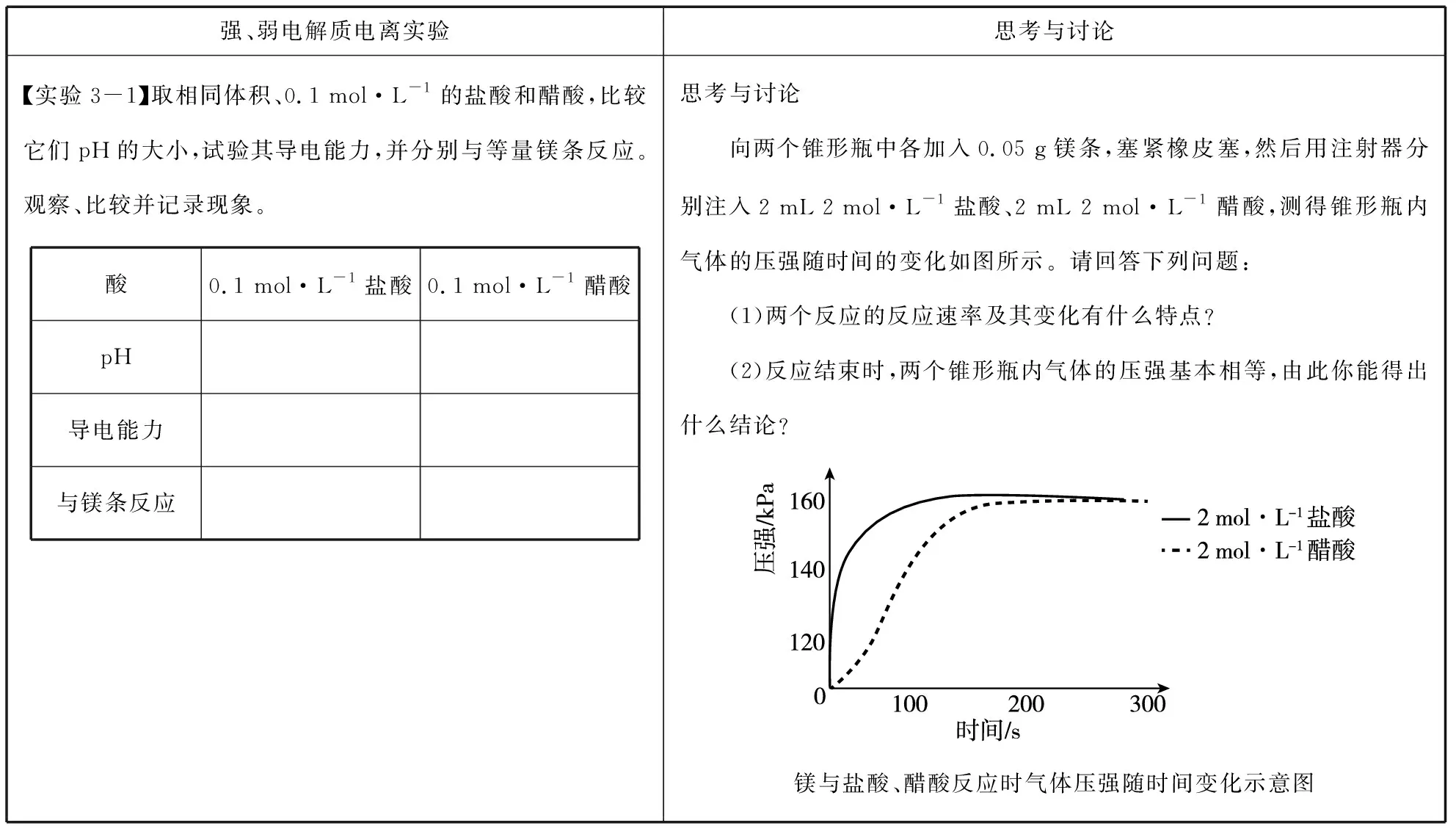
表1 弱电解质电离平衡在新教材中的呈现
【实验3-1】中的现象和溶液pH、电导率等数据表明,相同物质的量浓度的盐酸和醋酸中H+浓度不同,即HCl和CH3COOH的电离程度不同,学生据此理解醋酸等弱电解质的概念。借助【思考与讨论】中压强传感器采集的反应过程中的气体压强变化图像,能直观地表示出等体积、等浓度的两种酸与等量镁条反应产生气体的差别,一定时间内盐酸产生气体的速率比醋酸快,表明开始阶段盐酸大于醋酸中氢离子浓度,随着反应的进行,盐酸中的H+被快速消耗,醋酸中的H+被不断电离出来,使醋酸中的H+得以补充,二者与镁条反应的速率趋于相等;由于等体积、等浓度的两种酸中氢离子的物质的量相等,最终二者生成的气体体积相等。再结合【思考与讨论】中的问题讨论,进而促进学生对醋酸电离过程的理解及醋酸电离平衡的建立,借助气体压强的变化图像,减少了学生对醋酸电离过程想象的盲目性。教师在教学中处理【思考与讨论】时,还可以在原有的两个问题前后,分别增加一个简单问题①和问题④:①2 mL 2 mol·L-1的盐酸和醋酸中含有溶质的物质的量、最终电离出的氢离子的物质的量是否相等?④用化学用语解释0.1 mol·L-1的盐酸和醋酸,为什么盐酸的pH=1,而醋酸的pH>1?设置问题①和④的目的不是为了计算,而是要用问题①引导学生关注两种一元酸中溶质的物质的量、最终电离出的氢离子的物质的量都相等,而产生气体的速率不同,但是气体总量相等;问题④既是对【实验3-1】现象的解释,也是对刚刚构建的电离平衡概念的应用。


图1 盐酸和醋酸稀释过程中溶液pH随时间变化示意图
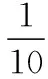
2.水解平衡影响因素
能够水解的盐溶液中,存在水的电离平衡和盐中弱离子的水解平衡,外界条件(温度、浓度和溶液酸碱性等)的改变会对溶液中的平衡产生影响,为了更直观地展现盐类水解平衡移动中微粒浓度的细微变化,避免影响水解的因素分析变成枯燥的理论推演和结论的死记硬背,老师们尝试将数字化手持技术引进课堂。以下借助pH传感器,以FeCl3、Na2CO3、NaHCO3溶液为研究对象,探究浓度、温度对盐类水解的影响。
2.1 浓度对水解平衡的影响——以FeCl3水解为例
人民教育出版社2020年版选择性必修1《化学反应原理》中,以实验形式进行“反应条件对FeCl3水解平衡的影响”的探究,探究中设计实验并对实验现象进行分析,主要以观察外界条件改变前后溶液颜色的变化作为分析依据。在进行温度和生成物浓度(即外加酸或碱)条件的探究中,可增加对照实验排除Fe3+颜色变化的干扰,但是,对于反应物浓度的改变(例如增大FeCl3浓度),很难通过对照实验排除Fe3+颜色(Fe3+浓度增大,溶液颜色也会加深)的干扰。而借助pH传感器进行实验,能够突破单纯通过观察颜色的局限性。具体过程见表2。

表2 利用pH传感器探究浓度的改变对FeCl3水解平衡的影响
2.2 温度对盐溶液pH的影响——以Na2CO3和NaHCO3溶液为例
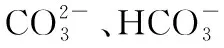
2.2.1 温度改变对Na2CO3溶液pH影响的综合分析


图4 升温过程中Na2CO3溶液pH变化曲线

图5 降温过程中Na2CO3溶液pH变化曲线
2.2.2 温度改变对NaHCO3溶液pH影响的综合分析

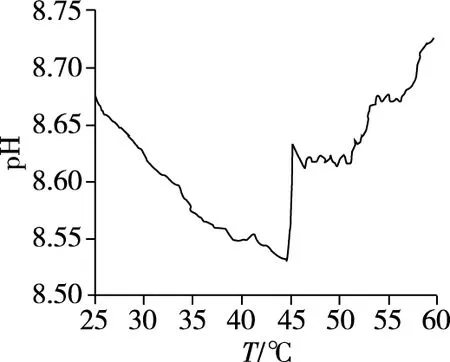
图6 升温过程中NaHCO3溶液pH变化曲线

图7 降温过程中NaHCO3溶液pH变化曲线
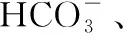
三、总结与反思
教师借助传感器进行电离平衡相关内容的教学,将强、弱电解质的性质进行了直观的定性表达,简洁明了,说服力强;教师利用pH传感器探究浓度对FeCl3水解平衡的影响,实验步骤简洁,并且对FeCl3溶液的浓度没有严格要求,学生只需关注实验前后FeCl3溶液浓度大小的变化,实验图像直观形象,解决了单纯通过观察颜色判断平衡移动时Fe3+颜色干扰的问题;教师利用pH传感器测定升温、降温条件下Na2CO3、NaHCO3溶液的pH变化,借助曲线变化的实验证据,帮助学生分析复杂体系中多种化学反应的协同与竞争,避免学生主观臆断得出结论,提升学生分析问题和解决问题的能力及证据意识。
数字传感技术实现了微量变化的数据采集,将微观变化转化为可视化的宏观现象,这是传统实验无法比拟的。学生对传统的“烧杯+试管”实验无法解决的困扰,可以借助传感器等精密度高的仪器进行定性或定量的微观探测,一方面避免主观臆断形成错误认知,另一方面提升“证据推理与模型认知”“宏观辨识与微观探析”等化学学科核心素养,体会信息技术、科技进步在化学学科发展中的重要意义。

