高考备考中“无机物质制备类实验题”的解题策略
广西 金敖然
化学实验综合题是各类高考试卷的必考题型,而无机物质制备类实验题又是这类题型的重要组成部分,可以综合考查实验仪器和药品的选择、实验操作、物质制备原理、物质的分离与提纯、实验的设计与评价、物质组成、样品含量的计算等知识。同时还可以结合反应原理中的平衡移动、反应速率以及元素化合物等知识多维度进行考查。可在考查中培养学生的思维能力,促进学生化学学科核心素养的发展。作为复习备考的高三学生首先要具备系统的化学实验理论知识,从多角度对“无机物质制备类实验题”进行分析和训练,构建解决这类题型的思维模型,优化解题方案,力求快速精准地突破“无机物质制备类实验题”,从而达到高效复习的目的。
一、研究高考真题,发现考点,揭示本质
近三年全国卷化学试题中,都设置一道实验选择题和一道实验综合题,分值共计20分或21分,由此可见其重要程度,笔者将近三年全国卷化学实验综合题的考查情况整理如表1所示:
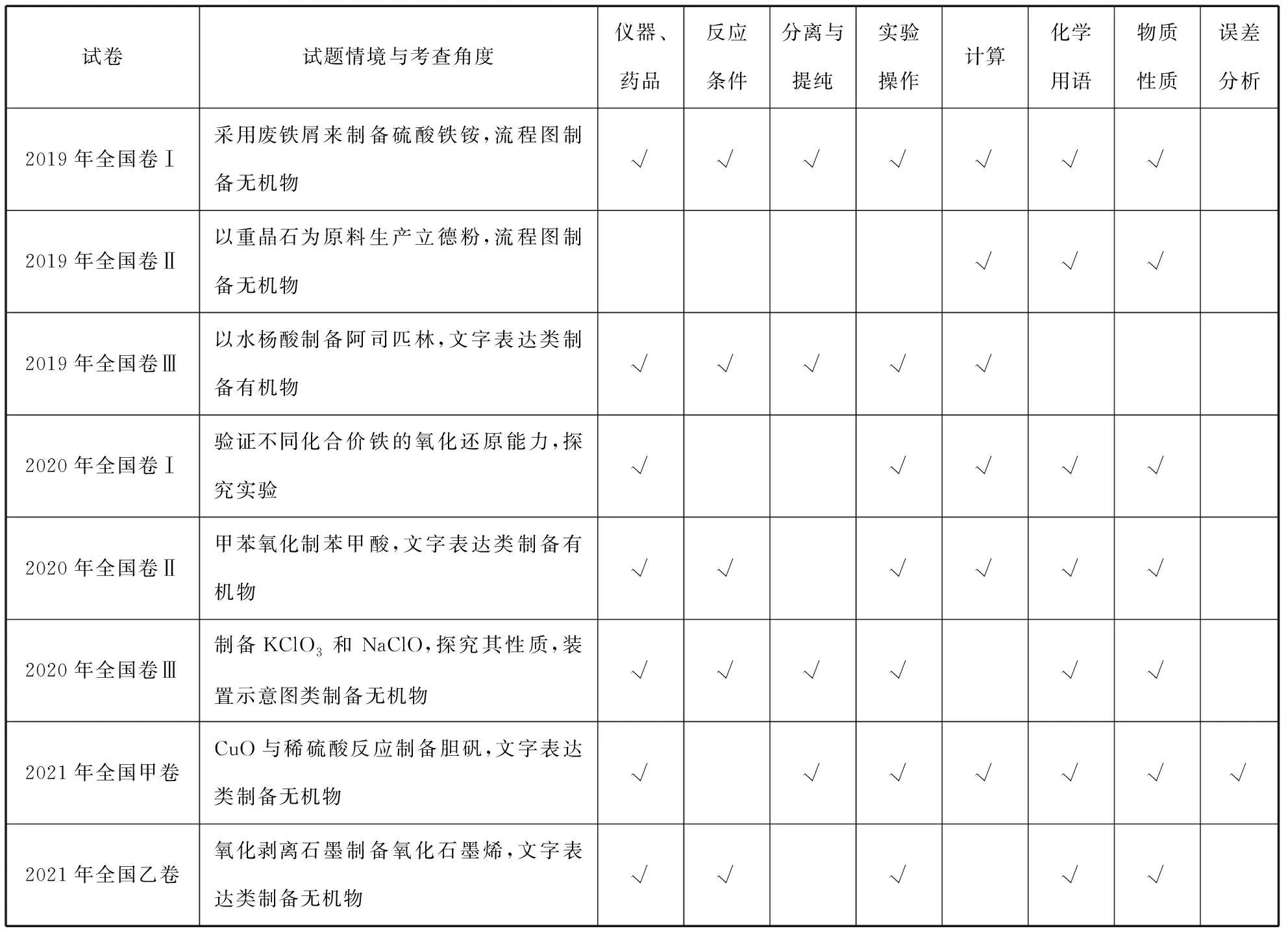
表1 2019—2021年全国卷实验综合题考情统计
纵观近三年的8套试卷,5次考查形式为无机物质制备,2次考查形式为有机物质制备,1次考查形式为探究类实验。无机物质制备类实验题出题概率达到62.5%。由表1可知高考试卷中重点考查无机物制备过程中涉及的仪器或使用的药品、物质的分离与提纯、实验的基本操作、化学用语、元素化合物的性质、计算及误差分析等。教师需掌握该题型的考查特点,指导学生学习解题策略、建立思维模型,提高学生的解题能力,培养学生的学科素养。
二、构建解题思维模型
1.有确定装置示意图类制备无机物的实验题
面对这类试题,教师要引导学生认真审题,快速准确获取有用信息,即该实验的实验目的,然后根据题中给的实验装置图和所学的实验基本知识,结合图1所示的气体制备实验模型进行实验设计。解题时学生需依据试题情境及目标产物选择实验的发生装置及所需药品。接下来对制得的气体进行净化,一般先除杂再干燥,此处学生需要结合气体的性质和装置图选择合适的除杂剂和干燥剂。收集气体或者做完气体性质实验之后,还要看尾气是否有毒或易燃易爆,学生要进行尾气处理并选择合适的装置。学生对实验整体进行分析设计的同时,还要关注每处关键装置内的实验现象是什么,涉及哪些化学反应原理和规律。最后学生通观全局进行实验评价,包括是否缺少装置、数据的处理、误差分析等。
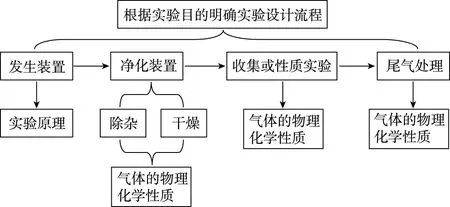
图1 常见气体制备模型
2.有流程图的无机物制备类实验题
此类试题中涉及的工艺往往来源于真实的化学工业,命题人以框图的形式将流程中的每一步工艺,呈现在学生面前。该题型重点考查实验的操作、陌生方程式的书写、物质的分离与提纯、化学反应原理、实验的评价以及计算等。流程图的基本模型如图2所示:

图2 实验流程图模型
化学工艺流程图中涉及的反应过程往往都比较复杂,需要对反应条件进行控制,学生对于如何控制反应条件掌握得不是很好,笔者现将一些相关内容归纳为以下几点:
(1)控制温度在一定范围内
该操作的目的是避免温度过低反应速率慢,同时也避免温度过高引起如盐酸、氨水等物质的挥发;避免温度过高引起如NH4HCO3、H2O2等物质的分解;避免温度过高引起过度的盐类水解;避免温度过高使可逆反应向吸热反应方向移动;避免温度过高发生副反应。
(2)如何调节溶液的pH
流程图中调节溶液的pH的目的往往是使某些金属离子转化成沉淀进而分离。但在调节溶液的pH的过程中一定要注意不要引入新杂质,如除去Cu2+中的Fe3+宜用CuO、Cu(OH)2、CuCO3等来调节溶液的pH,而不用NaOH或者氨水。
(3)如何从溶液中获得晶体
对于单一溶质的溶液,如果产品晶体中不含结晶水,实验中往往采用的操作是蒸发结晶;如果产品晶体中含有结晶水,宜采用蒸发浓缩、冷却结晶、过滤、洗涤、干燥等一系列操作来获得晶体。对于含有两种溶质的溶液,且两种溶质的溶解度随温度变化的差异比较大时,可以采用重结晶的方法获得两种晶体,具体操作为:蒸发结晶、趁热过滤(获得溶解度变化小的晶体)、再冷却结晶、过滤(获得溶解度变化大的晶体)。
(4)用不同液体洗涤的目的
用水洗涤产品的目的是洗去产品表面的可溶性杂质;用冷水或者乙醇溶液洗涤产品的目的是除去产品表面可溶性杂质,同时减少产品因溶解而造成的损失;用乙醇洗涤产品的目的是洗去产品表面的水分,加速干燥。
3.应用模型,解决问题
学生应用好解题模型可以快速理解题意,理顺解题思路,规范答题,提高解题的准确率。
【例1】(2020·全国卷Ⅲ·26节选)氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用图3装置(部分装置省略)制备KClO3和NaClO,探究其氧化还原性质。
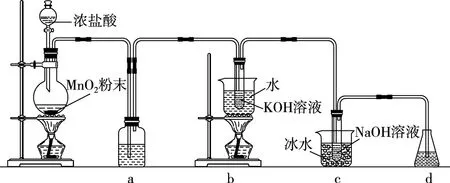
图3
回答下列问题:
(1)盛放MnO2粉末的仪器名称是________,a中的试剂为________。
(2)b中采用的加热方式是________。c中化学反应的离子方程式是____________________,采用冰水浴冷却的目的是________。
(3)d的作用是____________,可选用试剂________(填标号)。
A.Na2S B.NaCl C.Ca(OH)2D.H2SO4
【答案】(1)圆底烧瓶 饱和食盐水

(3)吸收尾气(Cl2) AC
【解析】首先教师根据装置类无机物制备的思维模型划分出各个“工作区”,进行逐一分析:
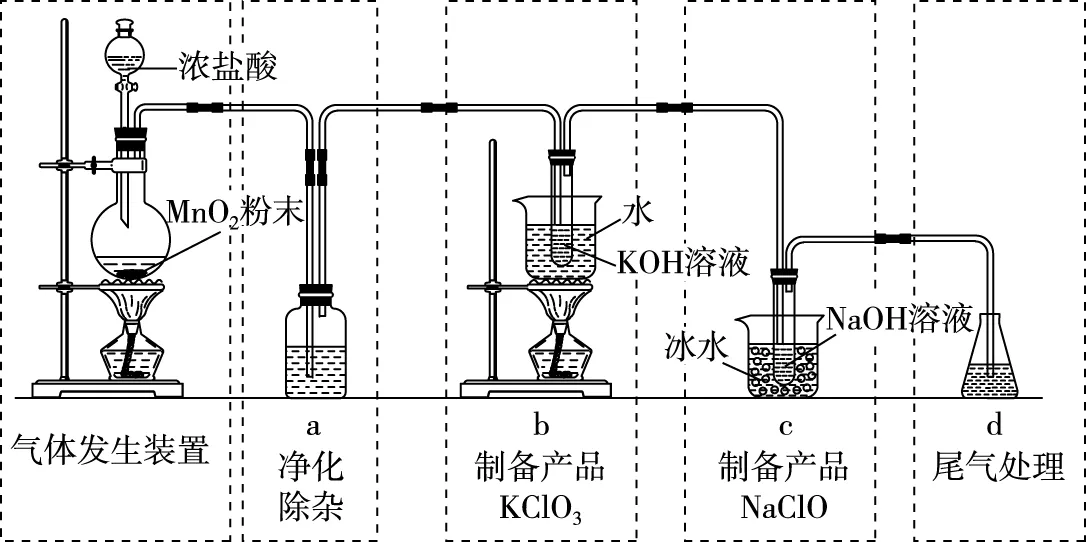
图4
氯气的制备,是在圆底烧瓶中完成,故盛放MnO2粉末的仪器名称是圆底烧瓶,a装置的位置在发生装置和制备产品的装置之间,故为净化装置。而净化包括除杂和干燥,由于b装置内为试管浸化水溶液中的反应,因此氯气无需干燥,但需除去氯气中的氯化氢气体,则a装置中盛装的是饱和食盐水。此处教师也可以鼓励学生积极思考为什么要除去氯化氢气体呢?引导学生通过观察b装置再结合元素化合物的性质综合分析,得出除去氯气中的氯化氢气体,有利于提高KOH的利用率和KClO3的产率的结论。由此得出a装置的存在是非常必要的。对于b、c两个装置,学生在学习氯气的性质时应该知道氯气与碱液反应在不同温度时产物是不一样的。温度高时反应主要生成氯酸盐,常温或者温度低时主要生成次氯酸盐,再结合实验目的学生不难得出b装置是制取KClO3的,而c装置是制取NaClO的。c装置冰水浴的作用就是“避免生成NaClO3”。d装置是实验中多余氯气的处理装置,学生可以根据氯气具有氧化性和与碱溶液反应的性质选择Na2S、Ca(OH)2作为吸收剂。
【例2】(2019·全国卷Ⅰ· 27节选)硫酸铁铵[NH4Fe(SO4)2·xH2O]是一种重要铁盐。为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如图5所示:
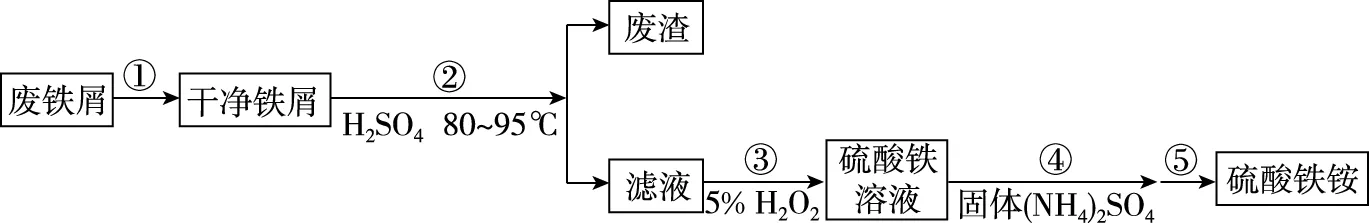
图5
回答下列问题:
(1)步骤①的目的是去除废铁屑表面的油污,方法是
________________________。
(2)步骤②需要加热的目的是________________,温度保持80~95℃,采用的合适加热方式是________________。铁屑中含有少量硫化物,反应产生的气体需要净化处理,合适的装置为________(填标号)。
(3)步骤③中选用足量的H2O2,理由是____________。分批加入H2O2,同时为了________,溶液要保持pH小于0.5。
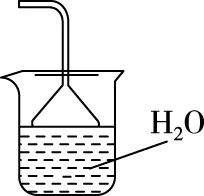
A
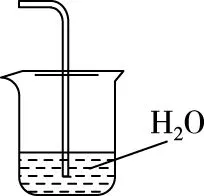
B
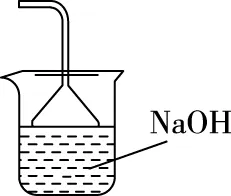
C

D
(4)步骤⑤的具体实验操作有________,经干燥得到硫酸铁铵晶体样品。
【答案】(1)碱煮水洗
(2)加快反应 热水浴 C
(3)将Fe2+全部氧化为Fe3+;不引入杂质 防止Fe3+水解
(4)加热浓缩、冷却结晶、过滤(洗涤)
【解析】教师还是根据流程图类无机物制备的思维模型划分出各个“工作区”,进行逐一分析:
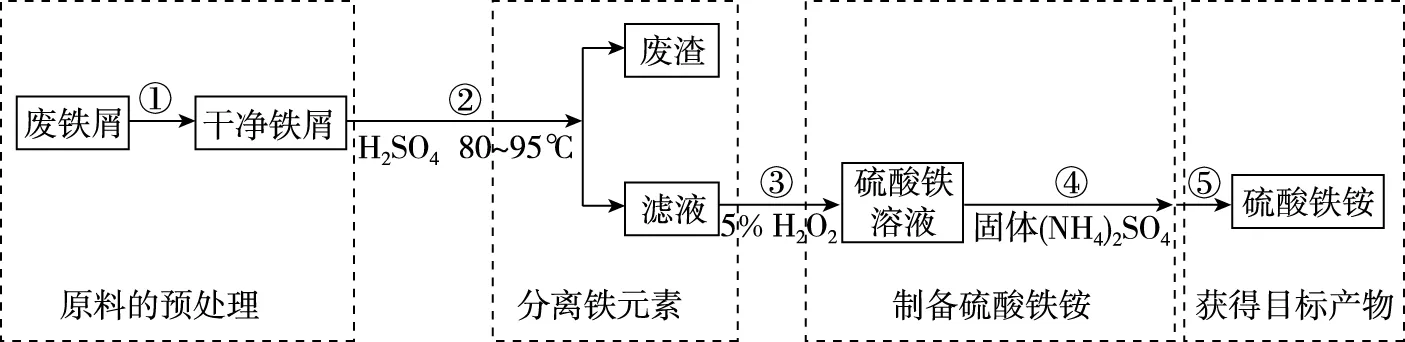
图6
(1)原料的预处理。为了提高铁制品的抗氧化能力,需在其表面上涂抹保护层,用碱液浸泡废铁屑除去表面油污,有利于下一步铁元素的溶解。
(2)分离铁元素。学生利用元素及其化合物知识可知单质铁可以溶解于H2SO4,利用水浴加热将温度控制在80~95℃有利于提高溶解的速率,最后过滤可以得到以FeSO4为主要成分的滤液。
(3)制备硫酸铁铵。利用绿色氧化剂H2O2将FeSO4氧化成Fe2(SO4)3,再加入(NH4)2SO4生成NH4Fe(SO4)2。
(4)获得目标产物。由于产品还含有结晶水,所以采用加热浓缩、冷却结晶、过滤(洗涤)等操作获得目标产品。
【例3】(2021·全国乙卷·27节选)氧化石墨烯具有稳定的网状结构,在能源、材料等领域有着重要的应用前景。通过氧化剥离石墨制备氧化石墨烯的一种方法如下(装置如图7所示):
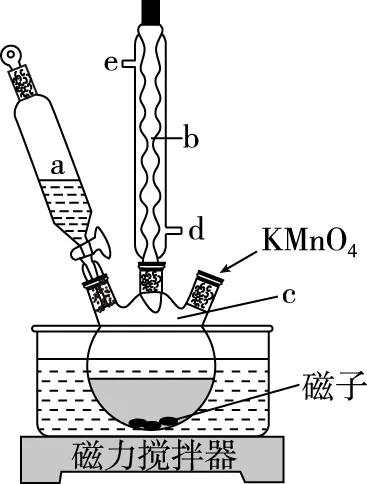
图7
Ⅰ.将浓H2SO4、NaNO3、石墨粉末在c中混合,置于冰水浴中,剧烈搅拌下,分批缓慢加入KMnO4粉末,塞好瓶口。
Ⅱ.转至油浴中,35℃搅拌1小时,缓慢滴加一定量的蒸馏水。升温至98℃并保持1小时。
Ⅲ.转移至大烧杯中,静置冷却至室温。加入大量蒸馏水,而后滴加H2O2至悬浊液由紫色变为土黄色。
Ⅳ.离心分离,稀盐酸洗涤沉淀。
Ⅴ.蒸馏水洗涤沉淀。
Ⅵ.冷冻干燥,得到土黄色的氧化石墨烯。
回答下列问题:
(2)步骤Ⅰ中,需分批缓慢加入KMnO4粉末并使用冰水浴,原因是________________________。
(3)步骤Ⅱ中的加热方式采用油浴,不使用热水浴,原因是________________________。
(4)步骤Ⅲ中,H2O2的作用是(以离子方程式表示)。
【答案】(2)反应放热,防止反应过快
(3)反应温度接近水的沸点,油浴更易控温

【解析】建立思维模型
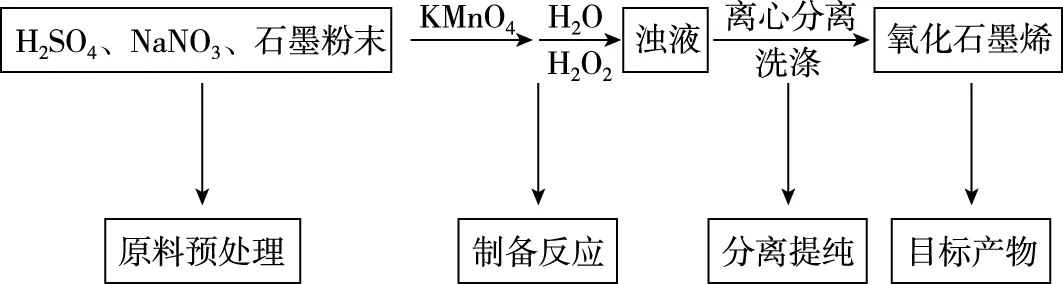
图8
(1)原料预处理。缓慢加入KMnO4目的是避免反应过于剧烈难以控制。
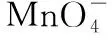
(3)分离提纯。利用离心机分离产物,再依次用稀盐酸、蒸馏水洗涤沉淀,得到目标产物。


