循环免疫荧光法助力组织学多靶标共染
傅椿辉,周洪辉,陈惠玲,王丽杰,陈 泳,杨清海
免疫组化染色是一种研究组织形态和原位蛋白表达的重要技术,对肿瘤的诊断、鉴别诊断、指导治疗、判断预后等方面具有重要作用[1]。组织切片可以为细胞和组织生物学提供丰富的信息。在同一张切片上,传统免疫组化染色通常只能对1~2种抗原进行染色分析,随着精准医学的发展和蛋白质组学更加深入的研究,如不同蛋白间的相互作用,共表达和共定位,表达量与空间和距离关系,肿瘤异质性分析,细胞表型统计,肿瘤微环境呈现等均需在一张组织切片上同时检测多个靶标分子[2-5]。本研究介绍一种利用循环免疫荧光的方法,可以同时显示至少5个以上靶标分子,免疫荧光染色与荧光基团的化学灭活结合抗原抗体分离的快速非破坏性方法交替进行,通过数字病理切片扫描仪,可以在不丢失任何信息的情况下捕获每一轮染色结果,用软件叠加每一轮染色结果,最终实现多重免疫荧光染色。
1 材料与方法
1.1 材料硫酸、高锰酸钾、硼氢化钠购自国药公司;DAPI购自Vector公司;ER、PR、HER-2兔单克隆抗体,Ki-67、CK5/6鼠单克隆抗体,EDTA抗原修复液、磷酸盐缓冲液(PBS)均购自福州迈新公司;异硫氰酸荧光素(FITC)标记的山羊抗小鼠IgG、罗丹明(rhodamine)标记的山羊抗兔IgG购自Abcam公司,3D Histech Pannoramic MIDI数字切片扫描仪、CaseView图像分析软件购自济南丹吉尔公司。
1.2 方法
1.2.1免疫荧光 (1)乳腺癌石蜡切片脱蜡、水化,自来水冲洗并浸泡于水中待用;(2)取适量EDTA(1 ∶50)抗原修复液倒入不锈钢锅中,将不锈钢锅置于电磁炉上,大功率加热至沸腾;(3)将功率调至最小(处于保温状态),将切片置于耐高温染色架上,放入已沸腾的修复液中,盖上锅盖继续加热20 min;(4) 室温自然冷却10 min,可用自来水在不锈钢锅外壁冲淋加速锅内修复液冷却,冷却至室温后取出切片,自来水冲洗干净,PBS冲洗3 min×3。(5)除去PBS,切片上滴加ER兔单克隆抗体(1 ∶50)和Ki-67鼠单克隆抗体(1 ∶50)混合液,室温下孵育60 min,PBS冲洗3 min×3;(6)除去PBS,切片上滴加FITC标记的山羊抗小鼠IgG(1 ∶100)和rhodamine标记的山羊抗兔IgG(1 ∶100)混合液,室温下孵育30 min,PBS冲洗3 min×3;(7)流水冲洗,风干切片,滴加DAPI复染液封固。
1.2.2抗体洗脱和荧光淬灭 染好的切片经Pannoramic MIDI数字切片扫描仪进行荧光扫描后,小心地移去盖玻片,蒸馏水清洗,切片上滴加0.15 mol/L KMnO4、0.01 mol/L H2SO4溶液2 min,流水冲洗,放入新鲜配置的4.4 mol/L NaBH4(pH 9.0)中10 min,流水冲洗,PBS浸泡5 min,即可彻底洗脱抗体和淬灭荧光[8-9]。接着可进行第二轮免疫荧光染色,方法从1.2.1步骤5加一抗开始。
1.2.3荧光扫描与图像分析 每一轮染色后,采用3D Histech Pannoramic MIDI数字切片扫描仪进行荧光扫描。扫描前先设置抗体标记的伪彩颜色,可以设置任意颜色。采用CaseView图像软件对每一轮的荧光图像进行对齐,叠加合成,最终实现多重免疫荧光染色。完整的循环免疫荧光染色流程见图1。
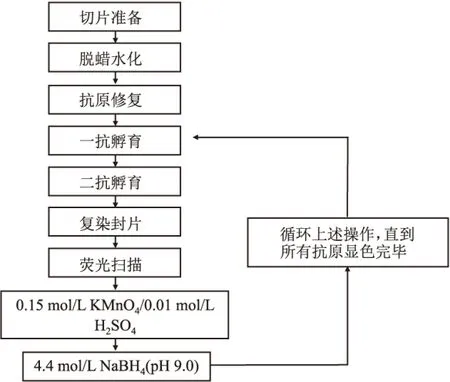
图1 循环免疫荧光染色流程图
2 结果
2.1 KMnO4/H2SO4/NaBH4洗脱抗体、淬灭荧光并保留抗原活性的有效性为验证KMnO4/H2SO4/NaBH4洗脱抗体的有效性,第一轮使用兔单克隆抗体ER在乳腺癌组织上进行免疫荧光染色,结果发现染色明显(图2A),经KMnO4/H2SO4/NaBH4处理后,只用荧光标记的二抗染色,未见任何ER染色,表明一、二抗已完全剥离(图2B)。再用ER抗体和荧光标记二抗进行新一轮染色,又可以看到明显的ER染色(图2C)。为进一步测试抗原的稳定性,实验进行了5轮的ER循环染色,ER免疫反应性在经过5轮的染色和洗脱后依然同第一轮染色一样强烈,染色未见明显减弱(图2D)。表明该方法至少可以进行5轮染色。
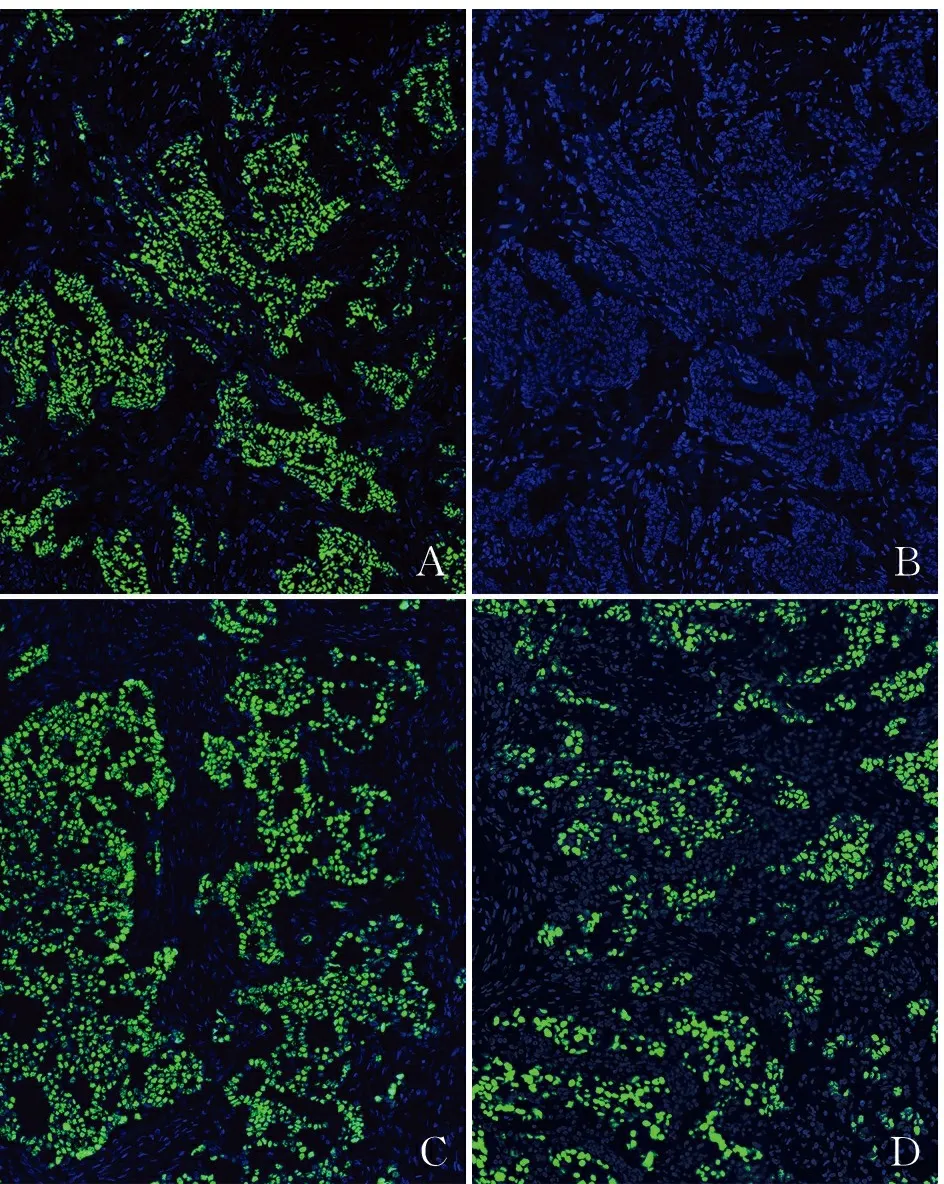
ABCD
2.2 免疫荧光染色与抗体洗脱结合荧光扫描实现多重免疫荧光染色在同一张乳腺癌组织上,分别用ER、PR、HER-2、Ki-67、CK5/6进行循环免疫荧光染色,通过3D Histech Pannoramic MIDI数字切片扫描仪荧光扫描和CaseView图像软件对齐叠加后,可在一张乳腺癌组织切片上完美呈现5种蛋白的共表达(图3),这为观察不同蛋白间的相互作用、肿瘤异质性分析、细胞表型统计、肿瘤微环境呈现等提供了极大的便利。
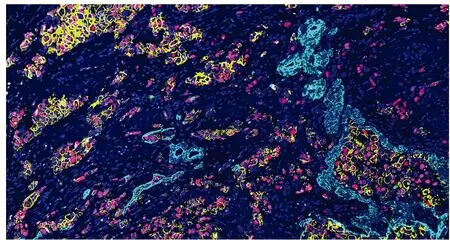
图3 同一张图片上实现5种蛋白共同标记,免疫荧光染色:ER为紫色;PR为红色;HER-2为黄色;Ki-67为绿色;CK5/6为青色;DAPI为蓝色
3 讨论
免疫荧光是一项被广泛用于肿瘤研究的技术,传统的多重免疫荧光染色通常只能显示2~3种抗原标记,并且要求使用不同种属来源的一抗和二抗,以避免抗体间的交叉反应[6-8]。当需要在一张切片上显示5种以上抗原标记时,传统的多重免疫荧光无法显现。酪胺信号放大免疫荧光利用酪胺分子与其结合的抗原蛋白之间共价键的稳定性,其键能远高于抗原、抗体间的非共价键结合力,荧光标记后通过微波加热法在保留抗原标记信号的同时去除结合在抗原上的一抗和二抗分子,解决了传统多重免疫荧光抗体交叉反应的问题[9];缺点是需要多种不同荧光素标记的酪胺信号放大试剂,配备激光扫描共聚焦显微镜和专业的多光谱成像设备,1次最多只能标记7种显色,步骤多,繁琐且耗时。对于大多数研究者来说试剂成本高,且缺乏专业设备,无法自行开展。循环免疫荧光法使用化学试剂去除每一轮样本中的抗体和荧光染料,结合数字切片扫描仪,只需要1~2种荧光二抗试剂即可完成多重免疫荧光标记。利用鸡尾酒式抗体孵育,每一轮可以显示1~2种抗原标记,抗原在经过5轮显色和洗脱后依然可以完好保留。因此,使用该方法经过5轮显色后,可以实现5~10种抗原标记,且步骤简单,耗时少,1天内即可完成。全波片荧光扫描的使用大大简化了循环免疫荧光染色方法,其提供了所有标记的永久存档,并允许在各种放大倍数下观察每个标记的任何区域。更少的二抗试剂和大多数实验室都配有的数字切片扫描仪,使得该方法具有更好的简易性、经济性和普及性。
综上所述,本研究建立的循环免疫荧光法(第一轮免疫荧光染色-伪彩扫描-化学洗脱-重复免疫荧光染色-图像合成)可以实现5~10种蛋白共染,该方法将有助于转化医学研究、肿瘤信号通路研究以及肿瘤微环境研究等。

