肿瘤相关成纤维细胞外泌体miRNA-656-3p调控喉癌生长侵袭及丹参酮ⅡA对其调控研究△
王媚 吴春萍 郭裕 王丽华 胡蓉 张珺珺 王慈 丁毅
(1.上海中医药大学附属市中医医院耳鼻咽喉科 上海 200071;2.复旦大学附属眼耳鼻喉科医院耳鼻咽喉科 上海 200031)
外泌体是肿瘤组织中肿瘤细胞与基质细胞相互作用的重要媒介,是近年来肿瘤微环境研究的前沿和热点。外泌体是直径为30~150 nm的微囊泡结构,包裹着蛋白质、mRNA、miRNA、lncRNA等生物活性分子,是肿瘤微环境中细胞之间信息传递的重要载体[1-3]。肿瘤相关成纤维细胞(cancer associated fibroblasts,CAFs)外泌体miRNAs的异常表达是新发现的影响肿瘤起始、生长、侵袭及转移的重要机制,是肿瘤微环境失衡的重要特征和肿瘤复发、转移的重要原因。目前已在肝癌[4]和乳腺癌[5]等肿瘤中发现了此类调控作用,但具体异常表达的miRNAs种类及下游调控机制因肿瘤而异。
喉癌组织中的CAFs能够明显促进喉癌细胞的体外增殖、迁移、侵袭及体内致瘤能力,并明显抑制原代喉癌细胞的体外凋亡[6-8]。我们推测,喉癌肿瘤微环境中可能同样存在CAFs外泌体miRNAs的异常表达。目前国内外尚未见喉癌CAFs外泌体miRNAs异常表达关键miRNAs的研究报道。我们预实验研究喉癌CAFs原代培养及外泌体miRNAs高通量测序检测发现,CAFs外泌体miR-656-3p表达显著下降。本研究的目的为验证表达下调的外泌体miR-656-3p对喉癌细胞增殖、侵袭和周期的影响,并探索可能的机制。此外,我们检测了中药提取物丹参酮ⅡA是否具有类似的上调CAFs外泌体miR-656-3p表达,并通过后者抑制喉癌细胞增殖和侵袭的功效。
1 材料与方法
1.1 细胞培养 喉癌CAFs及AMC-HN-8细胞系来源于复旦大学附属眼耳鼻喉科医院头颈外科课题组,2种细胞均培养于高糖DMEM(4 500 mg/L,Hyclone,美国)+1%青链双抗(Gibco,美国)+10%去外泌体胎牛血清(fetal calf serum,FBS,Gibco)。去外泌体FBS的制备可用常规FBS在120 000×g离心力下过夜离心,取上清后以0.45 μm的滤膜过滤。2种细胞均置入37 ℃ CO2培养箱培养。
1.2 CAFs外泌体提取及鉴定
1.2.1 外泌体提取 采用超速离心法。收集CAFs培养液上清于50 mL离心管中离心(4 ℃,500×g)10 min;取上清再置于50 mL离心管中离心(4 ℃,2 000×g)20 min;再取上清置于50 mL离心管中离心(4 ℃,10 000×g)30 min;收集上清,用0.22 μm滤膜过滤后再次离心(4 ℃,120 000×g)70 min;弃上清,磷酸盐缓冲液(phosphate buffer saline,PBS)重悬沉淀后再次离心(4 ℃,120 000×g)70 min;弃上清得到外泌体沉淀,50 μL PBS重悬。-80 ℃保存备用。
1.2.2 外泌体鉴定
1)透射电镜观察。取外泌体悬液用PBS 稀释10倍后取20 μL稀释悬液,滴加至碳覆膜铜网上,滤纸吸除多余液体。室温干燥过夜后用1%戊二醛固定和醋酸双氧铀避光染色30 s,滤纸吸除多余液体。室温风干10 min后用透射电镜在80 kV下观察并拍照。
2)纳米粒径追踪分析(nanoparticle tracking analysis,NTA)。取外泌体悬液100 μL,4 ℃条件下PBS 稀释10倍,加入比色皿。置入粒度电位仪样品池中,布朗运动60 s后,用Nanosight 粒子追踪软件分析纳米粒子浓度和大小分布。
3)Western印迹。外泌体沉淀及对照细胞用RIPA裂解液(碧云天,南通)裂解,蛋白浓度测定后上样。SDS凝胶(碧云天)电泳分离蛋白,转PVDF膜(Millipore,美国)。5%脱脂奶粉封闭,加入一抗CD81(1∶1 000,Abcam,美国)、TSG101 (1∶2 000,Abcam) 及Calnexin (1∶2 000,Abcam)4 ℃过夜孵化,再加入辣根过氧化物酶(HRP)标记的IgG二抗(1∶2 000;Jackson)室温孵化1 h。最后BeyoECL Plus试剂盒(碧云天,南通)显色拍照。
1.3 miR-656-3p过表达 采用分子克隆的常用方法,以pcDNA6.2-GW/EmGFP-miR (Invitrogen,美国)真核表达载体为基础,构建miR-656-3p过表达质粒。CAFs按2×105个细胞/孔的密度接种于6孔板,培养24 h后用Lipofectamine 2000(Invitrogen)进行瞬时转染(均按操作步骤进行),转染无关干扰序列的CAFs为NC对照组,只添加转染试剂 Lipofectamine 2000的CAFs为Mock对照组,而不添加任何试剂的CAFs为空白对照组。用实时PCR (real-time PCR,RT-PCR)验证miR-656-3p过表达效果,所用miR-656-3p及内参引物和PCR步骤见后文1.5。
1.4 丹参酮ⅡA储存液及条件培养基的制备
1.4.1 丹参酮ⅡA储存液配置 丹参酮ⅡA(Tan ⅡA)购自中国药品生物制品检定所,纯度 98%,用二甲基亚砜(DMSO)溶解,配制为10 mmol/L储存液,0.22 μm滤膜过滤除菌4 ℃冷藏备用。本研究中丹参酮ⅡA的细胞培养时终浓度为10 μmol/L。
1.4.2 miR-656-3p过表达CAFs培养液上清外泌体母液的制备 将miR-656-3p过表达CAFs培养48 h接近汇合后收集培养液上清,按照上文1.2.1步骤提取外泌体,最终将5 mL CAFs培养液上清所得外泌体沉淀加100 μLPBS重悬,作为进一步实验的外泌体母液,-80 ℃保存备用。命名为conditioned medium miR-656-3p过表达(CM miR-656-3p过表达)。
1.4.3 丹参酮ⅡA作用后的CAFs培养液上清外泌体母液的制备 在CAFs培养液中加入丹参酮ⅡA使其终浓度为10 μmol/L,培养48 h后同上法收集外泌体沉淀,加PBS重悬,-80 ℃保存备用。命名为conditioned medium 丹参酮ⅡA(CM Tan ⅡA)。
1.5 CAFs外泌体miR-656-3p不同表达水平的RTPCR验证 收集不同处理方法后的5组CAFs培养液上清中的外泌体用RT-PCR检测miR-656-3p表达水平。第①~③组:将过表达外泌体miR-656-3p的CAFs(实验组、对照组及Mock组)培养48 h,培养液上清收集后用上述超速离心法收集外泌体沉淀备用。第④组:在常规CAFs培养液中加入终浓度为10 μmol/L的丹参酮ⅡA培养48 h后收集培养液上清,同法收集外泌体沉淀备用。第⑤组:将不做任何处理的CAFs培养48 h,同法收集培养液上清中的外泌体备用,作为空白对照组。
TRIzol法提取5组外泌体沉淀中的总RNA,用NanoDrop 2000C 紫外可见光光度计(Thermo Evolution,美国)检测OD260/OD280值,评估RNA样品的浓度及纯度。用PrimeScriptTM RT reagent Kit(Takara,大连)逆转录RNA,用SYBR® Premix Ex TaqTM (Takara,大连)进行PCR扩增,均根据说明操作。snRNA U6作为内参对照,2-ΔCT法计算目标miRNA相对于snRNA U6的表达水平。热循环条件:95 ℃ 预变性30 s,40个循环(95 ℃ 变性5 s及60 ℃退火延伸34 s),溶解曲线(95 ℃ 15 s,65 ℃ 1 min,95 ℃ 15 s)。引物(生工生物,上海)序列见表1。

表1 miRNAs引物序列
1.6 增殖实验 采用CCK8方法检测。将相同数量的喉癌细胞(3 000个细胞/孔)悬浮于200 μL DMEM培养液(含10%无外泌体FBS及1%青链双抗),接种到96孔板中;实验1组及2组分别加入10 μL以上2种不同的CAFs外泌体母液(CM miR-656-3p过表达及CM TanⅡA)。以不加外泌体母液培养于200 μL DMEM培养液(含10%无外泌体FBS及1%青链双抗)的相同数量的喉癌细胞为对照。将3组细胞培养0、24、48、72、96 h,各孔加入20 μL的CCK-8,37 ℃孵化3 h,用酶标仪检测波长为450 nm处的吸光度值。以培养时间和吸光度值均数作曲线,评估各组细胞的增殖能力差异。
1.7 侵袭实验 采用Transwell检测。将数量相同的喉癌细胞(2 000个细胞/孔)悬浮于200 μL无血清EMEM,接种到底面铺好基质胶的孔径8 μm Transwell上室底部,下室加入约600 μL含血清(20%无外泌体FBS)DMEM。实验1组及2组分别于上室加入10 μL以上2种不同的CAFs外泌体母液(CM miR-656-3p过表达及CM Tan ⅡA),以不加外泌体母液组喉癌细胞为对照。Transwell小室置于培养箱中培养24 h后取出上室,弃去培养液,PBS 洗涤,棉签擦去上室底部上表面的细胞;将上室底部下表面的细胞置于4%多聚甲醛中固定15 min,再用0.25% 结晶紫染色10 min。用显微镜观察上室底部下表面10个随机视野计数,取均值。比较各组喉癌细胞的侵袭能力差异。
1.8 细胞周期 用流式细胞仪检测。将喉癌细胞悬浮于2 mL DMEM培养液(含10%无外泌体FBS及1%青链双抗),接种于6孔培养板(5 000个细胞/孔)。实验1组及2组分别加入1 mL以上2种不同的CAFs外泌体母液(CM miR-656-3p过表达及CM Tan ⅡA),以不加外泌体母液组喉癌细胞为对照。培养48 h后消化收集喉癌细胞,PBS洗2遍。离心后加入70%的冰乙醇,4 ℃固定,过夜。PBS洗涤,加入RNA酶(20 μg/mL),37 ℃孵化30 min。PBS洗涤,再加入碘化丙啶溶液(PI,15 μmol/L)孵化10 min。40μm滤网过滤,除去细胞团块,流式细胞仪检测。
1.9 周期蛋白CCND2表达检测 采用Western 印迹检测。将以上1.8中的3组喉癌细胞进行蛋白提取、浓度测定,后续操作步骤同1.2.2。不同之处为加入一抗为CCND2 (1∶1 000, Abcam),β-actin (1∶5 000,Abcam)为内参。
2 结果
2.1 CAFs外泌体TEM、Western印迹及NTA鉴定 TEM检查显示了包膜完整、形态均一的典型外泌体形态(图1A)。Western 印迹检查提示2个外泌体鉴定常用阳性蛋白标记物CD81和TSG101呈阳性表达,而外泌体鉴定常用阴性蛋白标记物calnexin呈阴性表达(图1B),与文献[9-10]报道一直。NTA揭示了外泌体颗粒的直径大小分布为(112.1±55.5)nm(图1C),与文献报道的(30~150 nm)[11]基本一致。

图1 外泌体TEM、Western印迹及NTA鉴定 A.TEM观察发现外泌体为直径100 nm左右、包膜完整的颗粒,比例尺为500 nm;B.Western印迹检测提示外泌体为CD81及TSG101呈阳性,而Calnexin呈阴性;C.NTA检测提示外泌体颗粒的直径均数约为112 nm。
2.2 CAFs外泌体miR-656-3p不同表达水平RT-PCR验证 RT-PCR检测结果发现,miR-656-3p过表达组的CAFs外泌体RNA提取物中miR-656-3p表达水平最高,而对照组、Mock组及空白对照组CAFs外泌体RNA提取物中miR-656-3p表达水平均较低,3组无明显差异,丹参酮ⅡA作用的CAFs外泌体RNA提取物中miR-656-3p表达水平居中(图2)。

图2 5组CAFs外泌体中miR-656-3p 表达水平RT-PCR验证 转染无关干扰序列的CAFs为对照组,只添加转染试剂Lipofectamine 2000的CAFs为Mock对照组,而不添加任何试剂的CAFs为空白对照组。n.s.示P>0.05,*示P<0.05,**示P<0.01。
2.3 增殖及侵袭实验 CCK8增殖实验发现,CM miR-656-3p过表达组AMC-HN-8喉癌细胞的增殖能力最弱,而对照未处理组喉癌细胞的增殖能力最强,CM Tan ⅡA条件培养基处理组的喉癌细胞增殖能力居中(图3A、B)。
Transwell侵袭实验发现,喉癌细胞穿透上室底部基质胶到达下表面的数量从多到少依次为:未处理对照组喉癌细胞[(84.40±4.42)个,n=10],培养液上室加入CM Tan ⅡA条件培养基处理的喉癌细胞[(55.10±2.93)个,n=10)以及培养液上室加入CM miR-656-3p过表达条件培养基的喉癌细胞[(32.00±2.27)个,n=10]。详见图3C~F。
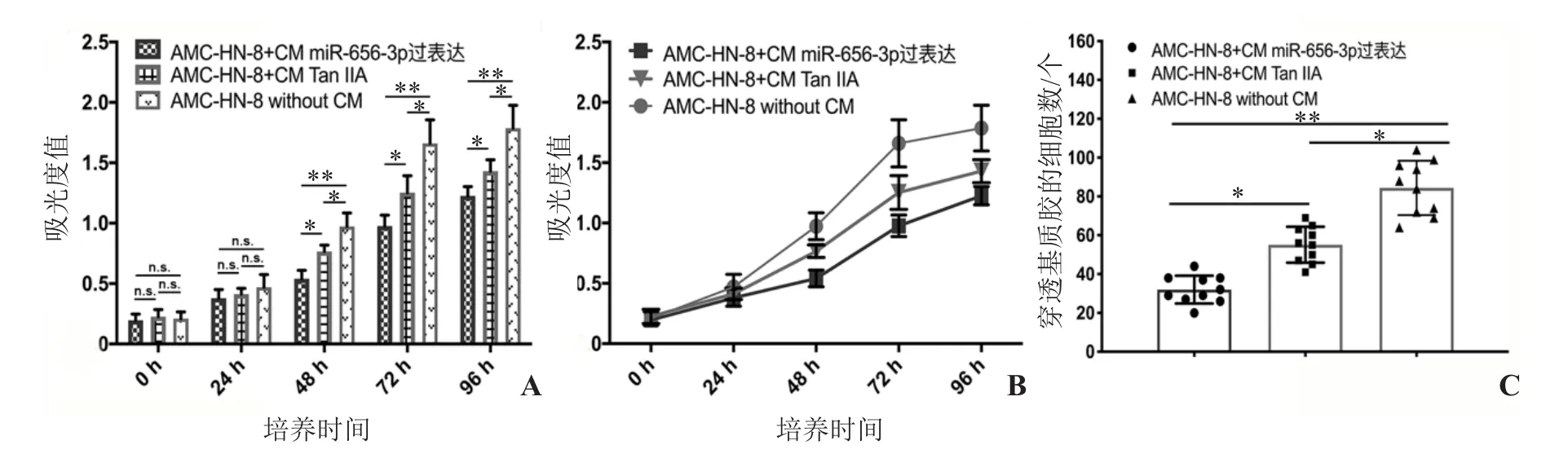

图3 CAFs外泌体miR-656-3p表达水平对喉癌细胞增殖和侵袭能力的影响 A、B.3组喉癌细胞的增殖能力统计图:miR-656-3p过表达条件培养基抑制喉癌细胞增殖能力作用最显著,CM Tan ⅡA条件培养基次之;C.3组喉癌细胞的侵袭能力统计图;D、E、F. 3组喉癌细胞侵袭实验显微镜典型视野图(×100)。*示P<0.05,**示P<0.01。
2.4 细胞周期及周期蛋白CCND2表达检测 流式细胞仪细胞周期检测结果发现,3组喉癌细胞的细胞周期分布不同,主要区别在G0/G1期和S期的比例上。未处理组喉癌细胞G0/G1比例约为56.62%±4.07%,S期比例约为32.64%±2.64%,G2/M期比例为10.74%±1.45%;CM Tan ⅡA条件培养基处理的喉癌细胞G0/G1比例约为66.52%±4.06%,S期比例约为26.14%±2.63%,G2/M期比例为7.35%±1.50%;而CM miR-656-3p过表达条件培养基组的喉癌细胞G0/G1比例约为76.70%±4.04%,S期比例约为17.48%±2.87%,G2/M期比例为5.82%±1.17%(图4A)。
细胞周期蛋白CCND2的Western印迹检测结果发现,CCND2的表达水平由低到高依次为加入CM miR-656-3p过表达条件培养基的喉癌细胞、加入CM Tan ⅡA条件培养基处理的喉癌细胞以及未处理对照组喉癌细胞(图4B)。
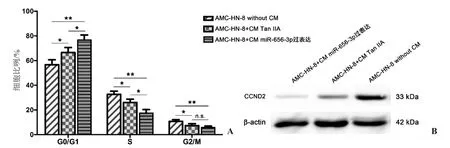
图4 CAFs外泌体miR-656-3p表达水平对喉癌细胞周期分布及周期蛋白CCND2表达的影响 A.3组喉癌细胞周期分布统计图:CAFs外泌体中miR-656-3p表达升高的程度与细胞周期检测中G0/G1期细胞的比例成正相关;B.3组喉癌细胞周期蛋白CCND2表达水平Western印迹检测:CAFs外泌体中miR-656-3p表达升高的程度与细胞周期蛋白CCND2的表达水平呈负相关。n.s.示P>0.05,*示P<0.05,**示P<0.01。
3 讨论
CAFs外泌体miRNAs的异常表达是肿瘤发生和侵袭、转移的重要机制,目前国内外尚未见喉癌CAFs外泌体miRNAs异常表达关键miRNAs的研究报道。本研究验证了前期高通量测序所发现的CAFs外泌体关键miR-656-3p对喉癌细胞生长和侵袭能力的影响,以及中药提取物丹参酮ⅡA通过上调CAFs外泌体miR-656-3p表达抑制喉癌细胞生长的功效。关于miR-656-3p在肿瘤中的研究报道文献非常少,而有关外泌体miR-656-3p的报道目前尚未见,表明外泌体miR-656-3p是新发现的具有较大发展前景的抗癌miRNA。
外泌体的提取目前有超速离心法、沉淀法及微流控芯片法等多种方法[12]。本研究采用的是超速离心法,该方法的优点为获得的外泌体不被分离试剂污染,且分离数量多;缺点为样品耗量大、耗时长。我们对超速离心法所收集的CAFs外泌体进行了经典的TEM、NTA和Western印迹鉴定,发现3项指标均符合外泌体的典型特征(图1),表明所收集的为合格的外泌体样本。
我们用基因过表达技术提高CAFs外泌体中的miR-656-3p表达水平,用RT-PCR验证过表达效果,同时发现丹参酮ⅡA作用后的CAFs外泌体中miR-656-3p表达水平也明显升高,虽然比基因过表达的升高程度小。表明丹参酮ⅡA可能起到与过表达技术类似的效果。
进一步用体外细胞培养的方法验证CAFs外泌体中表达上调的miR-656-3p是否对喉癌细胞的增殖和侵袭生物学特性起到抑制作用,我们发现miR-656-3p表达上调的CAFs外泌体加入到喉癌细胞培养液中之后,喉癌细胞的增殖和侵袭能力都明显下降,表明CAFs外泌体确实对喉癌细胞的增殖和侵袭能力发挥了调控作用。
我们通过TargetScan、miRTarBase、miRDB及miRWalk 4个生物信息学预测软件,发现细胞周期蛋白CCND2 (cyclin D2)是miR-656-3p 4个软件共同预测的靶基因。CCND2是重要的细胞周期调控蛋白,决定细胞能否由G1期进入S期。CCND2由290个氨基酸组成,第56~141位氨基酸为保守序列,称为细胞周期蛋白盒,与细胞周期蛋白依赖性激酶CDK6(也是miR-656-3p的靶基因)相结合,形成有激酶活性的复合物并作用于抑癌基因和转录因子的复合物Rb-E2F,使Rb基团磷酸化,引起E2F脱落。脱落的E2F进一步促进与DNA合成有关的基因表达,启动DNA合成,进而驱动细胞由G1期限制点进入S期,最终推动细胞周期进程[13-14]。调控CCND2的上游miRNAs因肿瘤而异,骨肉瘤中调控CCND2的上游miRNAs为miR-2682-3p[15],而胰腺癌中为miR-373-3p[16]。但是,国内外尚未见miR-656-3p对CCND2发挥调控作用的研究报道。
本研究的初步结果发现,CAFs外泌体中miR-656-3p表达升高的程度与细胞周期检测中G0/G1期细胞的比例成正相关,与细胞周期蛋白CCND2的表达水平呈负相关,表明CAFs外泌体中miR-656-3p可能是通过抑制喉癌细胞CCND2的表达从而阻断了其从G0/G1期进入S期的进程。
丹参酮ⅡA是常用的抗肿瘤重要成分[17-18]。文献报道的主要抗肿瘤机制包括以下几个方面:①抑制肿瘤细胞增殖,即抑制细胞从G0/G1期向S期推进,将细胞周期阻滞于G2/M期或促进线粒体裂变;②诱导肿瘤细胞死亡,即通过调控BCL-2等凋亡相关基因或从线粒体途径诱导细胞凋亡,后者通过降低线粒体膜电位或促进细胞色素C释放来实现;③抑制肿瘤细胞侵袭和转移,即调控基质金属蛋白酶-2(matrix metalloproteinase 2,MMP-2)和MMP-9等细胞黏附分子的表达;④抑制肿瘤细胞多药耐药性,即下调肿瘤细胞多药耐药(multidrug resistance,MDR)蛋白的表达;⑤诱导肿瘤细胞分化,即通过调节细胞内分化相关蛋白的表达来实现[19]。
综上所述,本研究在前期研究喉癌CAFs原代培养及外泌体miRNAs高通量测序检测的基础上揭示了以下3个关键问题。第一,miR-656-3p是喉癌CAFs外泌体中的关键miRNA。其表达的缺失显著促进了喉癌细胞的生长,表明喉癌组织中CAFs外泌体miR-656-3p扮演的是抑癌基因的角色。第二,CAFs外泌体miR-656-3p到喉癌细胞CCND2轴是新发现的抑制肿瘤生长的关键通路。第三,通过基因过表达技术虽然能够上调CAFs外泌体中miR-656-3p的表达水平进而抑制喉癌细胞的生长和侵袭,但是基因过表达技术短期内难以在临床应用。而中药提取物丹参酮ⅡA也有类似的通过上调CAFs外泌体miR-656-3p表达来抑制喉癌细胞生长的作用。
本研究虽然发现丹参酮ⅡA 具有一定的抗肿瘤活性,但其作用机制尚不明确,尤其是通过何种机制上调CAFs外泌体miR-656-3p表达的机制;此外,本研究都是通过体外细胞培养实验来验证的,没有体内成瘤实验的验证。这些都有待今后进一步深入研究。

