眼部受累的巨细胞动脉炎临床及影像特征分析△
陈倩 陈伟民 冯超逸 龚德山 张炯 毕颖文 常青 董建鸿 孙平 孙兴怀,7 田国红,7
[1.复旦大学附属眼耳鼻喉科医院眼科 上海 200031;2.上海德济医院神经内科 上海 200331;3. 上海德济医院神经外科 上海 200331;4.复旦大学附属华山医院风湿科 上海 200040;5.复旦大学附属眼耳鼻喉科医院病理科 上海 200031;6.上海市徐汇区中心医院眼科 上海 200031;7.国家卫健委及中国医学科学院近视眼重点实验室(复旦大学) 上海市视觉损害与重建重点实验室(复旦大学) 上海 200031]
巨细胞动脉炎(giant cell arteritis,GCA)是一种大血管炎,好发于50岁以上白种人,国人较少见,常累及主动脉及其分支,尤其是脑部分支。眼部可出现永久性视力丧失,眼外临床表现包括头痛、下颌跛行、头皮触痛、发热、消瘦以及风湿性多肌炎症状,均与颅脑血管缺血及全身炎症综合征有关[1-2]。
临床上,GCA并无特异性实验室检查,被视为诊断金标准的颞动脉活检阳性率低至50%[1],国内患者颞动脉活检实施比例较低,因此诊断颇具挑战性。本研究目的在于收集国人眼部受累的GCA患者的临床特征、实验室检查结果及影像学改变,探讨非侵入性检查手段的临床诊断价值。
1 资料与方法
1.1 资料 2016年1月~2021年6月因眼部症状就诊于复旦大学附属眼耳鼻喉科医院神经眼科门诊、最终确诊为GCA患者共15例。病例诊断参考1990年美国风湿病学会制定的5项诊断标准:年龄在50岁以上;新近发生的头痛;颞动脉触痛或搏动减弱;红细胞沉降率(erythrocyte sedimentation rate,ESR;简称血沉)≥50 mm/h;颞动脉活检表现为以单核细胞或粒细胞浸润为特征的血管炎,常伴多核巨细胞。5项中至少符合3项可确诊为GCA[3]。
1.2 方法 收集并分析患者症状、眼部体征、血液检查结果、眼部影像学检查、颞动脉彩色多普勒超声(简称彩超)、眼眶增强磁共振成像(magnetic resonance imaging,MRI)以及颞动脉活检病理结果。
2 结果
2.1 一般情况 15例患者一般情况见表1。患者性别比,男∶女=2∶1;平均年龄为(77.0±8.5)岁(64~90岁)。15例共22眼,单眼8例,双眼同时或先后发病7例。眼别比,右∶左=1∶1。中位视力为光感(LP),其中无光感(NLP) 10眼,LP/手动(HM) 5眼,0.05~0.1共4眼,0.2~0.6共3眼。患者眼外症状主要为头痛14例(93.3%)、体重减轻8例(53.3%);其他症状包括关节痛2例、头皮触痛2例、下颌跛行1例、多次脑梗死伴肾功能不全1例;无全身症状1例。

表1 15例GCA患者临床特征
2.2 眼部体征 视盘苍白水肿15眼,视盘周脉络膜萎缩6眼,盘沿出血4眼,视盘萎缩苍白4眼,棉毛斑4眼,视网膜睫状动脉阻塞2眼(图1)。7例双眼病例中,3例表现为一眼视盘苍白水肿、另一眼视盘萎缩,2例双眼视盘苍白水肿,1例一眼视盘苍白水肿合并睫状动脉阻塞另一眼视盘萎缩,1例双眼棉毛斑。

图1 GCA患者眼底改变 A.视盘周棉毛斑;B.视盘苍白水肿伴视盘周脉络膜萎缩;C.视盘苍白水肿伴盘周线状出血;D.视盘苍白水肿伴视网膜睫状动脉阻塞。
2.3 血液学检查 15例均行血常规、ESR及C反应蛋白(C-reactive protein,CRP)检测,异常例数及异常值均值见表2。白细胞增高9例(60%),红细胞及红细胞比容降低12例(80%),血红蛋白降低11例(73.3%),血小板增高4例(26.7%),血小板比容增高9例(60%),中性粒细胞百分比增高9例(60%),单核细胞百分比增高7例(46.7%)。ESR如以20 mm/h为标准则15例均增高(100%),但若参照文献进行年龄、性别校正,以Miller公式为标准[男性正常值=年龄/2;女性正常值=(年龄+10)/2],则增高者为11例(73.3%);以Hayreh公式为标准[男性正常值=17.3+(0.18×年龄);女性正常值=22.1+(0.18×年龄)],则增高者为13例(86.7%)。15例CRP均增高(100%)。异常结果均值详见表2。
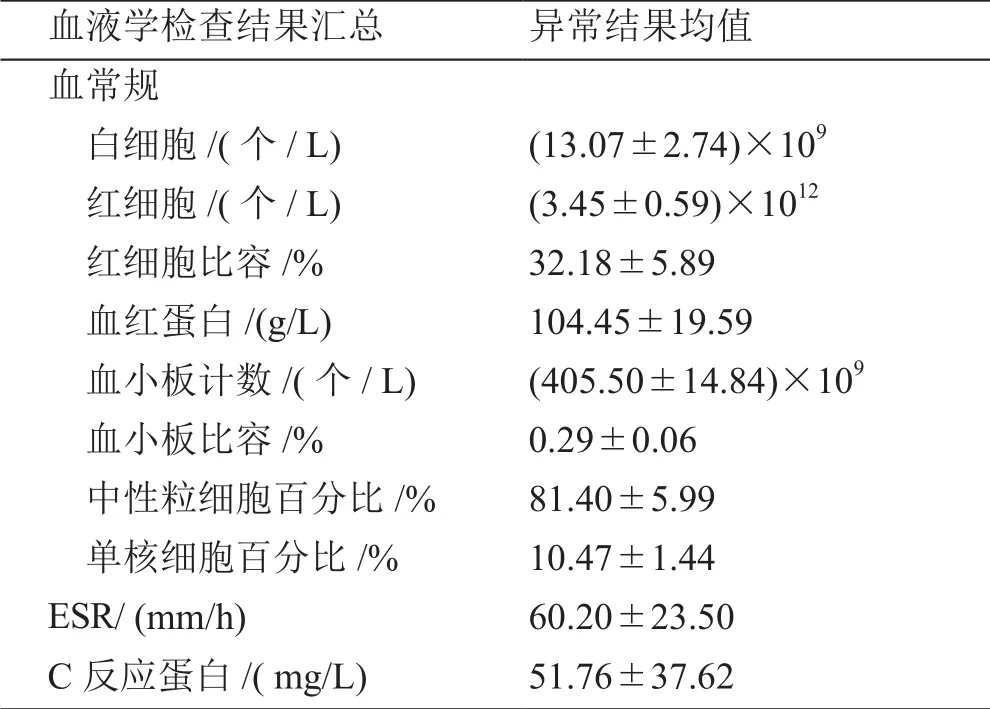
表2 GCA患者血液检查异常结果
2.4 眼部影像学检查 5例完成视野检测,2例(3眼)显示中心视野缺损,3例分别为单眼下方缺损、颞侧缺损和向心性缩小。11眼完成光学相干层析成像(optical coherence tomography,OCT)检查,8眼显示视盘及视网膜内层水肿,2眼显示为视网膜内层水肿,1眼显示为视网膜萎缩变薄(图2A~C)。因GCA患者大多全身情况不佳,仅2例行荧光素眼底血管造影检查,1例视盘及脉络膜充盈迟缓伴睫状动脉阻塞;1例视盘充盈迟缓。3例行高频B超检查显示视神经周围球后间隙增宽(图2D)。

图2 GCA患者OCT及高频B超 A.视盘神经纤维层水肿增厚(箭头);B.内层视网膜萎缩变薄(箭头);C.神经纤维层水肿增厚伴内层视网膜水肿(箭头);D.视盘周围球后间隙增宽(箭头)。
2.5 彩超颞浅动脉检测 15例中14例行颞浅动脉彩超检测,检测双侧耳前颞浅动脉主干管壁厚度及管腔直径,结果显示12例双侧颞浅动脉、1例单侧颞浅动脉管壁不同程度增厚(阳性率92.9%),表现为管壁毛糙、厚薄不均、弥漫性增厚或管腔节段性缩窄,部分病例有钙化斑,颞浅动脉横断面可见“晕环征”(图3)。颞浅动脉平均管壁厚度为(0.49±0.12)mm(0.25~0.75 mm),平均管腔直径为(1.36±0.42)mm(0.74~2.5 mm)。

图3 GCA患者颞浅动脉多普勒超声 A.纵切面管腔节段性缩窄(箭头);B.纵切面管壁弥漫性增厚(箭头);C.横断面晕环征(箭头)。
2.6 眼眶增强MRI及其他影像学检查 GCA患者中9例行眼眶增强MRI检查,均见视神经鞘膜强化(图4),阳性率100%,8例见脑萎缩,3例可见颞浅动脉管壁增厚强化(33.3%)。1例患者CTA检查显示双侧颈外动脉狭窄,1例行磁共振血管成像(magnetic resonance angiography,MRA)见一侧大脑中动脉狭窄。

图4 GCA患者眼眶增强MRI A.视神经鞘膜强化(箭头);B.颞浅动脉管壁增厚强化(箭头)。
2.7 颞浅动脉活检 共有8例患者行颞浅动脉活检,7例显示阳性病理结果(87.5%),表现为管腔狭窄、管壁炎性细胞浸润伴多核巨细胞形成(图5)。

图5 颞浅动脉活检病理HE染色 大图示颞浅动脉管壁增厚(箭头间);右下角小图为大图中环形区域放大图,箭头示多核巨细胞。
3 讨论
GCA发病率具有较大人种差异,好发于高加索人种。北欧诸国发病率尤高,50岁以上人群发病率均在20/100 000以上,以挪威最高,达32.4/100 000,且女性比例远高于男性[4-6]。在亚洲,本病报道较少,1997年日本报道50岁以上人群发病率仅为1.47/100 000,且在亚洲各国为数不多的病例报道中较少显露女性优势[7]。
本组病例中女性患者也明显少于男性,眼外临床表现以头痛(93.3%)和体重减轻(53.3%)为主,而白种人中常见的下颌跛行、头皮触痛、发热、风湿性多肌痛等症状均少见。典型临床症状的缺乏使得国人GCA多诊断困难,本组中1例患者眼部症状出现数年前已相继出现多次脑梗死、关节痛及肾功能不全,辗转于多科室而始终未能明确诊断,及至出现眼部表现才成为疾病诊断的突破口。文献[8]报道中,约20%的GCA患者可仅有眼部表现而无其他系统性症状,此类病例诊断更具挑战性。因此,熟悉GCA眼部病变表现有利于促成不典型病例诊断的确立。
文献报道中,80%~90%的眼部GCA表现为前部缺血性视神经病变(anterior ischemic optic neuropathy,AION)[9-10],本组病例中达到90.9%(20/22)。典型眼底改变为特征性的、白垩样视盘苍白水肿,由睫状后短动脉炎症梗死造成视盘极度缺血所致,B超所见部分病例视神经周围球后间隙增宽应与严重睫状后动脉炎症有关。由于供应视盘区的睫状后短动脉有多根,若仅有部分分支梗死,则会形成节段性视盘水肿及相应视野缺损。而盘周脉络膜萎缩与视盘周脉络膜慢性缺血有关。
GCA虽为大血管炎症,但2012年修订的关于系统性血管炎命名共识中认为GCA可累及各级动脉[11]。当AION伴有视网膜受累时应高度怀疑GCA可能性。文献报道中常见视网膜受累包括视网膜中央动脉阻塞、睫状视网膜动脉阻塞以及视网膜棉毛斑。GCA中视网膜中央动脉阻塞发生率约为14%;睫状视网膜动脉尽管在人群中少见,但拥有者发生GCA时绝大多数可受累,因其源于睫状后动脉循环所致,OCT上可见黄斑区视网膜内层水肿;棉毛斑与血小板微栓塞或视网膜节细胞轴突轴浆流局灶堆积有关,分布常以视盘为中心[12-16]。本组病例中有4眼伴棉毛斑、2眼伴有睫状视网膜动脉阻塞却并未发现视网膜中央动脉阻塞,可能与国内对GCA认识不足,多将视网膜中央动脉阻塞归因于动脉硬化微血管栓塞所致。GCA中罕见视网膜分支动脉阻塞者,原因与视网膜分支动脉缺乏内弹力层有关[17],在本组病例中也的确未发现视网膜分支动脉阻塞患者。
到目前为止,并无特异性生物化学标志物可以标识GCA,但ESR和CRP增高可提示系统性炎症存在。有文献[18]报道,两者在颞动脉活检阳性患者中灵敏度分别达到86.9%和84.1%。在本组病例中,ESR值经2种方法矫正后异常率分别达73.3%和86.1%,CRP异常率达100%。除此之外,本组病例血常规检查显示出较高的贫血(红细胞计数及红细胞比容降低,血红蛋白降低)及血小板计数或血小板比容增高比例,部分病例白细胞计数、中性粒细胞比例及单核细胞比例增高。文献[19]报道中也将贫血、血小板升高结合ESR、CRP升高作为提示GCA可能的生物化学指标。
尽管ESR和(或)CRP增高对于GCA具有提示意义,但其增高也可见于感染、恶性肿瘤、糖尿病及自身免疫性疾病。颞浅动脉活检虽然是诊断金标准,但阳性率并不高,且在国内实施率不高。因此,影像学检查在GCA诊断与鉴别诊断中具有重要价值。本组病例中活检比例不足50%,7例凭借临床特征及典型影像学改变明确诊断。欧洲风湿学会将颞动脉彩超作为疑诊GCA的一线影像学检查,超声所见颞动脉“晕环征”为显著增厚的管壁所形成,该特征具有68%灵敏度和81%特异度[20]。本组中14例行颞动脉彩超检查,除“晕环征”外,颞动脉管壁增厚、毛糙以及管腔节段性缩窄也为阳性发现,其中7例选择彩超探及颞动脉改变严重侧作为活检取材侧,最终阳性率高达87.5%,这一做法也为文献[21]所推荐。但彩超有较大操作者依赖性,一定程度上限制了其在临床上的推广应用。近些年高分辨率MRI也作为GCA补充影像学检查手段,常见阳性发现包括视神经鞘膜强化、眶内血管及颞浅动脉强化、脑萎缩等[1]。
GCA发病急、预后差,第2眼常在7 d内发病,快速诊断和治疗可使约15%GCA患者免于永久性视力丧失[22]。因此,需要综合各种检查结果尽快作出诊断,颞动脉活检的实施不应延误临床治疗的开始。
总之,GCA是一种好发于老年人的血管炎,眼部受累以白垩样缺血性视神经病变为主,可累及视网膜;ESR和(或)CRP增高伴贫血及血小板增高具有提示意义;颞动脉彩超和增强MRI阳性结果有助于诊断确立;有条件者可行颞动脉活检帮助明确诊断。

