窄带成像技术在显微镜下CO2激光声带切除手术中的应用△
李丹凤 刘永收 岳波 胡鹏刚 石力
(空军军医大学西京医院耳鼻咽喉头颈外科 西安 710032)
CO2激光手术一般在显微镜下操作,因其在组织分离上更为精细,大大改善了术后的嗓音质量,而且避免了不必要的气管切开,因此近年越来越多地用于早期喉癌及癌前病变手术[1]。窄带成像技术(narrow band imaging,NBI)是利用窄带光谱显示黏膜下层血管,并根据黏膜下层血管形态变化判断局部黏膜病变情况的一种技术。最开始广泛用于胃镜下观察胃黏膜的病变[2],而后逐渐开始用于咽喉黏膜的观察[3],通过黏膜下层血管形态异常来分析局部黏膜的病变程度,在咽喉鳞癌早期癌变的筛查中具有特殊优势。本研究探讨NBI在CO2激光声带切除手术中的应用价值。
1 资料与方法
1.1 一般资料 2015年1月~2019年12月5年间,我院收治行CO2激光声带切除手术的累及单侧或双侧声带的不典型增生病变及T1N0M0声带癌患者141例,其中男性133例、女性8例;年龄24~84岁,平均(60.7±11.07)岁。按照是否在NBI引导下手术分为2组:常规手术组与NBI引导手术组。常规手术组75例,患者平均年龄为(61.6±11.20)岁,直接在显微镜下观察,确定黏膜切缘,进行CO2激光切除手术。NBI引导手术组66例,患者平均年龄为(60.8±10.77)岁,在显微镜下观察肿瘤情况,在NBI内镜引导下共同确定黏膜切缘。
常规手术组与NBI引导手术组的手术方式均参照2000年欧洲喉科学会内镜声带切除分类标准[4]实施。NBI内镜表现参照Ni等[5]报道的分型标准判断肿瘤与正常组织的分界。术前患者签署知情同意书。
1.2 手术方法 所有手术均采用气管插管全身麻醉,支撑喉镜撑开喉腔,充分显露病变区域。常规手术组:显露手术区域后,仔细吸除气道内分泌物,小心去除表面假膜,显微镜下观察声带肿物累及范围及边界,确定切除范围,以3 mm安全缘予以CO2激光切除术。NBI引导手术组:用可弯曲的NBI内镜通过支撑喉镜进入喉腔,近距离观察病变边界,并在显示屏上采集留取清晰的病变各边缘图像;进行CO2激光切除时,结合NBI内镜图像确定病变及各周边黏膜切缘范围。图1为2种方法显示肿瘤情况。
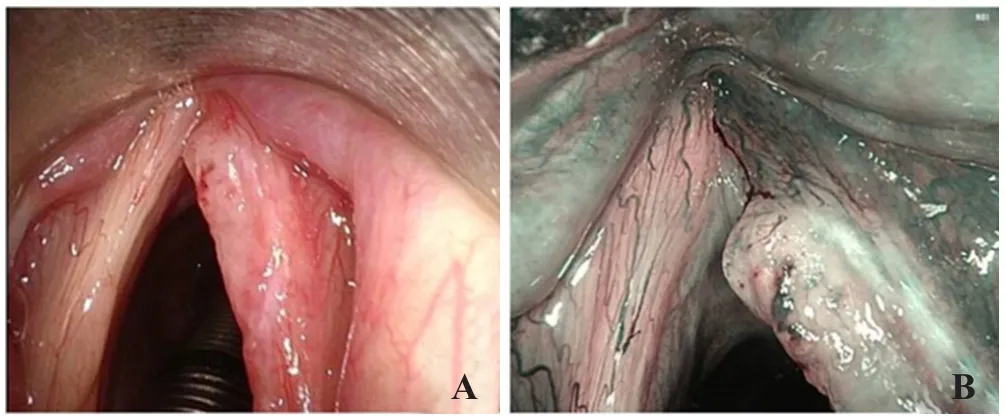
图1 2种方法显示肿瘤情况 A.显微镜下显示右声带肿瘤范围;B.显微镜下NBI内镜显示右声带肿瘤与正常黏膜边界。
2组患者按照上述操作,在第1次激光手术切除后,将切除肿瘤后的各周边声带组织送术中冷冻病检,判断相应部位肿瘤是否切除干净,如病检报告有不典型增生或者癌组织残留,均记为阳性,否则记为阴性。病检有阳性发现者均予以扩大切除,切除后切缘再次送病检,直至切缘阴性,以保证肿瘤切除干净。
1.3 观察项目 记录常规手术组与NBI引导手术组第1次激光切除手术后,切缘阳性的例数。
1.4 统计学处理 数据采用SPSS 19.0统计学软件进行处理,其中计数资料以例(%)表示,进行卡方检验,计量资料以表示,进行t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 2组患者一般特征比较 常规手术组中60例有吸烟史,15例无吸烟史;男性72例、女性3例。NBI引导手术组中49例有吸烟史,17例无吸烟史;男性61例、女性5例。根据术后病理及病变累及范围分为不典型增生、T1aN0M0、T1bN0M0三类。常规手术组不典型增生31例、T1a 21例、T1b 23例;NBI引导手术组不典型增生28例、T1a 16例、T1b 12例。常规手术组及NBI引导手术组间,性别、吸烟状态、病理分期差异均无统计学意义(P值均>0.05),具有可比性。
2.2 手术结果 常规手术组75例,其中64例患者在激光手术后第1次送检切缘为阴性,占85.3%;11例为阳性,占14.7%,包括9例切缘不典型增生和2例切缘见癌组织残留,均予以二次激光扩大切除至切缘阴性。NBI引导手术组66例,其中63例患者激光切除后第1次送检切缘为阴性,占95.5%;3例为不典型增生,占4.5%,同样予以继续扩大切除至切缘阴性。2组间差异有统计学意义(χ2=4.021,P=0.045,P<0.05)。
2.3 随访结果 所有患者术后定期随访,随访时间为6个月~4年。复发8例,均为男性,年龄60~82岁,平均(66.80±6.70)岁。其中常规手术组5例(0.7%),平均年龄为(68.20±7.25)岁;NBI引导手术组3例(4.5%),平均年龄为(64.7±4.64)岁。
3 讨论
NBI技术通过观察黏膜上皮内乳头样毛细血管袢的紊乱程度来判断咽喉黏膜病变的恶性程度,在咽喉黏膜鳞癌的鉴别方面已经日趋成熟[6]。吴俊华等[7]及邓敏鑫等[8]对下咽及喉腔黏膜一系列鳞癌及癌前病变做了系统性研究,分析了内镜下不同病理分级咽喉黏膜病变的规律。Davaris等[9]研究评估了广泛范围良性、恶性和增生异常等喉部病变,NBI的敏感度为93.3%。Klimza等[10]及朱国臣等[11]研究了NBI在指导下对于克服声带白斑患者遮蔽效应中的应用。Staníková等[12]研究了NBI声带白斑病变活检中的应用。以上均表明NBI技术在咽喉肿瘤诊断中具有相当重要的地位。目前,NBI技术已经广泛应用于喉良恶性病变的诊断中[13-14],用来指导门诊初治患者喉腔肿瘤性质的判断,以及术后患者的随访观察等。上述NBI内镜技术多用于术前或门诊诊断,在表面麻醉下探查喉腔肿瘤情况。但是由于声门区位置深在,而且因为局部肿瘤和炎症的影响,分泌物更易在声带表面潴留,加上有些患者配合较差等因素,导致表面麻醉时的NBI内镜检查有时会受到限制。另外,表面麻醉时声带处于自然状态,与支撑喉镜下撑开声门后的声带紧张状态不同,因此术前表面麻醉时肿瘤范围及切缘的确定与术中撑开喉腔以后的视野可能会存在偏差。
Farah[15]将NBI技术用于口腔癌切除手术前确定肿瘤切缘。Farah等[16]比较了NBI引导下切除的肿瘤核心区与正常组织miRNA和mRNA表达差异,也证实了口腔鳞癌手术中,以NBI确定的手术切缘具有更少的分子异常。因此,术中再次NBI检查是十分有必要的。Shan等[17]在开放的喉切除手术中也用到NBI技术检查喉咽黏膜的残余病灶,但在实际应用中,NBI成像易被血液污染,开放性手术出血较多,手术中也很难彻底止血,影响了NBI内镜观察的效果。而且NBI内镜的波长适合用来确定黏膜表面切缘[18],需要开放性喉切除手术的喉癌往往肿瘤在局部浸润程度较深,因此在开放性喉切除手术中应用是相对受限的。Piersiala等[19]用NBI技术评估T2、T3期声门癌激光切除后剩余黏膜的边缘,发现黏膜局部烧灼改变了切缘附近的微血管形态,可能造成NBI喉镜下对于肿瘤近端微小病灶的分辨能力下降。
因此我们采用全身麻醉后,支撑喉镜下暴露手术区域,显微镜下小心去除表面分泌物及假膜之后,在CO2激光切除前,术中以NBI 内镜近距离观察病变的范围与边界,与显微镜下观察同时评估,则能够更精确地确定适合激光切除的手术范围。另外,当声门癌超过声带范围,尤其是累及喉室、室带时,单纯显微镜下切除病变,由于操作距离、直线视野等因素的影响,对于喉室、前连合、声门下等褶皱区域的切除容易评估不够,加上肿瘤表面假膜、角化等因素的影响,造成术前检查时对肿瘤范围评估不够。而术中显微镜下清除褶皱区域的潴留分泌物及假膜后,使用弯折的NBI内镜不仅能够进一步仔细检查肿瘤边缘的情况,还能够近距离观察喉室及声门下等褶皱区域的肿瘤侵犯范围,从而提高一次手术成功率,减少冷冻病理次数,减少麻醉及手术时间。
本次回顾性分析研究结果显示,NBI引导下CO2激光声带切除手术,比常规CO2激光声带切除手术时第1次切缘送检阳性率明显减少,也证明了NBI引导下联合显微镜同时确定肿瘤切缘有较高的准确性。本研究统计中NBI引导下仍有一定的漏检率,可能与肿瘤黏膜下生长以及局部坏死性病变、炎性反应等[20]导致局部黏膜上皮内血管袢异常变化不明显有关。而且,为了防止肿瘤切除不彻底,将冷冻切缘不典型增生划归为阳性切缘进行了二次切除。另外,因为本文中病例的基底切缘不是按照NBI图像来决定的,因此未对基底切缘与NBI图像的关系进行讨论。
术后随访而言,由于患者入院时间不同,一部分患者随访时间未超过1年,因此所得结果尚不能说明2组患者在复发率上有无差别,需要长期随访才能得出有意义的结论。
总之,NBI引导技术在CO2激光声带切除手术中具有一定的实用价值。但因本研究为回顾性研究,且病例数有限,缺乏前瞻性的大宗病例资料研究。因此,NBI引导下CO2激光手术技术在其他类型与分期的喉癌、下咽癌手术中的应用,以及能否代替术中冷冻病理,在切除病变的同时尽可能保护正常声带黏膜,促进嗓音最优化恢复,仍需要进一步研究。同时,NBI引导下手术对手术医师瞬时记忆的经验和能力要求也比较高,如果后期能够应用NBI光源耦合的显微镜进行激光手术,将可能得到更为精确的研究结果。

